Show available content in
Abstract
肠道菌群是指寄居在肠道内数量庞大、种类繁多的微生物群。遗传、环境因素(如运动、饮食)和早期生活(如婴儿期的喂养方式)等均可影响肠道菌群在机体内的生态平衡。肠道生态失调与肠外疾病(如帕金森综合征、骨质疏松、自身免疫性疾病等)相关,故肠道菌群的紊乱可能是这些疾病发病的原因之一。运动对多种疾病有益处,肠道菌群参与神经系统、运动系统、免疫系统的调控。肠道菌群可以通过肠-脑轴、肠-肌轴、免疫等途径影响机体的健康状态;中等强度的有氧运动可以增加肠道菌群的数量,改变菌群丰度,但短期运动对菌群的α多样性无明显影响,抗阻运动对于肠道菌群亦无明显的调控作用。
Keywords: 肠道菌群, 运动, 代谢产物, 生态平衡, 生态失调
肠道菌群(gut microbiota,GM)是人体最大的微生态系统,肠道内定殖了超过1014个细菌,其基因组中的基因数量约为人类基因组基因总数的150倍,GM与人体相互依赖,影响多个系统(包括肠神经系统、肠内分泌系统、免疫系统等),在食物消化、营养素摄入、抵抗外来致病微生物入侵等方面发挥着重要的作用[1]。GM的组成会受到多种因素的影响,如遗传、早期生活(如母体感染、分娩方式、婴儿期喂养方式和抗生素的使用)和环境因素(如运动、饮食、压力、童年逆境)等[2]。有趣的是,用餐时间也会影响GM的组成[3];随着年龄的变化,GM的组成同样会发生改变[4]。即使在生活习惯非常相似的同质人群中,GM的组成也表现出高度的异质性[5]。当前,横断面研究[6-7]显示生态失调与肠外疾病(如帕金森综合征、骨质疏松、痴呆、自身免疫性疾病等)相关,但GM的组成与疾病发病和病程之间的因果关系仍有待纵向研究来证实。美国肠道项目(American Gut Project)研究[8]表明适度运动可重塑GM的组成和功能,改善老年人的肠道环境。本文主要从GM对机体的调控作用入手,阐述运动如何影响GM及其调控机制。
1. GM对机体的调控
1.1. GM对神经系统的调控
GM在肠道和大脑之间发挥调节作用。大脑和肠道可以通过中枢神经系统(central nervous system,CNS)、肠神经系统(enteric nervous system,ENS)、自主神经系统(autonomic nervous system,ANS)和下丘脑-垂体-肾上腺(hypothalamic-pituitary-adrenal,HPA)轴进行交流[9]。GM通过胃肠道将摄入的营养物质成分(如维生素、矿物质、碳水化合物、脂肪)信息传递给CNS,进而诱导与饮食和能量状况相关的全身反应[10]。GM的代谢产物也可影响ENS的功能,如短链脂肪酸(short-chain fatty acid,SCFA)、次级胆汁酸(bile acid,BA)、色氨酸代谢物、叶酸和γ-氨基丁酸(γ-aminobutyric acid,GABA)等可影响神经递质代谢[11]。SCFA分泌到肠腔,通过上皮屏障,释放到血液中,到达外周组织和器官;SCFA通过激活G蛋白偶联受体(G protein-coupled receptors,GPR)如GPR41和GPR43促进肠道L细胞分泌肽YY(peptide YY,PYY)、胰高血糖素样肽-1(glucagon like peptide-1,GLP-1)[12]和5-羟色胺(5-hydroxytryptamine,5-HT)[13]的释放,介导肠-脑轴的交流。GM通过其代谢物可与大脑建立双向交流,如GM代谢产物可以穿过血脑屏障(blood-brain barrier,BBB),进而影响迷走神经或诱导外周免疫。此外,GM还可以通过调节肠道内分泌细胞[如肠嗜铬细胞(enterochromaffin cell,ECC)]活性来介导肠-脑轴的交流[14]。肠-脑轴是一个重要的信号通路,当它受到干扰时,会导致各种免疫相关、代谢性和精神疾病[15]。研究[15]表明,与GM正常的无病原体小鼠相比,无菌小鼠表现出更高的BBB通透性,这与负责调节内皮组织屏障功能的紧密连接蛋白(tight junction protein,TJP)Occludin和Claudin-5表达减少有关。
综上所述,GM参与神经系统的调控,并且影响神经递质的合成、释放,支持了肠-脑轴假说,部分解释了某些神经系统疾病的机制和GM紊乱现象。
1.2. GM对运动系统的调控
GM的组成与多样性可能是肌肉代谢与功能的决定因素[16]。在大鼠肌少症模型中发现,与年龄相关的骨骼肌质量衰退与粪便中某一独特的微生物群有关,肌少症大鼠还表现出不同的粪便微生物群功能,涉及营养素生物合成和分解代谢的细菌基因表达重排[17]。GM可以通过某些营养素敏感通路影响肌肉代谢,如哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)或腺苷酸活化蛋白激酶(adenosine 5-monophosphate-activated protein kinase,AMPK)。mTOR和AMPK都是营养素敏感型细胞代谢主调节因子,调节体内多种功能稳态,如生酮、肌肉分解/合成代谢和脂肪生成[18]。GM产生的SCFA可以激活肌肉细胞中的AMPK;循环中的脂多糖(lipopolysaccharides,LPS)可以同时激活肌肉Toll样受体(Toll-like receptor,TLR)4和TLR5,促进核因子κB(nuclear factor kappa-B,NF-κB)的活化,产生炎症细胞因子[13]。在动物实验[19]中,与有GM的无病原体小鼠相比,无菌小鼠由于骨骼肌萎缩而显示出骨骼肌质量减少。16S核糖体核糖核酸(16S ribosomal ribonucleic acid,16S rRNA)测序显示:与健康对照组相比,肌少症前期与肌少症者GM中毛螺菌属、梭形杆菌属、罗氏菌属、真杆菌属和蓝绿藻菌属的数量明显减少,而乳酸杆菌的数量和LPS的生物合成增加[20]。
综上所述,GM及其代谢产物可以直接或通过对某些细胞因子的调控间接影响肌肉的合成与分解代谢。上述研究结果为肠-肌轴假说提供了证据,部分解释了肌少症患者可能的发病原因——GM紊乱。
1.3. GM对免疫系统的调控
GM中含有大量的细菌,包括无害的、共生的或潜在的病原体,这意味着GM可能通过与免疫系统的交流,参与调节无害和有害细菌之间的微调平衡[21]。GM参与机体的免疫成熟和抗感染保护,如微生物可以参与免疫系统识别并且区分有益菌和有害菌;GM可以直接或间接影响树突状细胞和巨噬细胞的功能,调节T细胞的活性,并通过上皮细胞诱导B细胞成熟[1]。胃肠道(gastrointestinal tract,GIT)除了进行营养素的消化和吸收,还发挥着肠道屏障的作用,可防止GIT中的不良物质(如病原体、膳食抗原和微生物群)进入体内。肠道屏障是复杂的,覆盖在肠上皮的黏液层在管腔和组织之间形成了物理屏障;肠上皮细胞分泌各种抗菌物质,如溶菌酶和防御素,形成了化学屏障,防止微生物群和组织之间的接触;免疫屏障包括由固有层的浆细胞分泌的免疫球蛋白A(immunoglobulin A,IgA),以及位于固有层和肠道相关淋巴组织中免疫细胞[22]。GM的代谢产物三甲胺(trimethylamine,TMA)吸收入血后进入肝脏,由肝脏酶——黄素单氧酶3(flavin monooxygenase3,FMO3)氧化,进而生成氧化三甲胺(trimethylamine N-oxide,TMAO)[23]。研究[24]认为TMA对内皮有不良影响,可破坏细胞骨架排列,诱发代谢应激,最终损害内皮屏障的完整性。健康肠道中的GM在血液中释放少量的LPS以维持宿主免疫系统的正常运转[25]。在正常情况下,肠道屏障可以防止LPS易位[26]。一些疾病状态以肠通透性增加为特征,各种营养因素和外部刺激可以使肠道屏障遭到破坏。更重要的是,大多数宿主免疫细胞驻留在肠道相关淋巴组织中,它们可以被激活并导致局部炎症,循环中的LPS也可以通过LPS结合蛋白(LPS binding protein,LBP)/TLR4信号通路激活免疫细胞,进入肝脏、脂肪组织和骨骼肌等,从而导致全身性炎症[26]。生态失调将会导致机体对共生菌的免疫耐受丧失、上皮屏障功能受损以及抗炎Treg淋巴细胞和促炎Th17淋巴细胞激活失衡[6]。体内和体外研究表明,特定的肠道细菌(乳酸杆菌和双歧杆菌)可以增加全身氨基酸的可用性,并在肠道内引发抗炎反应[27],且GM可通过刺激上皮细胞的增殖和产生各种抗菌分子来发挥保护功能,以避免病原体在GIT的定植[21]。此外,拟杆菌门与血浆炎症标志物LBP、C-反应蛋白(C-reactive protein,CRP)和肿瘤坏死因子-α(tumor necrosis factor-alpha,TNF-α)呈负相关,表明拟杆菌门可能在炎症调节中发挥作用[28]。
综上所述,当各种因素导致肠道通透性增加时,病原体将会通过肠道屏障进入体内,导致机体处于炎症状态。健康、平衡的GM可以识别病原体,防止病原体的定植并引起抗炎反应,保护机体。
2. 运动与GM
当前,普遍认为富含纤维的膳食模式有助于GM结构和功能的改变[29],且短期食用完全由动物性或植物性食物构成的膳食就会改变微生物群落结构,而不受其基因表达的个体差异影响[30]。运动也被认为对肠道健康和免疫力有J型曲线的影响,适量的运动对解决与肠道通透性和炎症有关的问题有积极作用,但持续高强度运动可能会产生有害的影响[18]。
2.1. 高强度运动对GM的影响
Tarracchini等[31]对207个公开获得的来自运动员和健康非运动员的粪便样本的鸟枪法宏基因组测序数据进行了荟萃分析,结果表明:与非运动员相比,运动员的GM显示出更好的抗炎作用,且GM中有益细菌的丰度增加。但是更多的微生物群α多样性并不总是与肠道健康相关,也可能与潜在有害细菌的生长有关,如马拉松运动员肠道中潜在致病菌韦荣球菌属的丰度增加[32],优秀耐力运动员经常在运动中或运动后出现各种GIT疾病[18]。一项系统综述[32]发现,运动员比非运动员的GM更多样化,但产生SCFA和乳酸的细菌丰度相对较低,表明高强度运动对GM的种群有不利影响。一项在长距离铁人三项运动中进行的研究[33]显示:超耐力运动后,LPS进入血液循环。因此,在肌肉损伤的情况下,LPS可能会引起细胞因子反应增加,导致运动员的GIT不适。从事长时间高强度体育运动的运动员表现出一种特殊的GM组成,其特征是参与炎症过程的细菌丰度更高,如嗜血杆菌和罗氏菌属、黏液菌属和瘤胃球菌属[34]。女性长跑运动员肠道细菌代谢产物琥珀酸盐浓度和粪杆菌属数量显著高于同龄健康女性[35],而琥珀酸盐的积累似乎可增加肠腔内的渗透压,降低肠道的吸水率,与肠道炎症相关。此外,高强度运动刺激血液从肠道再分配到肌肉,而血液的频繁再分配可能会通过内脏低灌注和缺血以及随后的再灌注潜在地扰乱GM[36]。GM与机体交流途径的总结见图1。
图1. 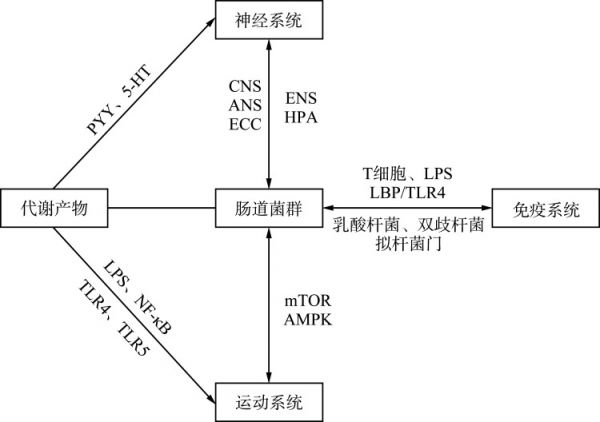
肠道菌群与机体交流途径
Figure 1 Gut microbiota communicates with the body
PYY: Peptide YY; 5-HT: 5-hydroxytryptamine; CNS: Central nervous system; ANS: Autonomic nervous system; ENS: Enteric nervous system; HPA: Hypothalamic-pituitary-adrenal; ECC: Enterochromaffin cell; LPS: Lipopolysaccharides; TLR4: Toll-like receptor 4; TLR5: Toll-like receptor 5; NF-κB: Nuclear factor kappa-B; mTOR: Mammalian target of rapamycin; AMPK: Adenosine 5-monophosphate-activated protein kinase; LBP: LPS binding protein.
总之,长时间的高强度运动不仅会导致肠道通透性增加,从而增加血浆LPS水平,而且还会引起免疫抑制[37]。关于GM与不同运动项目之间关系的报道很少,研究[38]显示:健美运动员体内粪杆菌属、梭状芽孢杆菌属和嗜血杆菌属细菌的比例高于专业跑步运动员;健美运动员体内亦检出数量很少的益生菌菌株,如长双歧杆菌以及产生SCFA的细菌,造成这种菌群丰度差异的原因很可能与饮食有关。
2.2. 中等强度运动对GM的影响
中等强度运动不会影响GM的多样性,但会影响其组成,如生成SCFA和乳酸的GM丰度增加,嗜黏蛋白阿克曼菌和颤螺菌属的相对丰度增加[32]。运动可以增加拟杆菌门的相对丰度,减少厚壁菌门的相对丰度,而且如果从生命早期开始进行运动,可能会产生更大且更持久的益处,但当停止运动后,对GM的影响逐渐消失[39]。Allen等[40]招募32名静坐少动的消瘦(n=18)和肥胖(n=14)女性参加为期6 周的耐力性运动训练(3 d/周),每天30~60 min,运动强度为60%~75%心率储备(heart rate reserve,HRR),结果显示:运动训练可以调节机体GM的组成和功能,且该变化独立于饮食;β多样性分析显示运动引起的GM改变与肥胖状态有关,即运动增加了消瘦者而不是肥胖者粪便中SCFA的浓度;此外,运动引起的GM变化在运动训练停止6周后在很大程度上被逆转。Resende等[5]招募了24名少动的男性,随机分为对照组和运动组,运动组每周进行150 min的中等强度[60%~65%峰值摄氧量(peak oxygen uptake,VO2peak)]有氧运动,结果显示:10周中等强度有氧运动能够改善非肥胖年轻男性的VO2peak,且VO2peak和体重指数(body mass index,BMI)与GM的组成相关。12周的中等强度快走训练可以增加健康老年妇女体内与改善心肺耐力相关的肠道拟杆菌门相对丰度,而躯干力量训练后肠道拟杆菌门相对丰度并无明显变化,此外,快走训练增加了粪便中SCFA浓度,略微降低了结肠腔内pH值,有利于拟杆菌类的生存[41]。Quiroga等[42]招募了39名肥胖儿童,旨在确定12周的抗阻和有氧联合训练对其GM和炎症的影响,结果显示:与健康儿童对照组相比,肥胖儿童拟杆菌门和变形杆菌门比例更高,厚壁菌门和放线菌门则相反,而运动可以使这种菌群分布模式逐渐趋向于正常。Bycura等[43]在探究不同运动对GM的影响时发现,经过8周中高强度的有氧运动和抗阻运动,有氧运动会使GM发生改变,且这种变化在运动2~3周时最为明显,但未能持续到8周;而抗阻运动组并未发现GM有明显变化。短期中等运动对GM的改善作用并不会一直存在,仅在最初的2~3周可能有明显改善作用(仅仅是改变其菌群丰度,而非改变其组成),且在结束运动6 周后,GM模式又恢复到原来的状态,提示可能需要长久的运动来维持健康的GM。此外,有氧运动对于GM的改善优于抗阻运动。
2.3. 运动影响GM的机制
有规律的运动对肠道来说是一种刺激应激源,引起有益于机体的反应,特别是在塑造GM的多样性和调节其分布方面[8]。不规律的力竭性或长时间训练对GM有负面影响,引起生态失调,可能会在一定程度上致使运动员免疫反应受损并影响健康[13]。
GM与增强GIT屏障密切相关,并参与正常的胃肠蠕动和肠道稳态[13]。运动干预有助于增强机体胃肠蠕动,促进粪便及时排泄,从而减少肠道黏膜与病原体和有害物质的接触时间,进而影响肠道内容物的特性,改变GM组成[1]。在生理和心理应激下,HPA轴的激活和随后分泌的各种激素(促肾上腺皮质激素、皮质醇、去甲肾上腺素、肾上腺素、多巴胺等)可能在肠道生态失调中发挥作用。运动刺激肌肉细胞产生白细胞介素6(interleukin-6,IL-6),循环中该细胞因子的水平升高,进而增强骨骼肌局部的葡萄糖摄取和脂肪酸氧化,促进胰岛素分泌,从而进一步增加肌肉细胞对葡萄糖的摄取;同时刺激肝脏葡萄糖输出和脂肪组织中脂肪酸释放,从而为运动肌肉提供能量底物并发挥抗炎作用[21, 44]。在动物试验[45]中,老年小鼠的肠道TJP(如Claudin-1、Occludin)在跑台运动后表达显著上调,且循环LPS水平显著下降。运动可增加肠道绒毛的厚度、高度和隐窝深度,进而通过紧密连接改善肠道屏障的完整性,减少肥胖对肠道菌群的影响[9]。在静坐少动的2型糖尿病(type 2 diabetes mellitus,T2DM)患者中,运动会增加细菌多样性和产生SCFA的菌群,这些变化可减少内毒素血症,促进SCFA和支链氨基酸(branched-chain amino acid,BCAA)的降解[12]。冲刺间歇训练(sprint interval training,SIT)与中等强度持续运动(moderate-intensity continuous training,MICT)均能降低全身和肠道炎症标志物(TNF-α、脂多糖结合蛋白)的水平,减少内毒素血症,且通过增加拟杆菌门和降低厚壁菌门/拟杆菌门比例来改善GM组成[25]。拟杆菌门可以抑制TLR-4和血管紧张素转换酶2(angiotensin-converting enzyme 2,ACE-2)依赖性信号转导,从而增强对促炎细胞因子的抵抗力[46]。嗜黏蛋白阿克曼氏菌(akkermansia muciniphila,Akk)与健康的GM有关,已知其在运动时丰度增加,这种细菌以肠内的黏蛋白结构为食,保障上皮屏障的完整性[26, 47]。由运动引起的心血管适应性变化可能通过减轻运动期间肠道灌注不足和缺氧来改善肠道屏障的完整性。从免疫的角度来看,长期运动与循环中促进肠道通透性的炎症细胞因子(如IL-6和TNF-α)减少有关。研究[48]表明:通过氧化还原信号转导(包括抗氧化和氧化损伤修复系统),规律运动诱导的对活性氧处理的适应有助于健康。有氧运动可以增加粪便中SCFA的浓度,从而略微降低结肠腔内的pH值,有助于拟杆菌门的定植生长[41]。肠道神经元中转录因子芳香烃受体(aryl hydrocarbon receptor,AhR)与GM协同作用,作为肠道环境和神经通讯之间的调节节点,调节GM与生理反应,而且AhR也与运动反应相关联[49],运动可能会通过对AhR的调控影响GM。
综上所述,运动可通过不同的影响机制(肠-脑轴、肠-肌轴、代谢产物)影响GM,进而调控机体的健康状态,其中涉及肠道环境、肠道屏障、GM组成、氧化应激等多途径。
3. 结 语
目前的研究表明,GM可以通过肠-脑轴、肠-肌轴、免疫等途径影响机体的健康状态。运动对机体健康的影响可能是通过其对GM的改善来介导的。中等强度的有氧运动可以增加GM的数量,改变菌群丰度;但短期运动对菌群的α多样性无明显影响;抗阻运动对于GM亦无明显的调控作用。
运动对于GM的调控机制包括:1)优化GM的组成;2)增加肠道蠕动速度,减少肠道黏膜与病原体的接触;3)改善肠道环境,如降低pH值,改善肠道绒毛性状和调节黏膜免疫,上调TJP,改善胃肠道屏障功能,减少内毒素血症;4)提高机体的抗氧化能力,增强免疫力,改善机体炎症状态;5)SCFA浓度及产生SCFA的菌群丰度增加;6)心血管适应;7)CNS、ENS、ANS、HPA轴的激活反作用于肠道,进而影响GM(图2)。
图2.
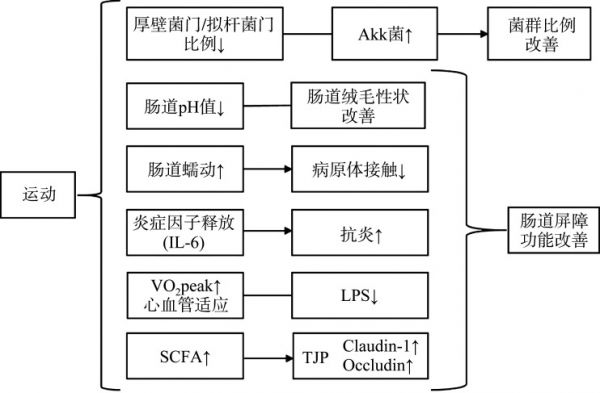
运动调控肠道菌群的机制
Figure 2 Mechanisms of exercise regulating gut microbiota
Akk: Akkermansia muciniphila; IL-6: Interleukin-6; VO2 peak: Peak oxygen uptake; LPS: Lipopolysaccharides; SCFA: Short-chain fatty acid; TJP: Tight junction protein.
基金资助
国家重点研发计划(2022YFC2010201)。This work was supported by the National Key Research and Development Program of China (2022YFC2010201).
利益冲突声明
作者声称无任何利益冲突。
作者贡献
高鑫 文献收集,论文撰写与修改;张培珍 论文指导与修改。所有作者阅读并同意最终的文本。
Footnotes
http://dx.chinadoi.cn/10.11817/j.issn.1672-7347.2024.230550
原文网址
http://xbyxb.csu.edu.cn/xbwk/fileup/PDF/202404508.pdf
参考文献
1. Zhang YW, Cao MM, Li YJ, et al. A narrative review of the moderating effects and repercussion of exercise intervention on osteoporosis: ingenious involvement of gut microbiota and its metabolites[J]. J Transl Med, 2022, 20(1): 490. 10.1186/s12967-022-03700-4. [DOI] [PMC free article] [PubMed] [Google Scholar] 2. Lee JE, Walton D, O’Connor CP, et al. Drugs, guts, brains, but not rock and roll: the need to consider the role of gut microbiota in contemporary mental health and wellness of emerging adults[J]. Int J Mol Sci, 2022, 23(12): 6643. 10.3390/ijms23126643. [DOI] [PMC free article] [PubMed] [Google Scholar] 3. Ramos Meyers G, Samouda H, Bohn T. Short chain fatty acid metabolism in relation to gut microbiota and genetic variability[J]. Nutrients, 2022, 14(24): 5361. 10.3390/nu14245361. [DOI] [PMC free article] [PubMed] [Google Scholar] 4. Strasser B, Wolters M, Weyh C, et al. The effects of lifestyle and diet on gut microbiota composition, inflammation and muscle performance in our aging society[J]. Nutrients, 2021, 13(6): 2045. 10.3390/nu13062045. [DOI] [PMC free article] [PubMed] [Google Scholar] 5. Resende AS, Leite GSF, Lancha Junior AH. Changes in the gut bacteria composition of healthy men with the same nutritional profile undergoing 10-week aerobic exercise training: a randomized controlled trial[J]. Nutrients, 2021, 13(8): 2839. 10.3390/nu13082839. [DOI] [PMC free article] [PubMed] [Google Scholar] 6. Ticinesi A, Lauretani F, Tana C, et al. Exercise and immune system as modulators of intestinal microbiome: implications for the gut-muscle axis hypothesis[J]. Exerc Immunol Rev, 2019, 25: 84-95. [PubMed] [Google Scholar] 7. 赵静晓, 王萍, 蒋敏敏, 等. 肠道菌群与甲状腺相关眼病[J]. 中南大学学报(医学版), 2023, 48(11): 1753-1759. 10.11817/j.issn.1672-7347.2023.230187. [DOI] [PMC free article] [PubMed] [Google Scholar]; ZHAO Jingxiao, WANG Ping, JIANG Minmin, et al. Gut microbiota and thyroid-associated ophthalmopathy[J]. Journal of Central South University. Medical Science, 2023, 48(11): 1753-1759. 10.11817/j.issn.1672-7347.2023.230187. [DOI] [PMC free article] [PubMed] [Google Scholar] 8. Zhang L, Liu Y, Sun Y, et al. Combined physical exercise and diet: regulation of gut microbiota to prevent and treat of metabolic disease: a review[J]. Nutrients, 2022, 14(22): 4774. 10.3390/nu14224774. [DOI] [PMC free article] [PubMed] [Google Scholar] 9. Ribeiro FM, Silva MA, Lyssa V, et al. The molecular signaling of exercise and obesity in the microbiota-gut-brain axis[J]. Front Endocrinol, 2022, 13: 927170. 10.3389/fendo.2022.927170. [DOI] [PMC free article] [PubMed] [Google Scholar] 10. Hashim HM, Makpol S. A review of the preclinical and clinical studies on the role of the gut microbiome in aging and neurodegenerative diseases and its modulation[J]. Front Cell Neurosci, 2022, 16: 1007166. 10.3389/fncel.2022.1007166. [DOI] [PMC free article] [PubMed] [Google Scholar] 11. Donati Zeppa S, Ferrini F, Agostini D, et al. Nutraceuticals and physical activity as antidepressants: the central role of the gut microbiota[J]. Antioxidants, 2022, 11(2): 236. 10.3390/antiox11020236. [DOI] [PMC free article] [PubMed] [Google Scholar] 12. Martínez-López YE, Esquivel-Hernández DA, Sánchez-Castañeda JP, et al. Type 2 diabetes, gut microbiome, and systems biology: a novel perspective for a new era[J]. Gut Microbes, 2022, 14(1): 2111952. 10.1080/19490976.2022.2111952. [DOI] [PMC free article] [PubMed] [Google Scholar] 13. Wegierska AE, Charitos IA, Topi S, et al. The connection between physical exercise and gut microbiota: implications for competitive sports athletes[J]. Sports Med, 2022, 52(10): 2355-2369. 10.1007/s40279-022-01696-x. [DOI] [PMC free article] [PubMed] [Google Scholar] 14. Zhang CX, Xue P, Zhang HY, et al. Gut brain interaction theory reveals gut microbiota mediated neurogenesis and traditional Chinese medicine research strategies[J]. Front Cell Infect Microbiol, 2022, 12: 1072341. 10.3389/fcimb.2022.1072341. [DOI] [PMC free article] [PubMed] [Google Scholar] 15. Rosa JM, Formolo DA, Yu JS, et al. The role of microRNA and microbiota in depression and anxiety[J]. Front Behav Neurosci, 2022, 16: 828258. 10.3389/fnbeh.2022.828258. [DOI] [PMC free article] [PubMed] [Google Scholar] 16. Giron M, Thomas M, Dardevet D, et al. Gut microbes and muscle function: can probiotics make our muscles stronger?[J]. J Cachexia Sarcopenia Muscle, 2022, 13(3): 1460-1476. 10.1002/jcsm.12964. [DOI] [PMC free article] [PubMed] [Google Scholar] 17. Siddharth J, Chakrabarti A, Pannérec A, et al. Aging and sarcopenia associate with specific interactions between gut microbes, serum biomarkers and host physiology in rats[J]. Aging, 2017, 9(7): 1698-1720. 10.18632/aging.101262. [DOI] [PMC free article] [PubMed] [Google Scholar] 18. O’Brien MT, O’Sullivan O, Claesson MJ, et al. The athlete gut microbiome and its relevance to health and performance: a review[J]. Sports Med, 2022, 52(Suppl 1): 119-128. 10.1007/s40279-022-01785-x. [DOI] [PMC free article] [PubMed] [Google Scholar] 19. Lahiri S, Kim H, Garcia-Perez I, et al. The gut microbiota influences skeletal muscle mass and function in mice[J]. Sci Transl Med, 2019, 11(502): eaan5662. 10.1126/scitranslmed.aan5662. [DOI] [PMC free article] [PubMed] [Google Scholar] 20. Kang L, Li PT, Wang DY, et al. Alterations in intestinal microbiota diversity, composition, and function in patients with sarcopenia[J]. Sci Rep, 2021, 11(1): 4628. 10.1038/s41598-021-84031-0. [DOI] [PMC free article] [PubMed] [Google Scholar] 21. Codella R, Luzi L, Terruzzi I. Exercise has the guts: How physical activity may positively modulate gut microbiota in chronic and immune-based diseases[J]. Dig Liver Dis, 2018, 50(4): 331-341. 10.1016/j.dld.2017.11.016. [DOI] [PubMed] [Google Scholar] 22. Riedel S, Pheiffer C, Johnson R, et al. Intestinal barrier function and immune homeostasis are missing links in obesity and type 2 diabetes development[J]. Front Endocrinol, 2021, 12: 833544. 10.3389/fendo.2021.833544. [DOI] [PMC free article] [PubMed] [Google Scholar] 23. Tacconi E, Palma G, de Biase D, et al. Microbiota effect on trimethylamine N-oxide production: from cancer to fitness-a practical preventing recommendation and therapies[J]. Nutrients, 2023, 15(3): 563. 10.3390/nu15030563. [DOI] [PMC free article] [PubMed] [Google Scholar] 24. Hoyles L, Pontifex MG, Rodriguez-Ramiro I, et al. Regulation of blood-brain barrier integrity by microbiome-associated methylamines and cognition by trimethylamine N-oxide[J]. Microbiome, 2021, 9(1): 235. 10.1186/s40168-021-01181-z. [DOI] [PMC free article] [PubMed] [Google Scholar] 25. Motiani KK, Collado MC, Eskelinen JJ, et al. Exercise training modulates gut microbiota profile and improves endotoxemia[J]. Med Sci Sports Exerc, 2020, 52(1): 94-104. 10.1249/MSS.0000000000002112. [DOI] [PMC free article] [PubMed] [Google Scholar] 26. Keirns BH, Koemel NA, Sciarrillo CM, et al. Exercise and intestinal permeability: another form of exercise-induced hormesis?[J]. Am J Physiol Gastrointest Liver Physiol, 2020, 319(4): G512-G518. 10.1152/ajpgi.00232.2020. [DOI] [PubMed] [Google Scholar] 27. Prokopidis K, Chambers E, Lochlainn MN, et al. Mechanisms linking the gut-muscle axis with muscle protein metabolism and anabolic resistance: implications for older adults at risk of sarcopenia[J]. Front Physiol, 2021, 12: 770455. 10.3389/fphys.2021.770455. [DOI] [PMC free article] [PubMed] [Google Scholar] 28. Valder S, Brinkmann C. Exercise for the diabetic gut-potential health effects and underlying mechanisms[J]. Nutrients, 2022, 14(4): 813. 10.3390/nu14040813. [DOI] [PMC free article] [PubMed] [Google Scholar] 29. Hill EB, Chen L, Bailey MT, et al. Facilitating a high-quality dietary pattern induces shared microbial responses linking diet quality, blood pressure, and microbial sterol metabolism in caregiver-child dyads[J]. Gut Microbes, 2022, 14(1): 2150502. 10.1080/19490976.2022.2150502. [DOI] [PMC free article] [PubMed] [Google Scholar] 30. David LA, Maurice CF, Carmody RN, et al. Diet rapidly and reproducibly alters the human gut microbiome[J]. Nature, 2014, 505(7484): 559-563. 10.1038/nature12820. [DOI] [PMC free article] [PubMed] [Google Scholar] 31. Tarracchini C, Fontana F, Lugli GA, et al. Investigation of the ecological link between recurrent microbial human gut communities and physical activity[J/OL]. Microbiol Spectr, 2022, 10(2): e0042022[2023-11-20]. 10.1128/spectrum.00420-22. [DOI] [PMC free article] [PubMed] [Google Scholar] 32. Dziewiecka H, Buttar HS, Kasperska A, et al. Physical activity induced alterations of gut microbiota in humans: a systematic review[J]. BMC Sports Sci Med Rehabil, 2022, 14(1): 122. 10.1186/s13102-022-00513-2. [DOI] [PMC free article] [PubMed] [Google Scholar] 33. Clauss M, Gérard P, Mosca A, et al. Interplay between exercise and gut microbiome in the context of human health and performance[J]. Front Nutr, 2021, 8: 637010. 10.3389/fnut.2021.637010. [DOI] [PMC free article] [PubMed] [Google Scholar] 34. Cataldi S, Bonavolontà V, Poli, et al. The relationship between physical activity, physical exercise, and human gut microbiota in healthy and unhealthy subjects: a systematic review[J]. Biology, 2022, 11(3): 479. 10.3390/biology11030479. [DOI] [PMC free article] [PubMed] [Google Scholar] 35. Morishima S, Aoi W, Kawamura A, et al. Intensive, prolonged exercise seemingly causes gut dysbiosis in female endurance runners[J]. J Clin Biochem Nutr, 2021, 68(3): 253-258. 10.3164/jcbn.20-131. [DOI] [PMC free article] [PubMed] [Google Scholar] 36. Jang LG, Choi G, Kim SW, et al. The combination of sport and sport-specific diet is associated with characteristics of gut microbiota: an observational study[J]. J Int Soc Sports Nutr, 2019, 16(1): 21. 10.1186/s12970-019-0290-y. [DOI] [PMC free article] [PubMed] [Google Scholar] 37. Clark A, Mach N. Exercise-induced stress behavior, gut-microbiota-brain axis and diet: a systematic review for athletes[J]. J Int Soc Sports Nutr, 2016, 13: 43. 10.1186/s12970-016-0155-6. [DOI] [PMC free article] [PubMed] [Google Scholar] 38. Mańkowska K, Marchelek-Myśliwiec M, Kochan P, et al. Microbiota in sports[J]. Arch Microbiol, 2022, 204(8): 485. 10.1007/s00203-022-03111-5. [DOI] [PMC free article] [PubMed] [Google Scholar] 39. Cataldi S, Poli L, Şahin FN, et al. The effects of physical activity on the gut microbiota and the gut-brain axis in preclinical and human models: a narrative review[J]. Nutrients, 2022, 14(16): 3293. 10.3390/nu14163293. [DOI] [PMC free article] [PubMed] [Google Scholar] 40. Allen JM, Mailing LJ, Niemiro GM, et al. Exercise alters gut microbiota composition and function in lean and obese humans[J]. Med Sci Sports Exerc, 2018, 50(4): 747-757. 10.1249/MSS.0000000000001495. [DOI] [PubMed] [Google Scholar] 41. Morita E, Yokoyama H, Imai D, et al. Aerobic exercise training with brisk walking increases intestinal Bacteroides in healthy elderly women[J]. Nutrients, 2019, 11(4): 868. 10.3390/nu11040868. [DOI] [PMC free article] [PubMed] [Google Scholar] 42. Quiroga R, Nistal E, Estébanez B, et al. Exercise training modulates the gut microbiota profile and impairs inflammatory signaling pathways in obese children[J]. Exp Mol Med, 2020, 52(7): 1048-1061. 10.1038/s12276-020-0459-0. [DOI] [PMC free article] [PubMed] [Google Scholar] 43. Bycura D, Santos AC, Shiffer A, et al. Impact of different exercise modalities on the human gut microbiome[J]. Sports, 2021, 9(2): 14. 10.3390/sports9020014. [DOI] [PMC free article] [PubMed] [Google Scholar] 44. Schnyder S, Handschin C. Skeletal muscle as an endocrine organ: PGC-1α, myokines and exercise[J]. Bone, 2015, 80: 115-125. 10.1016/j.bone.2015.02.008. [DOI] [PMC free article] [PubMed] [Google Scholar] 45. Shin HE, Kwak SE, Zhang DD, et al. Effects of treadmill exercise on the regulation of tight junction proteins in aged mice[J]. Exp Gerontol, 2020, 141: 111077. 10.1016/j.exger.2020.111077. [DOI] [PubMed] [Google Scholar] 46. Babszky G, Torma F, Aczel D, et al. COVID-19 infection alters the microbiome: elite athletes and sedentary patients have similar bacterial flora[J]. Genes, 2021, 12(10): 1577. 10.3390/genes12101577. [DOI] [PMC free article] [PubMed] [Google Scholar] 47. Imdad S, Lim W, Kim JH, et al. Intertwined relationship of mitochondrial metabolism, gut microbiome and exercise potential[J]. Int J Mol Sci, 2022, 23(5): 2679. 10.3390/ijms23052679. [DOI] [PMC free article] [PubMed] [Google Scholar] 48. Radak Z, Ishihara K, Tekus E, et al. Exercise, oxidants, and antioxidants change the shape of the bell-shaped hormesis curve[J]. Redox Biol, 2017, 12: 285-290. 10.1016/j.redox.2017.02.015. [DOI] [PMC free article] [PubMed] [Google Scholar] 49. Lensu S, Pekkala S. Gut microbiota, microbial metabolites and human physical performance[J]. Metabolites, 2021, 11(11): 716. 10.3390/metabo11110716. [DOI] [PMC free article] [PubMed] [Google Scholar] 

