首款口服斑秃新药、「渐冻人」症创新疗法…获批上市
据 Insight 数据库统计,本周(6 月12日-6月18日)全球共有41款创新药(含改良新)研发进度推进到了新阶段,14款申报临床。从成分类别角度来看,化药有22 款,占比高达 54%;此外,还涉及单抗、抗体类融合蛋白、siRNA等。 下面,Insight 将分别摘取国内外部分重点项目做介绍。
国内创新药进展
国内方面,本周共有35款创新药研发进度推进到了新的阶段,其中1款产品申报上市, 2款启动 III 期临床试验;首次公示临床试验的有15款,包括12款国产,3款进口。从成分类别来看,化药有 17 款,占比最高,近 50 %。
本周国内 15 款首次公示临床试验产品

来自:Insight 数据库
申报上市
信达生物:首款国产 PCSK9 单抗「托莱西单抗」申报上市
6 月 13 日,信达生物的 PCSK9 单抗「托莱西单抗」(研发代号:IBI306)申报上市获受理。值得注意的是,这是首款申报上市的国产 PCSK9 单抗,有助于打破进口垄断。
今年 2 月 17 日,信达生物宣布托莱西单抗的两项中国关键注册临床研究 CREDIT-1 研究和 CREDIT-4 研究达到主要研究终点,而此前在 2021 年 8 月,托莱西单抗的首项注册临床 CREDIT-2 研究也已经成功。至此,托莱西单抗已完成 3 项关键临床,向上市发起冲刺。
托莱西单抗 3 项注册临床试验最新数据
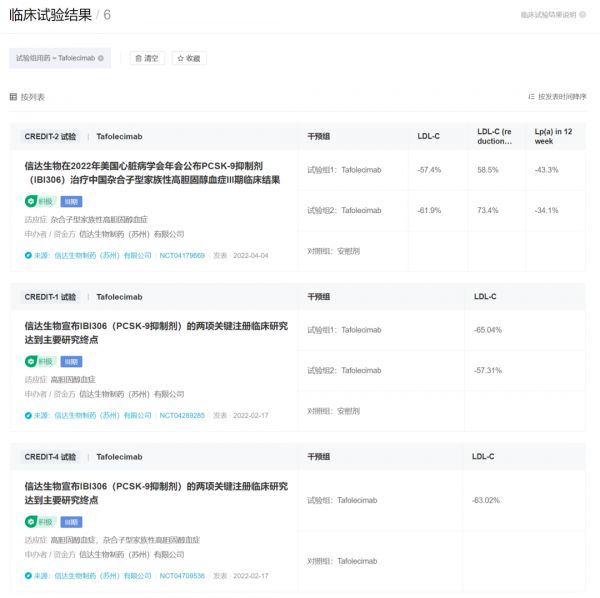
来自:Insight 数据库临床试验结果模块
本周,信达正式向 CDE 提交了托莱西单抗的上市申请获得受理。据此前临床试验信息,本次申报上市适应症应为:原发性高胆固醇血症和混合型血脂异常。
据 Insight数据库 显示,当前国内仅有两款进口药依洛尤单抗(安进)和阿利西尤单抗(赛诺菲)获批上市,今年进入医保目录之后,有望提高可及性,提供经济可负担的治疗方案;而首款国产的申报,对提高该类药物的可及性也有相当大的提升作用。 PCSK9 靶点单抗类药物国内竞争格局
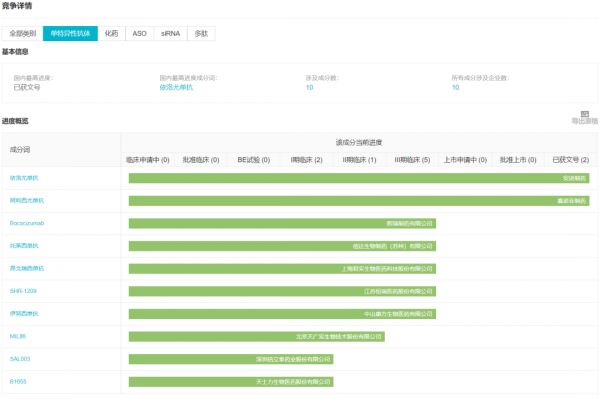
来自:Insight 数据库
启动 III 期临床试验
恒瑞:SHR-A1811 启动 III 期临床试验
6 月 16 日,恒瑞启动了一项注射用 SHR-A1811 对比吡咯替尼联合卡培他滨治疗 HER2 阳性转移性乳腺癌的随机、开放、平行对照、多中心 III 期临床研究。 CTR20221474 临床试验
针对该适应症,恒瑞还在开展一项注射用 SHR-A1811 联合吡咯替尼或帕妥珠单抗或 SHR-1316 或白蛋白紫杉醇治疗 HER2 阳性不可切除或转移性乳腺癌的开放、多中心 Ⅰb/Ⅱ 期临床研究。
首次启动临床
1、恒瑞:HRX0701
6 月 13 日,Insight 数据库 显示,恒瑞医药的子公司山东迪盛医药的 HRX0701 片首次在国内公示临床试验。
HRX0701 片是恒瑞开发的二肽基肽酶Ⅳ(DPP-4)抑制剂磷酸瑞格列汀与盐酸二甲双胍固定剂量复方制剂,通过两种不同作用机制达到更好的降血糖作用。 目前国内外已有多个同类复方产品获批上市。公开资料显示,2020 年 DPP-4 抑制剂与二甲双胍复方制剂全球销售额约为 57.2 亿美元。截至今年 4 月,HRX0701 片相关项目累计已投入研发费用约 790 万元。
2、强生:JNJ-63733657
6 月 13 日,Insight 数据库 显示,强生的 JNJ-63733657 注射液首次在国内公示临床试验。该试验是一项在中国健康受试者中评估 JNJ-63733657 的药代动力学、安全性和耐受性的 I 期、开放性、单次给药研究。 JNJ-63733657 正在国内开展的临床试验
JNJ-63733657 由强生旗下杨森公司开发,该药靶向 tau 蛋白中间区域的一个超磷酸化表位。tau 蛋白是神经细胞中和微管结合的可溶性蛋白,病理性 tau 蛋白的沉积和在大脑的扩散,与 AD 患者的认知能力下降有紧密的相关性。 据Insight 数据库 显示,此前 JNJ-63733657 已在 Linical Trials.gov 登记了一项在中国健康人群中的应用研究。
3、诺诚健华:Tafasitamab
据 Insight 数据库显示,6 月 17 日,诺诚健华的 Tafasitamab 首次在国内公示临床试验,这是一项评价 Tafasitamab 联合来那度胺治疗复发或难治性弥漫性大 B 细胞淋巴瘤患者安全性和有效性的单臂、开放、多中心 II 期临床研究。 针对该适应症,早在 2020 年 8 月已在美国获批上市。2021 年 8 月,诺诚健华从 Incyte 公司获得 Tafasitamab 在大中华区的开发和商业化授权,最高交易总额可达 1.175 亿美元。 Tafasitamab 医药交易
4、信达:IBI324
据 Insight 数据库显示,6 月 17 日,信达生物的 IBI324 首次在国内公示临床试验, 这是一项评估在糖尿病性黄斑水肿受试者中单次及多次玻璃体腔注射 IBI324 安全性和耐受性的 I 期剂量爬坡临床研究。 CTR20221524 临床试验
IBI324 是由信达生物开发的一款 VEGF/ANG-2 双抗,可通过靶向 Ang-2 和 VEGF 两种不同的途径抑制新生血管异常生长。
境外创新药进展
上周境外共有 11 款新药(含改良新)产品的研发进度推进到新阶段,其中,有多款新药/新适应症获批上市。
本周境外获批上市的重点产品(含新适应症) 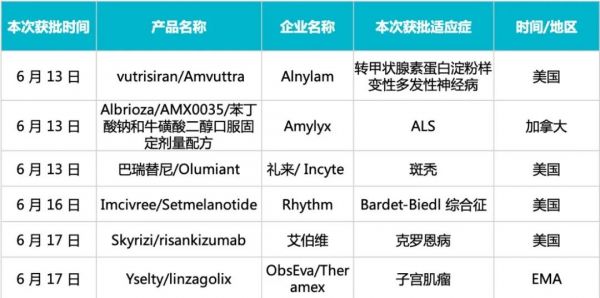
1、每 3 个月皮下注射一次!Alnylam 公司 RNAi 疗法 vutrisiran 上市
06 月 13 日,Alnylam 公司皮下注射 RNAi 疗法 vutrisiran/ALN-TTRSC02 的上市申请获 FDA 批准,用于治疗遗传性转甲状腺素蛋白介导(hATTR)的淀粉样变性成人患者的多发性神经病(polyneuropathy)。 vutrisiran 是 FDA 批准的第 1 款只需每 3 个月皮下注射一次,就能够逆转神经病损伤的 RNAi 疗法。本次获批是基于一项全球性、随机、开放标签、多中心 III 期 HELIOS-A 研究 9 个月的积极结果。该研究评估了 vutrisiran 在不同组 hATTR 淀粉样变性多发性神经病变患者中的疗效和安全性。 HELIOS-A 研究,研究共纳入 164 名患者,试验结果显示,vutrisiran 达到主要终点,接受治疗 9 个月后,vutrisiran 组的 mNIS+7 评分(评估神经病障碍的评分)与基线相比降低 2.2 点(意味着症状改善),而外部对照组评分增加 14.8 点(意味着症状恶化,p<0.0001)。9 个月时,50% 的患者与基线相比症状得到改善。同时达到试验的所有次要终点。且在接受治疗后 18 个月时,疗效数据与 9 个月时一致。 vutrisiran 是一种皮下给药 RNAi 治疗药物,开发用于治疗 ATTR 淀粉样变性,包括 hATTR 和野生型 ATTR(wtATTR)淀粉样变性。可通过靶向和沉默特定的 mRNA,阻断野生型和变体转甲状腺素蛋白(TTR)的产生。 据 Insight 数据库显示,当前 Vutrisiran 正在开展一项 IIII 期 HELIOS-B 研究,旨在评价其治疗 ATTR 淀粉样变性心肌病(包括 hATTR 和野生型 ATTR(wtATTR)淀粉样变性)患者的疗效。 HELIOS-B 临床试验
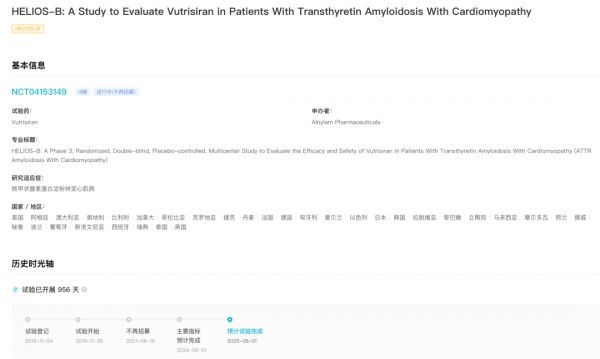
Vutrisiran 也是 Alnylam 获批的第 2 款用于治疗 hATTR 淀粉样变性多发性神经病变的 RNAi 疗法。此前于 2018 年 10 月获批上市了 PATISIRAN,不过,该产品需要每 3 周静脉输注一次。
2、Amylyx「AMX0035」渐冻症创新疗法获全球首批!
6 月 13 日,加拿大监管机构批准 Amylyx 的 Albrioza(苯丁酸钠和牛磺酸二醇口服固定剂量配方,曾用名 AMX0035)有条件上市,用于治疗肌萎缩侧索硬化(ALS)。这是该创新疗法在全球范围内首次获得监管机构的批准。 Albrioza 的批准是基于名为 CENTAUR 的 2 期临床试验,包含 137 名 ALS 患者。试验结果显示,使用名为 ALSFRS-R 的量表对患者症状进行评估,与安慰剂相比,接受 Albrioza 治疗的患者改善明显。两组间次要结局无显著差异。为了评估Albrioza 对 ALS 患者的疗效和安全性,还需要更长期、更大规模的试验。
Albrioza CENTAUR 试验结果
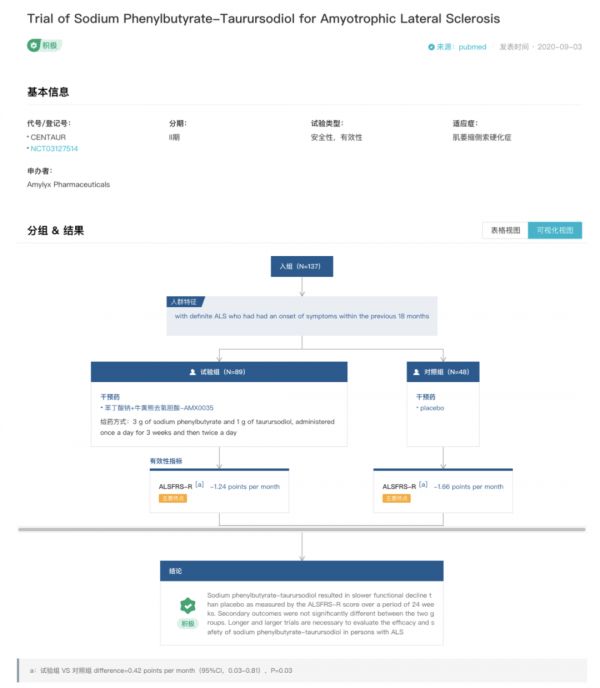
来自:Insight 数据库 临床试验结果模块
加拿大监管机构上市批准的条件之一是 Amylyx 公司需要进行验证性临床试验,进一步验证 Albrioza 在 ALS 患者中的疗效。 据 Insight 数据库 显示,Amylyx 当前正在开展一项 Phoenix 的全球 III 期临床试验,旨在评估 AMX0035 与安慰剂对成年 ALS 患者 48 周治疗的安全性和有效性。该试验预计招募约 600 名 ALS 患者。
3、首款口服斑秃疗法获批,可恢复 80% 头发生长
6 月 13 日,礼来和 Incyte 公司联合开发的口服 JAK 抑制剂巴瑞替尼(商品名:Olumiant)获 FDA 批准上市,用于治疗严重斑秃成人患者。这是 FDA 批准用于治疗斑秃的首款口服斑秃疗法。 巴瑞替尼是礼来与 Incyte 公司合作开发的一款每日一次的口服 JAK 抑制剂。当前已在超过 75 个国家和地区获批用于治疗类风湿性关节炎,且在超过 50 个国家和地区获批用于治疗中重度特应性皮炎。此外,据 Insight 数据库 显示,巴瑞替尼针对新冠适应症也已于去年获批上市。本次获批为第 4 项适应症。
巴瑞替尼全球研发进展甘特图
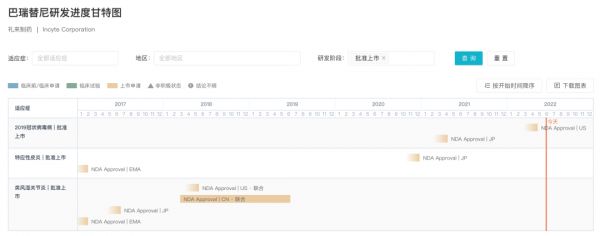
来自:Insight 数据库
2020 年 3 月,FDA 授予巴瑞替尼用于治疗成人重度斑秃的突破性疗法认定。针对该适应症,今年 2 月,FDA 再次授予优先审查权。此前尚无 FDA 批准的用于治疗斑秃的疗法,巴瑞替尼为首款。
4、罕见肥胖症新药 Imcivree 新适应症获批,用于治疗 BBS 患者
6 月 16 日,据 Insight 数据库显示,Rhythm 制药公司的 Imcivree (Setmelanotide)新适应症上市申请获 FDA 批准,用于治疗 Bardet-Biedl 综合征(BBS)患者,进行体重管理。 Setmelanotide 是一种首创、寡肽类 MC4 受体激动剂,旨在恢复因 MC 受体上游基因缺陷引起的受损 MC4 受体通路的功能,从而直接解决疾病的根本原因。setmelanotide 能够重新建立患者的能量消耗和食欲控制,减少饥饿感、降低体重。 Setmelanotide 于 2020 年 11 月首次获 FDA 批准,用于 6 岁及以上PCSK1/POMC/LEPR 缺陷型肥胖症的小儿和成人患者的慢性体重管理。Setmelanotide 是第一个被批准用于治疗这些罕见遗传性肥胖症的药物。
Imcivree 全球研发进度甘特图
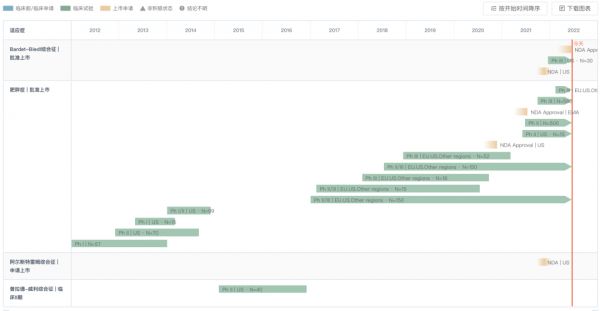
来自:Insight 数据库
此外,据 Insight 数据库 显示,当前还在积极推进 Setmelanotide 针对 Alström 综合征的上市申请。
5、艾伯维 risankizumab 获批上市用于治疗克罗恩病
6 月 17 日,艾伯维(AbbVie)的 Skyrizi(risankizumab/瑞莎珠单抗)用于治疗中重度克罗恩病成人患者上市申请获 FDA 批准。 Skyrizi 是首个获批治疗这一患者群体的专一靶向白细胞介素-23(IL-23)的抑制剂,同时也是中重度克罗恩病患者 6 年来首个新治疗选项。 此前多项临床 3 期试验显示,与安慰剂组相较,Skyrizi 可以有效改善克罗恩病患的内镜反应并达成临床缓解。 本次获批是基于在中重度克罗恩病患身上,两个诱导性与一个维持性的临床 3 期试验所显示 Skyrizi 的安全与疗效数据结果。在诱导性试验当中,最早可在第 4 周时观察到,在病患出现临床反应与缓解情形方面,Skyrizi 治疗组病患人数显著多于安慰剂组。在第 12 与第 52 周时,Skyrizi 组获得内镜反应与临床缓解的患者人数也优于安慰剂组。 据Insight数据库 显示,此前已在多个国家/地区获批上市了银屑病、关节炎相关适应症。
全球研发进展甘特图
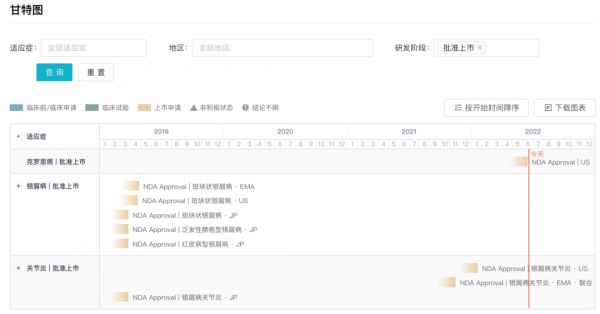
来自:Insight数据库
推文用于传递知识,如有版权等疑问,请于本文刊发30日内联系BiG生物创新社。
本文由“健康号”用户上传、授权发布,以上内容(含文字、图片、视频)不代表健康界立场。“健康号”系信息发布平台,仅提供信息存储服务,如有转载、侵权等任何问题,请联系健康界(jkh@hmkx.cn)处理。
相关知识
国内百万人或将摆脱秃顶困境,治疗重度斑秃创新靶向药获批
京东健康线上首发辉瑞斑秃治疗新药乐复诺® 提升重度斑秃患者用药可及性
全球首款用于治疗严重斑秃的抑制剂有望上市 这些药企紧盯你的头发
渤健渐冻症新药刚刚获批,FDA又在释放什么信号?
减肥领域首款中国原创新药获批上市,“全人源”GLP
药监局批准1类创新药来瑞特韦片上市,这款新冠口服药怎样?
盘点丨24款创新药获批上市!中药表现亮眼,2款纳入优先审评!
再创新高!上海市今年已获批三款1类创新药
乐复诺®京东健康线上首发 惠及12岁及以上青少年和成人重度斑秃患者
上海市生物医药创新发展再创佳绩,又一款PD-L1新药获批
网址: 首款口服斑秃新药、「渐冻人」症创新疗法…获批上市 https://m.trfsz.com/newsview1495261.html