聂少平团队|菌源代谢物挖掘与膳食营养干预

论文概览
菌源代谢物挖掘与膳食营养干预
聂启兴,张珊珊,陈春华,邹坚桥,聂少平*
南昌大学 食品科学与资源挖掘全国重点实验室 中国-加拿大食品科学与技术联合实验室 江西省生物活性多糖重点实验室
摘要:肠道是一个复杂的共生系统,肠道菌群与宿主健康密切相关。肠道菌通过产生丰富的代谢物影响宿主的生理功能,这些代谢物作为信号分子和代谢反应的底物在宿主体内发挥作用。肠道菌群失调影响宿主体内菌源代谢物的丰度,通过破坏宿主靶点的信号转导进而影响宿主健康。此外,膳食营养组分也能够塑造肠道菌群,影响菌源代谢水平调控宿主代谢。本文综述了国内外研究成果,重点介绍了菌源代谢物的挖掘方法以及相关的膳食营养干预手段,展望了以菌源代谢物为靶点的代谢性疾病预防与治疗前景,为深入理解肠道菌群在调控宿主代谢中的作用提供了参考。
肠道是一个复杂的共生系统,不仅是人体消化吸收的重要场所,同时也是最大的免疫器官,在维持正常免疫防御功能中发挥着极其重要的作用。人体肠道中存在着种类繁多的微生物,这些微生物被称为肠道共生菌。肠道共生菌主要包含细菌、古菌、真菌等,其编码的基因数量比人类基因组高出一个数量级,被称为人体的“第二基因组”[1]。肠道共生菌受饮食、环境、遗传等多种因素调控,在训练宿主免疫系统、消化食物、调节肠道内分泌功能和神经信号传导、改变药物作用和代谢、消除毒素以 及产生影响宿主的多种化合物方面均具有重要作用[2-3]。
根据近年来的流行病学、生理学和基因组学等学科的研究结果,结合细胞研究和动物实验,发现环境对人类健康和疾病的影响很大程度上受到肠道共生菌的调控。大量研究表明多种疾病(如肥胖、2型糖尿病、非酒精性脂肪肝病、结肠炎和结肠癌等)的发生发展与肠道菌群紊乱密切相关[4-5]。早在2006年,华盛顿大学Gordon教授团队证明肥胖人群肠道菌群多样性下降,并且发现将肥胖患者体内的肠道菌群移植给无菌小鼠后可导致小鼠体重显著增加[6]。这项具有里程碑意义的研究为后续深入研究肠道微生物发挥的功能提供了理论基础,将肠道菌群与宿主能量代谢建立了紧密的联系。后续的流行病学研究表明,肥胖个体与正常人群的肠道微生物群存在明显差异。在物种水平上,凸腹真杆菌(Eubacterium ventriosum)和肠道罗斯拜瑞氏菌(Roseburia intestinalis)的丰度与肥胖呈正相关,而Oscillospira spp.的丰度与肥胖呈负相关[7-9]。我国的研究人员通过宏基因组分析也发现,具有降解谷氨酸能力的多形拟杆菌(Bacteroides thetaiotaomicron)在肥胖个体中的丰度显著降低,并与血清谷氨酸浓度呈负相关,而给小鼠灌胃B. thetaiotaomicron也能够改善高脂饮食诱导的肥胖[10]。肠道菌群与宿主代谢调控是一个复杂的过程。代谢性疾病发生发展的过程中伴随着肠道菌群失调,肠道微生物的多样性和稳定性受到破坏,某些特定有益菌的减少和机会致病菌的增加会进一步导致宿主代谢紊乱[11]。
肠道菌群失调会影响肠道和循环中的菌源代谢产物含量,增加宿主体内脂多糖(lipopolysaccharide, LPS)水平,引起宿主体内的炎症反应。大量研究表明,肠道共生菌通过产生丰富的代谢物(例如短链脂肪酸、胆汁酸、三甲胺等)影响宿主的生理功能,这些代谢物作为信号分子和代谢反应的底物在宿主体内发挥作用[12-15]。例如短链脂肪酸(short chain fatty acids, SCFAs)是肠道微生物发酵活动的主要产物,通过激活肠内分泌细胞的G蛋白偶联受体43 (G protein coupled receptor 43, GPR43)和G蛋白偶联受体41 (G protein coupled receptor 41, GPR41),促进胰高糖素样肽-1 (glucagon-like peptide-1, GLP-1)和酪酪肽(peptide YY, PYY)的分泌[16-17]。此外,乙酸可以穿过血脑屏障到达下丘脑,促进谷氨酸-谷氨酰胺和γ-氨基丁酸(gamma aminobutyric acid, GABA)神经胶质循环,增加乳酸抑制食欲和营养吸收;丙酸也可以直接作用于脂肪组织,刺激瘦素的表达和分泌;丁酸可以通过抑制下丘脑中表达神经肽Y的食欲刺激神经元激活以及脑干孤束核和背侧迷走复合体内神经元活性预防饮食引起的肥胖、肝脂肪变性和胰岛素抵抗[18-20]。而肝脏生成初级胆汁酸后,在肠道中被肠道菌表达的胆盐水解酶(bile salt hydrolase, BSH)去结合后进一步被肠道菌代谢生成次级胆汁酸,通过影响宿主法尼醇X受体(farnesoid X receptor, FXR)、孕烷X受体(pregnant X receptor, PXR)和G-蛋白偶联受体(G protein coupled receptor, GPCR)等受体调控宿主代谢[21-23]。抑制肠道FXR(例如牛磺熊去氧胆酸、牛磺β鼠胆酸等)能够通过减少肠源性神经酰胺的生物合成,改善高脂诱导的肥胖以及肝脏脂质代谢紊乱,而激活肠道和脂肪的Takeda G蛋白偶联受体5 (Takeda G protein coupled receptor 5, TGR5)则能够促进肠道GLP-1的产生以及脂肪产热改善宿主代谢[24-26]。这些结果均表明菌源代谢物对于调节宿主健康至关重要。
膳食营养组分在塑造肠道菌群方面起着重要作用,包括发酵碳水化合物和蛋白质等营养组分、代谢酚类和进一步修饰小分子代谢物等,进而影响菌源代谢物的丰度并调节机体代谢。尽管目前已经识别出多个对宿主健康有重要意义的菌源代谢物相关靶点,但是由于宿主体内的代谢反应极其复杂,宿主与肠道菌群以及肠道菌群之间存在高度的相互作用,导致菌源代谢物的挖掘与功能解析仍然是目前研究的难点。本文基于国内外研究成果,重点介绍菌源代谢物的挖掘方法,回顾菌源代谢物在代谢性疾病中的作用及相关的膳食营养干预手段,展望以菌源代谢物为靶点的代谢性疾病预防与治疗前景。
1 菌源代谢物的挖掘
现代仪器分析技术的进步促进了代谢组学的快速发展,而代谢组学技术对于菌源代谢物的挖掘至关重要。微生物群衍生或修饰代谢物的定性定量分析为后续的宿主-微生物群相互作用与功能验证奠定了基础,增进了对宿主-微生物群相互作用的理解。当前研究主要通过质谱和核磁共振技术进行菌源小分子代谢的分析[27-28]。研究人员通过肠道菌体外培养、比较正常小鼠与无菌鼠之间的代谢物差异、代谢物探针菌群孵育/体内转化以及基于活性筛选的化合物分离等手段进行关键菌源代谢物的挖掘。
1.1 非靶向代谢组
非靶向代谢组是目前广泛使用的代谢物挖掘方法,该方法旨在检测生物样品中的所有代谢物,揭示生物系统的全貌和代谢动态。非靶向代谢组学的主要特点是其全面性,能够同时检测上千种代谢物,这使得研究人员能够对生物体的整体代谢轮廓进行分析,从而在海量的数据中发现潜在的生物标志物,而不仅仅是关注特定的代谢物或代谢途径,有助于揭示生物系统中的新机制和新功能。通过与无菌小鼠的生物样本进行代谢物比较分析,能够更好地判断细菌来源的代谢物[29-30]。Liu等[31]通过对比无菌(germ free, GF)小鼠和正常(specific pathogen free, SPF)小鼠的肝脏和肝脏线粒体代谢谱,发现了一种新的菌群相关代谢物δ-三甲铵基戊内盐;该物质能够由多种肠道菌生成,并能够通过减少细胞肉毒碱和线粒体长链酰辅酶A,抑制线粒体脂肪酸氧化促进小鼠肥胖;而补充δ-三甲铵基戊内盐会进一步加剧西式饮食干预后的GF和SPF小鼠的内脏脂肪积累和脂肪肝。而同期发表在Nature Aging期刊的文章也发现年轻小鼠的粪便菌群移植给老年小鼠后能够改善认知障碍,代谢组学分析则表明老年小鼠大脑和血液中的δ-三甲铵基戊内盐水平相比于年轻小鼠显著升高[32];进一步的人群样本检测也证明了该物质与年龄呈正相关关系,主要是促进内侧前额叶皮质突触传递和神经网络活动紊乱(自发抑制性突触后电流频率增加)损害小鼠的学习和记忆功能。在另一项GF和SPF小鼠不同器官的代谢组分析中,研究人员发现肠道菌群几乎影响了所有器官(尤其是肠道)的代谢谱,并且通过全球天然产物社会分子网络(global natural products social molecular networking, GNPS)分析鉴定出了肠道中3种由菌群产生的氨基酸结合型胆酸(Phe-cholic acid、Tyr-cholic acid、Leu-cholic acid,氨基酸通过酰胺键连接至胆酸的24号位)[33]。相比于肝脏中形成的牛磺胆酸和甘氨胆酸,后续的生物合成通路解析发现,肠道菌的BSH在胆汁酸代谢中存在一种新功能,即作为一种胺N-酰基转移酶,其能够将胺类与胆汁酸结合而形成微生物氨基酸结合胆酸[34-35]。目前为止,队列研究已经发现微生物氨基酸结合胆酸在炎症性肠病和囊性纤维化患者中富集,其中的某些氨基酸结合胆酸也能够激活FXR、PXR以及芳香烃受体(aryl hydrocarbon receptor, AhR),但是其在宿主代谢中发挥的生理功能仍然有待进一步研究[36]。
除了与无菌小鼠样本进行基于代谢组的比较分析,通过大队列研究发现菌源代谢物与宿主代谢之间的关系也是目前常用的研究方法之一。例如2020年美国克利夫兰研究中心的Hazen团队通过非靶代谢组学对1 162例血浆样本进行分析发现代谢物苯乙酰谷氨酰胺(phenylacetylglutamine, PAGln)水平在2型糖尿病(type 2 diabetes mellitus, T2DM)患者及主要心脏不良事件(major adverse cardiovascular events, MACE)人群中浓度较高,并且在另一个4 000名受试者的验证队列中证实了血浆中PAGln的浓度可以作为MACE风险的独立预测因素[37]。肠道菌通过porA和fldH基因将膳食中的苯丙氨酸转化为苯乙酸,随后在人体肝脏中被转化为PAGln,该物质作用于GPCRs,包括α2A、α2B和β2-肾上腺素能受体介导一系列的细胞反应,促进体内血小板聚集和血栓形成[37]。另一项研究也发现在炎症性肠病(inflammatory bowel disease, IBD)患者体内,5-氨基水杨酸干预后的药效在人群中存在差异,通过代谢组学研究也发现肠道菌能够将5-氨基水杨酸代谢为多种酰基化代谢产物,从而影响其临床药效[38]。此外,近期一项研究也提出了反向代谢组的概念,即通过化学合成的方法获得大量含有潜在代谢物的混合体系,随后通过非靶代谢组的方法获得这些化合物的二级质谱图,再与公共数据库中的质谱数据进行比较分析,从而推断出宿主体内潜在的代谢物[39-40]。该方法能高通量地丰富研究人员对现有的生化和代谢模型的认知,同时可以用来确定潜在的诊断生物标志物。
1.2 化学探针
虽然质谱技术的快速发展极大提高了代谢组学检测过程中的灵敏度,但是对于低丰度代谢物的挖掘仍然存在不足,化学探针的开发和使用对于低丰度代谢物的挖掘至关重要。Garg等[41]设计了一种新型的化学探针,该探针能够直接从生物样本中提取氨基酸、单胺类化合物等胺类代谢物,并在温和条件下重新释放代谢物,进行质谱分析;该方法显著提高了胺类 化合物的检测范围,并且在粪便样品中鉴定出4种未知的代谢产物,表明该探针在挖掘未知菌源代谢物中的潜力。而在另一项研究中,研究人员也通过构建修饰在磁珠上的化学选择性探针实现了含羰基代谢物的高通量检测,该方法可在飞摩尔和埃摩尔级别同时检测人群粪便、尿液和血浆样品中的200多种代谢物[42]。这一类探针的使用旨在增加代谢物检测过程中的灵敏度。
相比于上述化学探针,代谢物炔基探针结合点击化学方法则主要在于挖掘被进一步代谢或修饰的新型代谢物。蛔苷是线虫生命代谢过程中的一种重要代谢物,Hoki等[43]构建了以蛔苷为基础的炔基探针,并在线虫培养过程中加入该探针,经过线虫代谢后收集样本结合点击化学反应挖掘出了线虫对蛔苷的新型代谢形式。胆汁酸在调节宿主代谢、分子信号传导过程中起着重要作用,其组成的变化与代谢性疾病的发生发展密切相关。基于此,研究人员构建了胆汁酸炔基探针,进一步通过肠道菌孵育,结合非靶向代谢组学,寻找新型的菌源胆汁酸[44] (图1)。通过将胆酸24号位置的炔基探针置于培养基中进行肠道菌孵育,推测胆酸除羧基之外的其他位置或活性基团能够被肠道菌进行修饰,进一步形成新型的菌源胆汁酸;胆酸探针经肠道菌孵育后,对代谢物进行萃取,进一步使用树脂对探针代谢物进行富集,随后收集探针代谢物进行点击化学反应,并进行非靶向代谢组学分析;胆汁酸探针的优势在于树脂对探针代谢物的富集以及形成m/z为100.076 1的探针报告离子,基于该报告离子能够快速地对探针代谢物进行识别,通过GNPS分子网络二级质谱相似性,推测可能的胆酸衍生物;通过该方法挖掘了一系列的酰基化胆汁酸,并且解析了其生物合成通路,阐明了琥珀酰胆酸(3-succinylated cholic acid, 3-sucCA)在缓解代谢相关脂肪性肝炎中的机制。除此之外,代谢物炔基探针也能够结合流式分选技术进行代谢物互作细菌的筛选及其下游代谢物的识别[45-47]。这类方法的开发极大地促进了新型菌源代谢物的深入挖掘,也推动了微生物组学和代谢组学的研究进展。
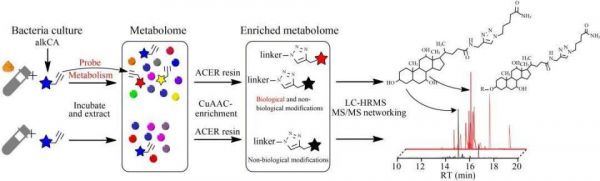
图1 胆酸探针结合点击化学挖掘新型菌源胆酸代谢物 alkCA:胆酸炔基探针;CuAAC:铜催化叠氮-炔环加成;LC-HRMS:液相色谱串联高分辨质谱。
Figure 1 Gut microbiota-associated bile acid screening by click-chemistry based enrichment strategy. alkCA: Alkyne probe of CA; CuAAC: Copper(I)-catalyzed azide-alkyne cycloaddition; LC-HRMS: Liquid chromatography coupled with high resolution mass spectrometry.
1.3 化合物分离
化合物分离是进行菌源代谢物挖掘的重要手段之一。Huo等[48]发现Candida metapsilosis M2006B能够通过激活肠FXR缓解结肠炎,但是不依赖于肠道中的胆汁酸;研究人员进一步大规模制备了Candida metapsilosis M2006B的发酵液进行代谢物提取,并且通过制备高效液相色谱分离获得了13个代谢物组分;随后通过荧光素酶报告基因检测实验对代谢物组分进行分析,发现代谢物F4和F5能够显著激活FXR,并且基于核磁共振和高分辨质谱对其进行了结构解析,最终发现Candida metapsilosis M2006B能够通过产生无环倍半萜类化合物激活肠FXR缓解结肠炎。另一项研究也发现摩氏摩根菌(Morganella morganii)能够产生一种新型的基因毒素indolimines破坏小鼠肠道通透性,加剧结肠肿瘤生成[49]。在该代谢物的挖掘过程中,研究人员通过基于摩氏摩根菌的小规模发酵结合生物活性筛选(DNA损伤)的引导分离以及超高效液相色谱串联飞行时间质谱的非靶向代谢组学发现潜在活性组分,然后进行大规模培养和分离并进行结构鉴定和遗传毒性分析,最终鉴定出该基因毒素。此外,本课题组前期研究也发现肠缺氧诱导因子2α (hypoxia inducible factor-2α, HIF-2α)特异性敲除小鼠肠内容物提取的代谢物对普通拟杆菌(Bacteroides vulgatus)的生长具有明显抑制作用,但是对扭链瘤胃球菌(Ruminococcus torques)的生长没有影响[50]。进一步,基于提取物对普通拟杆菌生长的影响,研究人员利用高效液相色谱、核磁共振等多种色谱及光谱技术对小鼠肠内容物进行了活性代谢产物分离及结构鉴定,最终确定乳酸是肠HIF-2α促进普通拟杆菌生长的关键活性成分[50]。
2 菌源代谢物与宿主健康
人体肠道微生物受到膳食、年龄、药物干预等多重因素的影响,在这些因素的推动下产生胆汁酸、短链脂肪酸、氨、酚类、内毒素多种代谢物。这些菌源代谢物是介导微生物-宿主交流的重要媒介,对于维持宿主生理病理状态至关重要[51-52]。反之,肠道微生物相关的代谢谱变化也可以一定程度上反映宿主的饮食方式或生理变化。此外,基于基因组学、宏蛋白质组学和代谢组学的多组学手段也已经广泛应用于菌源代谢物的功能研究,其中胆汁酸、吲哚衍生物、维生素等菌源代谢物已经被发现能够影响宿主代谢[53]。
色氨酸是一种必需氨基酸,只能通过饮食来源获得。色氨酸的代谢主要包括犬尿氨酸、5-羟色胺和吲哚这3种途径。其中肠道菌群能够直接将色氨酸代谢为吲哚、吲哚衍生物和色胺等代谢物,这些物质能够激活AhR,进一步通过调节促炎和抗炎细胞因子的表达维持宿主免疫稳态和肠道屏障功能[54-55]。早在2018年,研究人员就通过代谢组学手段发现在代谢综合征患者和相关的动物模型中肠道AhR配体的水平明显低于对照组,并且肠道菌群代谢色氨酸生成AhR配体的能力也显著降低[56]。给代谢综合征小鼠补充AhR激动剂Ficz,或者进行罗伊氏乳杆菌干预能够有效改善肠道屏障功能、减少系统性炎症,并且促进GLP-1分泌,进一步改善代谢综合征小鼠的糖代谢和脂肪肝。随后的大量研究也表明肠道菌产生的吲哚衍生物通过激活AhR能够有效调控宿主肠道免疫改善宿主健康[57-59]。例如吲哚-3-甲醛(indole-3-carboxaldehyde, 3-IAld)能够通过激活AhR/IL-22轴维持肠上皮屏障完整性和抑制炎症反应,缓解小鼠的结肠炎症状;同时,3-IAld也会影响小鼠肠道菌群的结构和功能,导致糖发酵细菌和产SCFAs的细菌丰度增加[60]。多形拟杆菌(Bacteroides thetaiotaomicron)干预也能够提高吲哚-3-乙酸(indole-3-acetic acid, IAA)和吲哚-3-丙酸(indole-3-propionic acid, IPA)的水平,并通过激活AhR和增强Treg细胞功能来抑制肠道炎症[61]。此外,肠道菌产生的吲哚衍生物也能够进入宿主循环,激活宿主外周组织的AhR信号影响宿主代谢[62-63]。例如,缺乏亮氨酸的饮食可改变肠道菌群组成,其中类球布劳特氏菌(Blautia coccoides)的丰度显著增加。B. coccoides能够将色氨酸代谢为IAA,肠道的IAA进一步进入宿主外周循环,激活肝脏中的AhR改善高脂饮食小鼠的胰岛素敏感性[62]。
肠道菌能够产生/修饰脂肪酸影响宿主稳态。SCFAs是目前研究最为广泛的代谢物之一,主要包括乙酸、丙酸、丁酸和戊酸。膳食纤维无法被宿主消化吸收,摄入后被肠道菌降解产生SCFAs,并且SCFAs的产生类型和含量也与膳食纤维的结构和种类密切相关[64-65]。目前SCFAs影响宿主健康相关的机制研究主要涉及SCFAs调控的3种受体GPCR41、GPCR43和GPCR109A,通过对相关GPCR基因缺陷小鼠的研究,已经明确了SCFAs信号通过这些受体在调控炎症和肠道稳态中的重要性,但这些受体在不同细胞类型上的功能作用目前仍然有待进一步解析[66]。丁酸和烟酸已经被证明可以通过激活肠GPCR109a影响巨噬细胞和树突状细胞的抗炎效果,并进一步改善肠道稳态[67-68]。而在肠内分泌细胞中,丁酸能够诱导食欲调节激素PYY和GLP-1的释放,促进胰岛素的产生改善血糖稳态[69]。而乙酸也能够通过增加下丘脑的谷氨酸-谷氨酰胺循环和γ-氨基丁酸神经胶质循环诱导厌食信号[20]。相比于短链脂肪酸,肠道菌也能产生中链和长链脂肪酸影响宿主健康。例如粪肠球菌(Enterococcus faecalis)能够通过酰基辅酶A硫酯酶(acyl-CoA thioesterases, ACOT)产生代谢物肉豆蔻油酸激活肥胖小鼠的棕色脂肪产热改善肥胖[70]。相比之下,肠道梭单胞菌(Fusimonas intestini)能够产生反油酸,该物质能够损伤肠道完整性并促进饮食诱导的肥胖[71]。另有研究表明,肠道菌能够将亚油酸(linoleic acid, LA)转化为共轭亚油酸(conjugated linoleic acid, CLA),CLA会进一步通过免疫调控影响鼠伤寒沙门氏菌感染[72]。
维生素是人体六大营养素之一,既不参与构成宿主细胞,也不为人体提供能量,但通过参与人体内的生化反应调节宿主代谢。肠道菌群具有显著的合成和利用B族维生素的能力,然而营养不良儿童表现出肠道微生物B族维生素合成能力降低的趋势[73-74]。研究人员使用同位素示踪技术发现宿主来源的烟酰胺(nicotinamide, NAM)可进一步被肠道菌转化为烟酸(nicotinic acid, NA)并维持正常的循环水平[75]。同时本课题组的研究也发现狄氏副拟杆菌(Parabacteroides distasonis)可通过产生烟酸激活肠GPCR109a受体保护肠屏障功能并改善胰岛素抵抗,并且最终也通过独立的验证队列和公共数据库数据重分析验证了P. distasonis的丰度和粪便烟酸的水平与胰岛素抵抗存在负相关[76]。另一项研究表明,女性肠道菌中维生素B2和B6合成能力比男性更强,而维生素B9和B12生物合成能力与年龄呈负相关,并且肠道菌群维生素产生能力与血糖相关因子、脂质、循环炎症有密切关系[77]。此外,特定的肠道菌(乳杆菌、双歧杆菌等)能将膳食维生素A转化为视黄醇等相关的活性代谢物(包括全反式维甲酸和13顺式维甲酸),其中全反式维甲酸对于维持肠道免疫和改善肠道炎症至关重要[78-80]。
3 膳食营养组分调控菌源代谢物
肠道菌群对于宿主健康至关重要,通过饮食调节肠道菌群来改善人体健康的方法也已经受到大众的认可。大量研究已经表明膳食多糖、低聚糖、多酚等植源性物质能够通过调节肠道菌群,进一步通过菌源活性代谢物的产生影响宿主健康(图2)。
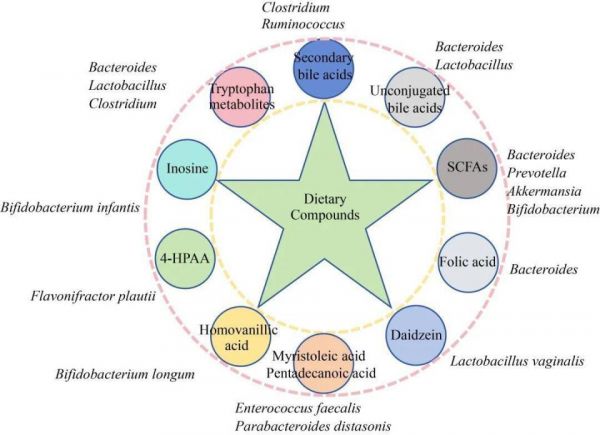
图2 膳食组分调节细菌代谢物
Figure 2 Regulation of gut microbiota-derived metabolites by dietary compounds.
3.1 膳食纤维
膳食纤维是日常膳食中调节代谢的重要功效成分之一,无法被宿主消化吸收,在肠道中被肠道菌降解进而影响其组成和功能,对于维持宿主正常的生理功能至关重要。膳食纤维结构复杂、种类繁多,由于其来源和结构的多样性,对肠道菌存在差异化的影响,产生不同的活性代谢物影响宿主代谢和生理状态[81]。在一项随机双盲、安慰剂对照实验中,研究人员发现可消化的玉米淀粉和抗性土豆淀粉不影响肠道中SCFAs的产生,而抗性玉米淀粉能够增加直肠真杆菌(Eubacterium rectale)的丰度产生丁酸,抗性木薯淀粉能够促进狄氏副拟杆菌(Parabacteroides distasonis)的增殖产生丙 酸[82]。本课题组前期研究发现铁皮石斛来源的葡甘露聚糖能够促进肠道共生菌P. distasonis的增殖,通过产生烟酸激活肠GPCR109a轴改善肠道屏障功能缓解胰岛素抵抗;而魔芋来源的葡甘露聚糖则是通过富集肠道的卵圆形拟杆菌(Bacteroides ovatus),产生IAA激活肠芳香烃受体改善肠道屏障功能和胰岛素抵抗[76,83]。这 2种葡甘露聚糖的结构差异主要在于乙酰基的含量,因此这种差异化的分子机制以及对肠道功能细菌的特异性富集提示不同结构或来源的膳食纤维对于宿主生理状态的影响至关重要。在另一项研究中,Wei等巧妙利用稳定同位素示踪技术,发现一系列的13C标记的肠道菌(即利用菊粉的细菌)以及13C标记的菌源代谢物,其中P. distasonis产生的长链脂肪酸十五烷酸能够通过修复肠道黏膜屏障功能抑制非酒精性脂肪性肝炎的发展[84]。相比于肠道菌群产生的物质,肠道细菌也能够影响膳食组分中代谢物的释放。在无菌小鼠中定殖14株肠道共生菌后给小鼠饮食中添加柑橘纤维,结果发现在小鼠粪便中检测到大量的N-甲基血清素。进一步的研究表明,B. ovatus能够通过调控PL9等碳水化合物活性酶(carbohydrate-active enzymes, CAZyme)将柑橘纤维分解,进一步释放其中的N-甲基血清素,并且该物质能够影响小鼠的肥胖、新陈代谢和肠道运动[85]。此外,也有大量研究聚焦膳食纤维对SCFAs产生菌的影响,通过提升SCFAs的水平影响宿主健康[86-88]。这些结果表明膳食纤维能够影响肠道中菌源代谢物的水平,通过多种途径调控宿主代谢。
3.2 酚类物质
酚类化合物是植物中分布最广的次生代谢产物之一,是植源性食物(如水果、蔬菜、谷物、咖啡和茶饮料)的主要活性成分之一。目前已经在高等植物中鉴定出数千种多酚化合物,其中在食用植物中发现了数百种[89-90]。人体摄入多酚后,少部分非糖基化酚醛化合物如单体黄烷- 3-醇、原花青素二聚体(游离酚)等可被小肠吸收,经过氧化、还原和水解,在肠细胞和肝细胞中参加生物转化,形成一系列的水溶性共轭代谢物迅速释放进入体循环进而分配到各器官或以尿液形式排出[91]。大部分多酚以结合酚(比例为90%–95%)的形式存在,无法被消化吸收,而是在肠道中被微生物进行代谢[92-93]。同时,摄入多酚后也会改变肠道菌群的组成,选择性促进某些细菌的生长,抑制有害菌的生长,并且还会改变肠道微生物的代谢表达,从而调节肠道微生态促进宿主健康[94-95]。
大豆异黄酮是豆类中重要的一种生物活性物质,天然形式的大豆异黄酮主要以糖苷的形式存在,生物利用度低。近期研究表明肠道中的阴道乳杆菌(Lactobacillus vaginalis)能够产生β-半乳糖苷酶,将食物中糖甙形式的大豆异黄酮转化生成游离形式的黄豆苷元,进一步靶向抑制肝细胞Fdps基因表达,激活肝细胞AKT-GSK3β-Nrf2信号轴,抑制肝脏细胞铁死亡,保护对乙酰氨基酚(acetaminophen, APAP)诱导的急性肝损伤[96]。果蔬调控宿主代谢的机制通常都归因于其中酚类物质的抗氧化活性。在最近的一项研究中,研究人员发现黄酮改善宿主代谢的益处部分取决于肠道微生物的代谢。黄酮能够被肠道珀氏解黄酮菌(Flavonifractor plautii)代谢生成4-羟基苯乙酸(4-hydroxyphenylacetic acid, 4-HPAA),该物质能够通过激活肝脏腺苷单磷酸活化蛋白激酶α,调控脂肪酸氧化和脂肪从头合成改善高脂诱导的肝脏脂肪变性[97]。而另一项研究也表明,多甲氧基黄酮干预显著增加了B. ovatus的丰度,以肠道菌群依赖的方式降解肠道和循环中的支链氨基酸水平并改善高脂诱导的代谢紊乱[98]。此外,普洱茶中的茶褐素也能够影响肠道菌群结构,降低BSH活性相关细菌的丰度,增加回肠结合型胆汁酸水平,从而抑制肠内FXR-FGF15信号通路,导致肝脏胆汁酸生成和粪便排泄增加,降低肝脏胆固醇水平和脂肪生成[99]。
3.3 其他膳食组分
除了膳食纤维和酚类物质外,其他植源性物质或提取物也能够通过调控菌源代谢物影响宿主代谢。Quan等[70]发现使用人参提取物干预小鼠后显著改善了小鼠的肥胖状态和肠道菌群组成,其中肠道粪肠球菌(Enterococcus faecalis)丰度显著增加。粪肠球菌主要是通过激活脂肪产热途径改善肥胖,并且进一步的研究也证明该菌通过ACOT产生的代谢物肉豆蔻油酸(myristoleic acid,MA,一种不饱和长链脂肪酸),激活肥胖小鼠的棕色脂肪产热以及诱导米色脂肪的形成减少脂肪囤积,改善肥胖。另一项研究也发现卡姆果提取物(camu camu, CC)能通过激活小鼠棕色脂肪组织产热和促进能量消耗预防高脂饮食诱导的小鼠体重增加和肝脏脂肪变性;补充CC改变了小鼠的肠道菌群组成(增加了嗜黏蛋白阿克曼氏菌的丰度,减少了乳杆菌的丰度),并且增加了小鼠血浆中次级胆汁酸和游离型胆汁酸的丰度,可能是次级胆汁酸进一步激活脂肪TGR5促进产热介导的代谢改善作用[100]。此外,中国科学院微生物所刘宏伟教授团队长期致力于活性天然产物与肠道菌群领域的研究,并取得了一系列的突破性进展[101]。例如发现灵芝杂萜衍生物(ganoderma meroterpene derivative, GMD)干预能够通过减轻内毒素血症、增强脂质氧化和减少脂质生成缓解fa/fa大鼠的非酒精性脂肪性肝病(nonalcoholic fatty liver disease, NAFLD)表型[102];后续的机制研究发现GMD显著富集了参与叶酸生物合成的解木聚糖拟杆菌(Bacteroides xylanisolvens)、多形拟杆菌(Bacteroides thetaiotaomicron)、单形拟杆菌(Bacteroides uniformis)和多氏拟杆菌(Bacteroides dorei)的丰度,通过叶酸合成基因folp生成叶酸激活相关肠-肝信号通路改善NAFLD。该团队后续的研究还发现GDM能够改善动脉粥样硬化小鼠的糖脂代谢和动脉硬化。GDM显著增加了粪副拟杆菌(Parabacteroides merdae)的丰度,通过porA基因降解肠道支链氨基酸(branched-chain amino acid, BCAA),抑制动脉斑块巨噬细胞mTORC1通路的激活进而改善动脉粥样硬化[103]。
4 结论与展望
肠道菌群通过产生或修饰各种代谢物影响宿主代谢,包括免疫、发育以及新陈代谢在内的多种生理功能。目前这一研究领域在其基础和转化层面仍然存在巨大挑战。虽然研究人员已重点关注肠道菌群对整体功能性代谢的影响,但仍有许多问题有待深入探索,包括对宿主体内大量尚未知晓的菌源代谢物进行注释,对来自宿主、微生物和饮食来源的化合物或其混合来源的区分方法,宿主与菌群共代谢过程中菌群代谢物的贡献等。此外,膳食营养干预引起了整体微生物组的变化,如何有效识别其中的关键功能菌并进行验证仍然是研究过程中的重点和难点。目前为止,只有极少数的研究得到了验证并用于指导人群干预或临床实践,未来的研究仍然需要进一步将微生物组数据与其他组学数据和生物临床变量结合,深入解析肠道菌发挥功能的机制。
免责声明:本内容来自腾讯平台创作者,不代表腾讯新闻或腾讯网的观点和立场。
 举报
举报
相关知识
7.功能糖资源挖掘团队
医科院药物所戴均贵、陈大伟团队与中国科学院微生物所刘宏伟团队JACS:利用糖基转移酶为探针定向挖掘真菌源活性糖苷分子
青年论坛文章推荐——靶向肠道菌群的精准膳食干预/中国食品科学技术学会
业界:挖掘益生菌资源 推动健康食品产业发展
农业农村部食物与营养发展研究所食物资源监测与营养健康评价创新团队2024年招聘博士后公告
AIR观点|聂再清:数据驱动的个性化营养健康管理是慢病管理的核心
Science丨乔杰/雷晓光与合作者报道肠道菌群调控代谢性疾病的新角色——菌源宿主同工酶
食源益生菌与饮食干预对脂代谢的影响研究进展.docx
以营养为导向 挖掘食品资源 满足健康需求 2024新和成人类营养高质量发展论坛绍兴举办
物联网健康数据挖掘与精准医疗
网址: 聂少平团队|菌源代谢物挖掘与膳食营养干预 https://m.trfsz.com/newsview1526839.html

