氨基酸揭示为肝脏脂肪合成的主要碳源,研究揭示营养代谢新机制
非酒精性脂肪肝病(NAFLD)是一种由肝脏脂肪过度堆积引发的系列肝脏病症,可能逐步演变为脂肪性肝炎(NASH)、肝纤维化、肝硬化,甚至导致肝癌及其他终末期肝脏疾病。尽管全球成年人中脂肪肝的发病率已高达三分之一左右,但目前仅有一款针对NASH的药物获得FDA批准。鉴于该疾病中普遍存在的代谢功能障碍,其名称已更改为代谢相关脂肪性肝病(MASLD)及肝炎(MASH),以更准确地描述疾病特征及成因。然而,脂肪肝的发病机制涉及复杂的代谢重编程,其背后的代谢本质尚不完全清楚。
脂质从头合成(DNL)是利用碳水化合物和蛋白质等前体合成脂肪的过程,其升高是肥胖人群脂肪肝的核心代谢变化。尽管靶向DNL关键酶的药物效果良好,但这种单一治疗方式也带来了一些毒副作用,提示我们需要更深入地理解肝脏脂肪合成的途径。营养物质吸收和代谢为脂质从头合成提供必要的前体物质,对于维持脂合成的活性至关重要。然而,关于脂肪合成前体的定量分析存在诸多固有局限,尽管前人已为此付出半个多世纪的努力,但肝脏中超过一半的脂肪酸前体来源仍待揭示。
近日,中科中山药物创新研究院(ZIDD)国际中心廖一烈、新加坡科技研究局(A*STAR)分子细胞研究所(IMCB)韩卫平团队、广州实验室傅肃能团队以及清华大学生命科学学院合作,在Cell Metabolism杂志上发表新研究。该研究首次鉴定出肝脏新生脂肪酸中超过70%的碳原子来源于氨基酸,揭示了膳食蛋白质和氨基酸代谢在肝脏脂合成及脂肪肝发生发展中的核心作用。
为了深入探究脂肪肝的发病机制,研究团队首先借助美国国家健康和营养检查调查(NHANES)数据库进行了大规模的流行病学分析。这一分析覆盖了三大宏量营养素——碳水化合物、蛋白质和脂肪,与脂肪肝病的关系。出乎意料的是,传统观念中认为的主要脂合成底物,即碳水化合物,并未显示出与脂肪肝病发病率之间的显著关联。相反,蛋白质的摄入量与代谢相关脂肪性肝病(MASLD)的风险增加呈现出明显的正相关。特别是在MASH方面,高膳食蛋白质摄入的人群发病率显著升高,甚至接近高脂摄入人群的水平,而高碳水摄入则与更低的疾病风险相关。这一与既有认知相悖的发现,揭示了肝脏在营养代谢方面可能存在特殊的模式。
流行病学研究指出,蛋白质及其代谢产物氨基酸在脂肪肝的发生和发展中扮演着关键角色。为了进一步验证这一发现,研究团队对小鼠的原代肝脏细胞进行了深入的研究。通过代谢流分析,他们直接定量了不同营养物质在肝细胞代谢中的具体贡献。结果显示,氨基酸成为肝细胞线粒体呼吸的主要底物,其贡献远大于葡萄糖。更进一步的13C同位素示踪实验揭示,在肝细胞的中心碳代谢过程中,葡萄糖的直接贡献微乎其微,而氨基酸,特别是谷氨酰胺,则成为三羧酸循环的关键底物。
由于三羧酸循环是脂质从头合成的重要前体物质来源,研究团队进一步对肝细胞的脂肪酸进行了13C标记研究。结果令人瞩目:与三羧酸循环的结果相吻合,谷氨酰胺为肝细胞中新生脂肪酸提供的碳原子数量显著多于葡萄糖,甚至高出8至40倍,其贡献与果糖相当。在对比了6种主要的营养底物后,研究团队发现,包括乳酸、乙酸以及各种氨基酸在内的底物,对肝细胞脂肪酸合成的贡献均显著高于葡萄糖。特别是在体外培养环境的底物浓度条件下,氨基酸成为原代肝细胞脂合成过程中的最主要碳供体。
为了进一步验证之前的结论,研究团队设计了一项实验,将13C标记的葡萄糖和氨基酸以15%和5%的比例混合后掺入水中,喂养小鼠持续24小时。这一方法使得研究团队能够首次在活体水平上对脂肪酸进行高效标记,并追踪到肝脏脂合成中约75%的膳食碳源。结果显示,在体内环境下,葡萄糖和氨基酸都对肝脏新合成的脂肪酸有显著贡献。值得注意的是,相同质量下,肝脏利用氨基酸进行脂合成的效率大约是葡萄糖的两倍。
这一发现揭示,葡萄糖的碳原子主要在肝脏外通过合成次级代谢物(如乳酸、乙酸、非必需氨基酸等)来为脂合成提供碳源,而氨基酸则能直接通过肝脏代谢进入脂合成途径。最终,膳食中的葡萄糖和氨基酸(质量比约为3:1)分别贡献了45%和30%的新合成脂肪酸。
氨基酸对肝脏脂合成的显著且直接贡献,提示其代谢可能成为治疗脂肪肝的新靶点。为了进一步探索这一可能性,研究者检测了脂肪肝模型——肥胖小鼠(ob/ob)中的代谢变化。他们发现,与正常小鼠相比,肥胖小鼠肝脏中的逆向TCA(还原型羧化)过程增强,而正向TCA介导的氨基酸氧化分解则减弱,这导致更多的氨基酸被引入脂合成途径。
接下来,研究者尝试通过抑制剂或基因沉默的方式抑制氨基酸摄入或还原型羧化过程,结果成功地抑制了肝细胞的脂肪积累。相反,他们通过在肥胖小鼠肝脏中过表达谷氨酸脱氢酶(GLUD1),将原本用于脂合成的氨基酸代谢流转向彻底氧化分解,从而降低了脂合成的底物可及性,并显著缓解了肥胖小鼠的肝脏脂肪变性。
最后,流行病学与代谢流的分析结果提示,减少膳食蛋白(氨基酸的主要来源)的摄入可能对脂肪肝的防治有益。为了验证这一假设,研究团队设计了低蛋白饲料,并用以喂养肥胖小鼠。结果显示,与对照组(蛋白占比25%)相比,低蛋白组(蛋白占比5%)小鼠的肝脏脂滴显著缩小,肝损伤程度也有所减轻(血液中的谷丙转氨酶ALT活性降低)。转录组学数据进一步证实,低蛋白饮食导致小鼠肝脏中脂合成通路的基因表达显著下调。同时,这种饮食还促进了小鼠体重的下降,尽管这可能与它对食欲的抑制作用有关。值得注意的是,氨基酸在脂合成中的关键作用并非仅限于其作为底物的功能,还可能涉及包括氨基酸介导的信号转导在内的复杂机制。综上所述,低蛋白饮食对肥胖小鼠的脂肪肝具有改善作用,但其对肝纤维化、肝硬化等疾病的影响尚需进一步研究。
此外,尽管氨基酸在脂合成中扮演着重要角色,但这并不意味着营养学意义上的高蛋白饮食会加剧脂肪肝的形成。实际上,高蛋白饮食(能量占比≥35%)已被证明能够减少肝脏中的脂肪堆积。因此,膳食蛋白摄入与脂肪肝之间的关系呈现出一种“过犹不及”的现象。这可能与蛋白质或氨基酸对DNL以外的其他脂肪代谢途径(如脂质吸收、脂蛋白分泌、脂肪酸分解等)的复杂调控有关。同时,20种氨基酸对代谢相关信号通路的影响也各不相同,例如支链氨基酸(BCAA)对mTOR信号的激活作用,以及半胱氨酸等氨基酸对食欲的抑制效应。因此,蛋白质和氨基酸对机体代谢的全面影响仍有待进一步研究来深入阐明。
在脂肪组织中,碳水化合物是脂质从头合成的经典底物。然而,在肝脏中,情况则有所不同。葡萄糖会优先储存为糖原,仅有1-2%的葡萄糖会进入脂肪合成途径。尽管如此,大量同位素示踪研究显示,相较于乳酸、丙酮酸、丙氨酸等中间代谢物,葡萄糖本身对肝脏脂肪酸合成的贡献其实相对较小。
面对这一现象,Joseph Katz和J. Denis McGarry等科学家在1980年代提出了“葡萄糖悖论”的假说。他们认为,尽管糖的摄入对肝脏脂合成具有促进作用,但肝脏脂合成的主要底物并非直接来自葡萄糖。尽管近年来关于循环代谢物的代谢流定量分析取得了进展,但这些中间代谢物通常是由膳食营养素在肠道或组织内代谢生成的,而非日常食物中的主要成分。因此,肝脏脂合成中的大部分膳食前体来源仍然是一个谜团。
经过半个多世纪的探索,本研究终于揭开了这一谜团。我们发现,长期被忽视的氨基酸竟然是肝脏脂合成的重要原料。同时,我们也揭示了葡萄糖主要通过其次级代谢途径(如合成乳酸、乙酸、非必需氨基酸等)为肝脏脂合成提供碳源。这一发现与近年来Rabinowitz团队和傅肃能团队的新研究相一致,即来源于葡萄糖的乳酸是TCA及脂合成的关键底物,这一发现填补了代谢框架中的重要一环。
回溯到1877年,法国生理学家克劳德·伯纳德在《糖尿病讲义》中探讨了一个关键问题:“糖在这种情境下究竟扮演何种角色——是作为‘营养刺激物’发挥作用,还是直接转化为糖原?我倾向于认为,前者更为贴切。”这一论断在近150年的岁月里一直吸引着科学家们的关注。直至今天,Rabinowitz团队、Locasale团队以及傅肃能团队等众多研究者,通过详尽的代谢流分析,重新审视了早年的同位素示踪研究,揭示了葡萄糖及其衍生物的详尽代谢路径和底物贡献。我们的研究进一步揭开了除葡萄糖以外的另一半碳代谢底物的神秘面纱,也为“葡萄糖悖论”提供了强有力的解答。
对于大多数细胞而言,氨基酸并非能量代谢和脂合成的理想底物,这主要归因于氨的毒性问题。然而,肝脏作为全身氨基酸的汇聚地,拥有完善的氨代谢系统和高度活跃的氨基酸代谢酶。在将氨基酸脱下的氨基转化为尿素后,剩余的碳可以通过糖异生、氧化分解等多种途径进行处理,这为氨基酸的碳骨架进入脂合成途径创造了条件。此外,肝脏还扮演着糖和脂肪的储存仓库及中转站的双重角色,对这两大营养物质的利用相对较少。这种独特的代谢模式使肝脏能够高效处理氨基酸,充分利用其产物,同时对糖的利用保持“节俭”,从而为机体储存和供应能量。这一机制与肝脏维持全身代谢平衡的使命高度契合,确保了肝脏在营养底物利用方面的优先地位,这也可能是其作为氨代谢中心、糖脂储备仓库与中转站的基础。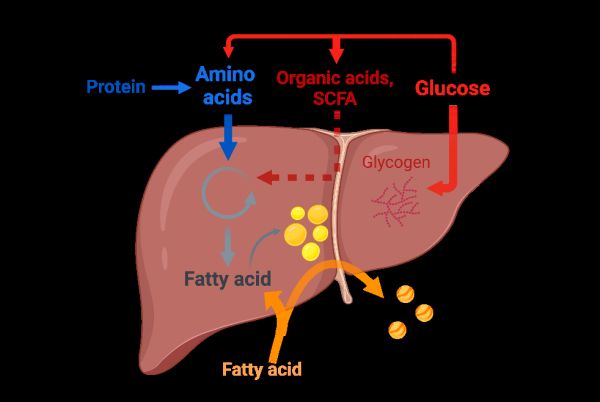
最后,鉴于氨基酸代谢在肝脏中的核心地位,其紊乱可能引发多种肝脏功能异常和疾病。韩卫平团队的研究揭示,肝癌中存在代谢重编程,尤其是BCAA等多种氨基酸的代谢异常,与肝癌的发生发展紧密相关。本文的研究进一步将这一发现拓展至早期肝脏疾病,同时指出氨基酸代谢失调可能是脂肪肝炎向肝癌转变的关键环节。
该论文的第一兼通讯作者是中科中山药物创新研究院国际中心的助理研究员廖一烈(清华大学已毕业博士生、生物岛实验室已出站博士后)。广州实验室的傅肃能教授和新加坡科技研究局分子细胞研究所的韩卫平教授担任共同通讯作者。清华大学已毕业博士生刘雷和广州实验室助理研究员陈绮珊对该研究做出了重要贡献。研究中的质谱分析主要依托清华大学代谢组学平台,部分检测得到清华大学药学技术中心的协助。中山药创院李佳课题组为该研究提供了强有力的支持和帮助。
Cell Metabolism 封面图
该封面图巧妙地融合了中国山水画的深远意境,通过隐喻的方式展现了氨基酸与糖在代谢过程中的不同命运。其中,蓝色瀑布象征着氨基酸的代谢流向,它直截了当地流入代表肝脏脂肪堆积的池中,彰显了氨基酸在肝脏脂肪合成中的直接作用。而红色河流则代表葡萄糖的代谢路径,大部分葡萄糖先流入象征糖原合成的湖泊,其蜿蜒曲折的支流则象征着肝脏外的次级代谢过程,最终通过间接途径汇入脂肪肝池中。这一研究不仅深入探索了肝脏脂肪合成的源头,更全面揭示了肝脏营养代谢的复杂图景。
Liao, Y., Liu, L., Li, H., Bai, X., Sun, F., Xiao, X., and Fu, S. (2021). Glucose and amino acid metabolism interact to promote hepatic de novo lipogenesis and steatosis. bioRxiv, pp.2021- Katz, J., and McGarry, J.D. (1984). The glucose paradox: Is glucose a viable substrate for liver metabolism? The Journal of clinical investigation 74, 1901-19 Hui, S., Ghergurovich, J.M., Morscher, R.J., Jang, C., Teng, X., Lu, W., Esparza, L.A., Reya, T., Le, Z., Yanxiang Guo, J., et al. (2017). Glucose fuels the TCA cycle through circulating lactate. Nature 551, 115-1
Chen, Q., Li, H., Tian, H., Lam, S.M., Liao, Y., Zhang, Z., Dong, M., Chen, S., Yao, Y., Meng, J., and colleagues. (2023). Comprehensive Analysis of Reaction Rates and Lipid Turnover in Mus musculus. Cell Metabolism 35, 711-721 e Ericksen, R.E., Lim, S.L., McDonnell, E., Shuen, W.H., Vadiveloo, M., White, P.J., Ding, Z., Kwok, R., Lee, P., Radda, G.K., and Toh, H.C., et al. (2019). BCAA Catabolism Loss in Carcinogenesis Activates mTORC1 and Accelerates Tumor Development and Progression. Cell Metabolism 29(5), 1151-11
Ding, Z., Ericksen, R.E., Escande-Beillard, N., Lee, Q.Y., Loh, A., Denil, S., Steckel, M., Haegebarth, A., Ho, T.S.W., Chow, P., and Toh, H.C., et al. (2020). Proline Biosynthesis Pathway Identified as a Key Driver of Liver Tumorigenesis. Journal of Hepatology 72(4), 725-7
相关知识
丝氨酸变脂肪?张昭悦等揭示肝脏脂肪合成新途径
营养与健康所乐颖影研究组揭示非酒精性脂肪肝中脂质合成增加的新机制
我学者揭示肝癌酮体代谢调控新机制
专家点评Science丨黄波团队揭示肝脏储存营养的底层逻辑并找到干预脂肪肝的利器
《科学》:揭示肝脏储存营养逻辑,助力脂肪肝防治—新闻—科学网
Cell论文揭示精氨酸驱动代谢重编程促进肝癌生长
武汉大学揭示脂肪酸代谢调控内胚层分化的分子机制
研究揭示节食后体脂反弹和肥胖的机制及营养干预策略
赵世民团队揭示氨基酸代谢失调促胰岛素抵抗的分子机制
17个关键基因揭示代谢功能障碍脂肪肝的遗传秘密
网址: 氨基酸揭示为肝脏脂肪合成的主要碳源,研究揭示营养代谢新机制 https://m.trfsz.com/newsview1605056.html