糖酵解研究的新进展:从机制到疾病治疗潜力

近年来,糖酵解领域的研究因其在生物医学领域的显著潜力而备受瞩目,吸引了国家自然科学基金的广泛关注,并有多项研究项目因此获得了资助。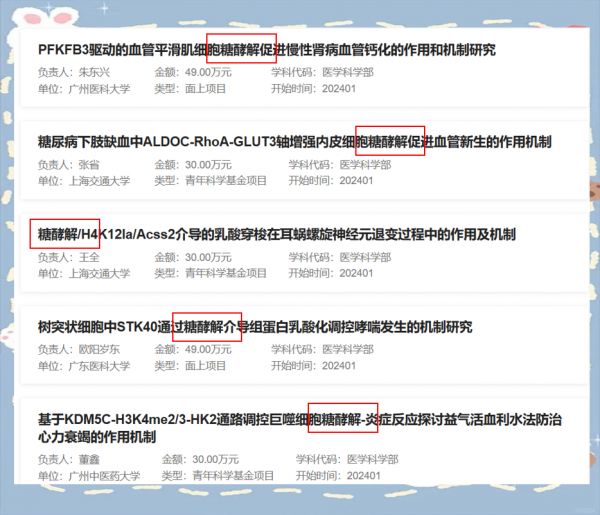
糖酵解,这一生物体内的关键代谢过程,将葡萄糖高效转化为丙酮酸,并释放出少量能量和还原型烟酰胺腺嘌呤核苷酸。在缺氧环境下,这一过程显得尤为关键,因为它允许细胞在无氧状态下持续产生能量。糖酵解包含多个核心步骤:首先,葡萄糖通过磷酸化和异构化转化为葡萄糖-6-磷酸,再进一步转变为果糖-6-磷酸;随后,果糖-1,6-二磷酸经过裂解,生成两个三碳分子。最终,通过一系列反应,这些分子被转化为丙酮酸,同时释放出ATP和NADH。
糖酵解与众多疾病息息相关,特别是在癌症、糖尿病和心血管疾病领域。例如,癌症细胞会利用糖酵解来满足其快速生长的能量需求,即使在充足氧气的情况下也会进行这一过程,被称为“沃伯格效应”。糖尿病患者的胰岛素抵抗或分泌不足会干扰糖酵解的正常进行,导致能量供应不足和高血糖。而在心血管疾病中,心肌细胞可能会因缺氧而依赖糖酵解来维持功能,但长时间的无氧糖酵解会积累酸性代谢产物,进一步损害心肌细胞。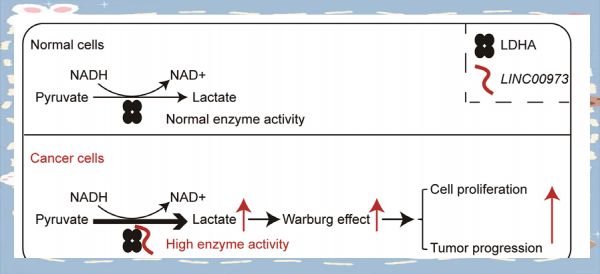
肿瘤细胞有氧糖酵解特异激活的新机制
糖酵解为何受到如此关注?这背后有多重原因。首先,糖酵解途径的深入研究对于推动细胞代谢机制的基础科学研究至关重要,进而揭示生命活动的内在规律。其次,糖酵解过程中的关键酶和调控因子已逐渐成为众多疾病,特别是癌症和代谢性疾病治疗的重要靶点。通过抑制这些关键酶,可以有效地阻断肿瘤细胞的能量供应,为治疗提供新策略。此外,糖酵解研究还为药物开发提供了新的方向,科学家们可以据此设计和开发出能够调节糖酵解途径、治疗相关疾病的药物,从而提升患者的生活质量。综上所述,糖酵解不仅是我们理解生物化学过程的基础概念,也是医学研究和药物开发领域的前沿热点。
肿瘤细胞有氧糖酵解特异激活的新机制
糖酵解,这一细胞内的基础代谢过程,近年来备受科研领域的关注。其背后的原因多方面的:首先,深入探究糖酵解途径对于推动细胞代谢机制的基础研究、揭示生命活动的内在规律具有重要意义;其次,糖酵解过程中的关键酶和调控因子已成为众多疾病,尤其是癌症和代谢性疾病治疗的重要靶点,通过抑制这些关键酶,可以有效阻断肿瘤细胞的能量供应,为治疗提供新策略;此外,糖酵解研究还为药物开发提供了新的方向,科学家们据此设计和开发的药物有望调节糖酵解途径、治疗相关疾病,从而提升患者的生活质量。综上所述,糖酵解不仅是理解生物化学过程的基础概念,更是医学研究和药物开发领域的前沿热点。
2. EGR1通过转录下调PFKL抑制HCC生长和有氧糖酵解
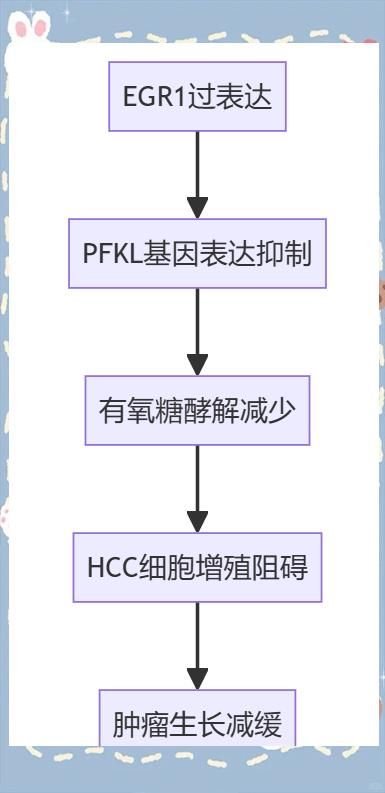
背景:肝细胞癌(HCC)是一个全球公共卫生难题,其当前治疗效果欠佳且治疗靶点有限。本研究旨在探讨早期生长反应1(EGR1)作为HCC的转录因子靶标的作用,并评估其作为基因治疗靶点的潜力。
方法:通过体外和体内实验,我们研究了EGR1对HCC生长的影响。利用小鼠HCC模型和人类类器官技术,我们评估了EGR1基因疗法在HCC治疗中的潜力。同时,深入探讨了EGR1调控基因表达和抑制HCC生长的分子机制。
结果:我们发现,HCC中EGR1的表达水平显著降低,这促进了HCC细胞的增殖和肿瘤的生长。相反,EGR1的过表达则抑制了HCC细胞的增殖和肿瘤的发展。此外,通过体内外实验验证,EGR1基因疗法对HCC具有显著的疗效,进一步证实了EGR1在HCC中的抗癌作用。
机理研究显示,EGR1与肝型磷酸果糖激酶-1启动子区(PFKL)相互作用,从而抑制了PFKL基因的表达和其介导的有氧糖酵解。此外,我们还发现,EGR1能增加HCC细胞和异种移植肿瘤对索拉非尼的敏感性。
结论:综上所述,我们的研究揭示了EGR1作为HCC肿瘤抑制基因的治疗潜力,为HCC患者提供了新的治疗选择和希望。
2024年1月
3. AKT1通过磷酸化细胞质ME2促进肿瘤细胞糖酵解
发文期刊:《Nature Communications》IF:16.6
摘要:肿瘤细胞常依赖于有氧糖酵解来满足其高能量和生物合成需求,但糖酵解的调控机制及其与肿瘤细胞其他代谢途径的协同作用尚不清楚。本文揭示了AKT1通过磷酸化细胞质苹果酸酶2(ME2)来诱导线粒体代谢向糖酵解的转换。这种转换依赖于ME2的全长形式(ME2fl),它能够增强糖酵解的表型。具体来说,AKT1在ME2fl的N末端线粒体定位信号肽的丝氨酸9处进行磷酸化,从而阻止其线粒体易位。与调控三羧酸(TCA)循环的线粒体ME2不同,ME2fl作为支架,将关键的糖酵解酶如磷酸果糖激酶(PFKL)、甘油醛-3-磷酸脱氢酶(GAPDH)和丙酮酸激酶M2(PKM2)以及乳酸脱氢酶A(LDHA)聚集在一起,促进胞质溶胶中的糖酵解。因此,AKT1通过磷酸化ME2fl增强了肿瘤细胞在体内外的糖酵解能力,揭示了AKT1介导的ME2亚细胞易位转换在肿瘤细胞代谢适应中的关键作用。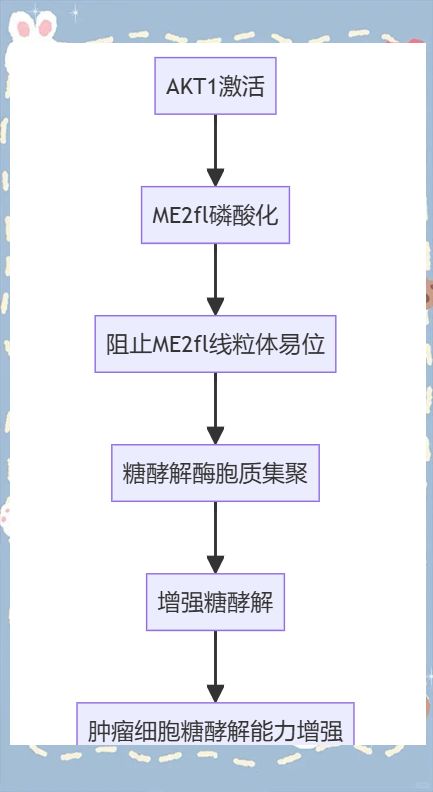
4. Serum amyloid A facilitates glycolysis in neutrophils during resistance to PD-1 blockade in hepatocellular carcinoma
发文期刊:《Nature Communications》IF:16.6
摘要:肝细胞癌(HCC)对程序性死亡受体1(PD-1)阻断治疗的反应差异显著。本研究揭示,血清淀粉样蛋白A(SAA)的循环水平在预测HCC对抗PD-1治疗的耐药性方面具有显著价值,特别是当其浓度超过20.0mg/L时。进一步研究显示,在PD-1抑制后疾病进展的患者中,瘤周SAA的表达与循环SAA水平呈现出高度相关性。体外实验表明,SAA能够诱导中性粒细胞通过LDHA/STAT3途径激活糖酵解,进而表达PD-L1并释放抑癌素M,从而削弱细胞毒性T细胞的功能。体内实验也证实,通过遗传或药理学手段抑制STAT3或SAA可以消除中性粒细胞介导的免疫抑制,并增强抗PD-1治疗的抗肿瘤效果。这些研究结果揭示,SAA可能是一种与HCC抗PD-1耐药性密切相关的关键炎症细胞因子,而针对SAA诱导的PD-L1中性粒细胞的STAT3或SAA抑制策略可能为克服抗PD-1耐药性提供新的治疗思路。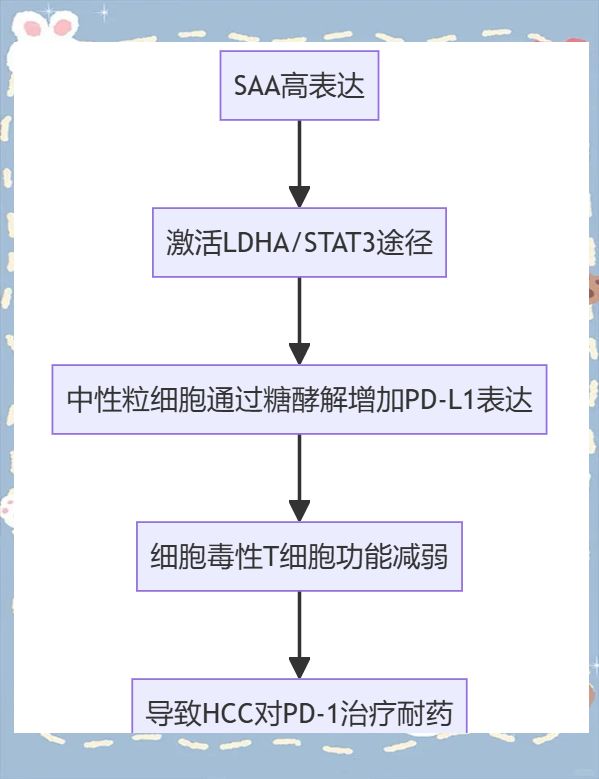
5. NMNAT2 通过维持 NAD 稳态促进囊泡糖酵解,从而支持快速轴突转运
发文期刊:《Molecular Neurodegeneration》IF:15.1
背景:在神经退行性疾病的早期阶段,常会出现生物能量适应不良和轴突病变。烟酰胺腺嘌呤二核苷酸(NAD)作为能量代谢的关键辅助因子,其合成主要依赖于中枢神经系统神经元中的烟酰胺单核苷酸腺苷酸转移酶2(NMNAT2)。然而,在阿尔茨海默氏症、帕金森氏症和亨廷顿氏病等大脑疾病中,NMNAT2的mRNA水平会显著降低。这引发了我们对于皮质谷氨酸能神经元轴突健康与NMNAT2之间关系的探究,尤其是考虑到这些长轴突在神经退行性疾病中的脆弱性。此外,我们还试图验证NMNAT2是否通过确保轴突转运所需的ATP水平来维护轴突健康,因为这对于轴突功能的正常发挥至关重要。
方法:为了深入探讨这些问题,我们构建了小鼠和培养的神经元模型,以观察皮质谷氨酸能神经元中NMNAT2的缺失对轴突转运、能量代谢以及形态完整性的具体影响。同时,我们探索了外源性NAD补充、抑制NAD水解酶,以及无菌α和TIR基序蛋白1(SARM1)是否能够有效预防由NMNAT2缺失引发的轴突缺陷。在研究过程中,我们综合运用了遗传学、分子生物学、免疫组化、生物化学、荧光延时成像、光学传感器实时成像以及反义寡核苷酸等多种技术手段。
结果:我们通过体内实验证实,谷氨酸能神经元中的NMNAT2对于轴突存活至关重要。通过体内和体外研究,我们发现NMNAT2能够维持NAD的氧化还原状态,从而通过糖酵解为远端轴突中的囊泡货物提供必要的“板载”ATP。当给NMNAT2敲除(KO)神经元补充外源性NAD时,糖酵解得以恢复,进而快速轴突转运也得到恢复。此外,我们在体内和体外还发现,降低SARM1(一种NAD降解酶)的活性可以减轻轴突转运的缺陷,并抑制NMNAT2敲除神经元中的轴突变性。
结论:NMNAT2通过保持远端轴突中的NAD氧化还原平衡,确保了轴突的健康,从而为快速轴突转运提供了有效的囊泡糖酵解支持。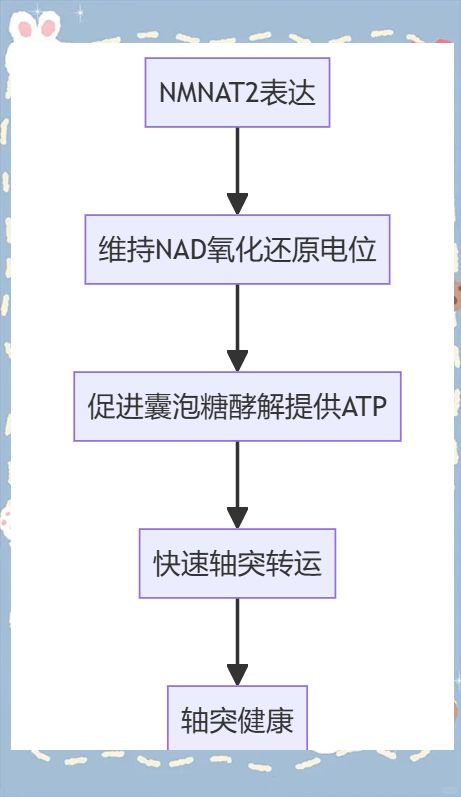
小结
综上所述,糖酵解的研究可以通过深入探讨其在癌症、代谢疾病、心血管疾病以及神经退行性疾病等复杂疾病状态中的作用来进一步发展。特别值得关注的是,糖酵解在为肿瘤提供能量和生物合成原料方面所扮演的角色,以及它如何通过关键酶如磷酸果糖激酶1(PFKL)和乳酸脱氢酶A(LDHA)的精细调控与疾病的进展密切相关。此外,研究糖酵解与炎症反应之间的相互影响及其对治疗效果的影响也具有重要意义,例如探究血清淀粉样蛋白A(SAA)如何通过LDHA/信号转导与转录激活因子3(STAT3)信号通路来调节免疫细胞的功能。这些研究不仅有助于深化我们对糖酵解生物学基础的理解,也为开发新的治疗策略提供了坚实的科学依据。
举报/反馈
相关知识
糖原代谢调控与疾病研究的新进展
新型高效糖尿病治疗药物开发研究获进展
针灸治疗肥胖症机制研究进展
海洋药物在肾脏疾病治疗中的研究进展.pptx
糖尿病新型药物研究进展.docx
酰基羧酸水解酶在疾病中的作用及机制研究进展
《Cell》50年代谢研究总结——糖尿病的进展与机遇
饮食辅助治疗HIV 患者的研究进展
杂粮发酵食品的健康和治疗潜力
综述|音乐疗法在肺部疾病康复治疗中的研究进展
网址: 糖酵解研究的新进展:从机制到疾病治疗潜力 https://m.trfsz.com/newsview1775316.html

