聚合物对生物医学研究和医疗实践影响
5.1 简介
生物材料是一个令人兴奋的、高度多学科的领域。这些材料已经发展成为现代改善人类健康和生活质量不可或缺的元素。生物材料的应用范围从基因阵列和生物传感器等诊断,到血袋和手术工具等医疗用品,到医疗植入物和设备等治疗,再到涉及组织工程皮肤和软骨的新兴再生医学等。一般将生物材料分为三大类:金属、陶瓷和聚合物。聚合物本质上是有机的,具有金属和陶瓷无法比拟的多功能性。聚合物可以提供的广泛物理、机械和化学特性推动了聚合物生物材料的广泛研究、开发和应用。此外,聚合物在生物材料领域的重要性清楚地反映在医用聚合物惊人的市场规模上,估计约为 10 亿美元,每年增长率为 10-20%。
本章简要概述了多年来聚合物在医学领域做出的开创性贡献。这里讨论的许多聚合物最初是作为塑料、弹性体和纤维开发的,用于非医疗工业应用。二战后,外科医生“借用”它们来解决医疗问题。从那时起,它们就导致了生物医学专用材料的发展。目前,随着现代生物学和协作努力的快速发展,涉及材料科学、工程、化学、生物学和医学的跨学科工作正在产生具有生物活性、仿生性、最重要的是具有优异生物相容性的聚合物生物材料。本章还包括这种新一代聚合物生物材料的例子。
5.2 眼科中的聚合物生物材料
眼科专注于眼睛疾病,眼睛是日常生活中复杂而重要的器官。生物材料在眼科中的应用可以追溯到十九世纪中叶,当时阿道夫·菲克成功发明了玻璃隐形眼镜。从那时起,各种各样的眼科生物材料被开发出来,其中一些在临床应用中取得了巨大的成功。生物材料在眼科中的应用包括隐形眼镜、人工晶状体 (IOL)、人工眼眶壁、人工角膜、人工泪管、青光眼滤过植入物、粘弹性替代品、药物输送系统、巩膜扣带、视网膜钉和粘合剂以及眼内填充物。虽然陶瓷和金属也已用于眼科,但现代眼科植入物主要由聚合物制成。本节将重点介绍用于隐形眼镜、IOL 和人工角膜的聚合物。
5.2.1 聚合物隐形眼镜
隐形眼镜是一种放置在眼角膜上以达到矫正、治疗或美容效果的光学装置。据估计,全世界约有 1.25 亿隐形眼镜佩戴者。人们在高性能隐形眼镜材料中寻求各种主要特性,包括 (1) 良好的可见光透射率;(2) 高氧渗透性;(3) 泪膜润湿性;(4) 抗泪膜成分(如脂质、蛋白质和粘液)沉积;(5) 离子渗透性;(6) 化学稳定性;(7) 良好的热导率;(8) 易于制造。隐形眼镜中已使用了多种聚合物,它们的弹性模量决定了隐形眼镜的硬度或软度。图 5.1 显示了隐形眼镜中常用的各种单体的结构。第一代聚合物隐形眼镜由聚甲基丙烯酸甲酯 (PMMA) 制成,这种聚合物在商业上称为 Plexiglas,是硬质或刚性镜片材料的经典例子。PMMA 可以使用本体自由基聚合制备并车削成镜片形状。PMMA 隐形眼镜具有优异的光学性能,例如折射率比玻璃更高、耐久性出色,并且由于其疏水性而具有良好的抗泪膜成分沉积性。然而,PMMA 隐形眼镜的主要缺点是透氧性差和容易改变眼球形状,限制了其使用。为了提高氧气的渗透性,硬性透气性(RGP)隐形眼镜在 20 世纪 70 年代末被开发出来。
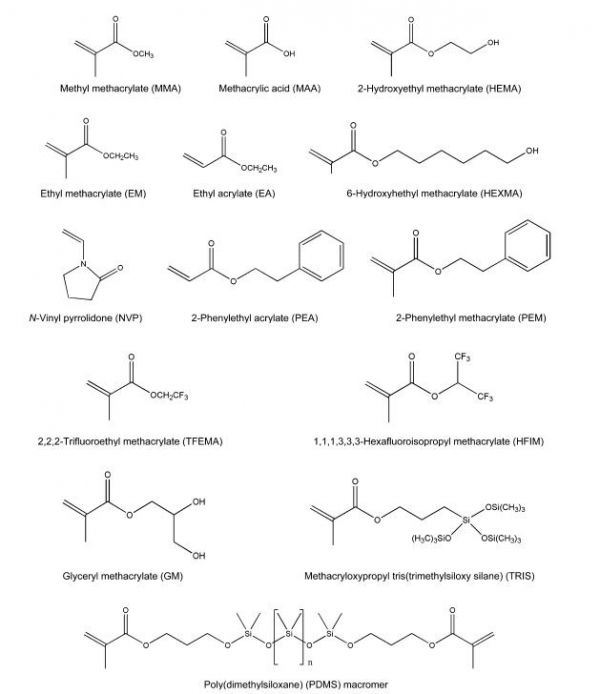
图 5.1 隐形眼镜和人工晶状体常用单体的化学结构。
用于 RGP 隐形眼镜的材料通常是甲基丙烯酸甲酯 (MMA) 与赋予高氧渗透性的单体的共聚物,例如甲基丙烯酰氧基丙基三(三甲基硅氧基硅烷) (TRIS)、六氟异丙基甲基丙烯酸酯 (HFIM) 和 2,2,2 三氟乙基甲基丙烯酸酯 (TFEMA)。将高度疏水性的硅氧烷加入共聚物中会降低镜片的润湿性,从而导致脂质沉积的不必要增加。因此,亲水性单体,例如甲基丙烯酸 (MAA)、2-羟乙基甲基丙烯酸酯 (HEMA) 或 N-乙烯基-2-吡咯烷酮 (NVP),通常用作 RGP 镜片配方中的润湿剂,以弥补润湿性的降低。
软性隐形眼镜出现于 20 世纪 60 年代,当时 Otto Wichterle 开发了聚(2-羟乙基甲基丙烯酸酯)(PHEMA),并彻底改变了隐形眼镜行业。一般来说,软性隐形眼镜由水凝胶制成,水凝胶是一种能够保留大量水分的交联网络。第一个 PHEMA 软镜片含有 40% 的水合物。尽管与硬性镜片相比,PHEMA 的佩戴舒适度有所提高,但其低氧渗透性会干扰正常的角膜代谢。由于水合程度直接影响氧气的渗透性,因此通过将 HEMA 与高亲水性单体(如 NVP、MAA 和甲基丙烯酸甘油酯 (GMA))共聚,开发了含水量高(>50%)的水凝胶。亲水性增加的一个缺点是蛋白质与镜片的结合率更高,这可能会导致不适和并发症,例如细菌粘附增加。高含水量的水凝胶也容易导致角膜干燥。为了提高透氧性,研究人员开发了一种用于软性隐形眼镜的新型含硅氧烷水凝胶。众所周知,由于硅氧烷基团(eSi(CH3)2eOe)体积大且链移动性强,含硅氧烷材料通常具有较高的氧扩散率。另一方面,硅氧烷材料具有高度疏水性,因此容易发生脂质沉积,并且橡胶状行为不太舒适。为了弥补这些缺点,将功能化硅氧烷大分子单体(如图 5.1 所示)与亲水单体(例如 NVP 和 HEMA)共聚成水凝胶,该水凝胶可提供角膜所需的足够高的透氧性,并具有柔软性,可舒适地长时间佩戴。目前,商业化的硅氧烷水凝胶隐形眼镜包括 Focus Night & Day(CIBA Vision Corp. 的 lotrafilcon A)和 PureVision(Bausch and Lomb 的 balafilcon A)。值得注意的是,这些水凝胶表面存在硅氧烷部分,需要进一步处理才能使镜片在眼睛上耐受。硅氧烷水凝胶的表面处理示例包括射频辉光放电 (RFGD) 和在镜片表面接枝聚合亲水单体(例如丙烯酰胺)以改善表面亲水性。
5.2.2 聚合物人工晶状体
IOL 通常用于替代自然晶状体,并为接受白内障手术的患者提供清晰的光学成像。IOL 是眼部生物材料研究的一个主要领域,因为它在治疗白内障引起的失明方面发挥着关键作用,预计到 2020 年,白内障引起的失明病例将达到 4000 万例。IOL 在生物材料史上也占有特殊地位,其发明源于 Harold Ridley 爵士对二战飞行员眼睛中意外植入眼罩碎片的生物反应的精确观察。由于眼罩材料 PMMA 对眼睛具有良好的耐受性,Ridley 受启发使用该材料发明了第一个生物相容性 IOL,并且它被公认为生物材料科学的开创性突破。IOL 的关键材料要求包括光学特性,即能够保持清晰的光学成像路径和长期生物相容性,因为植入物旨在永久留在眼睛中。在其他材料出现之前,PMMA 主导了 IOL 市场 40 年。尽管 PMMA 具有出色的光学性能和眼睛的相对耐受性,但它仍然会对 IOL 植入物周围的组织造成损害。最令人担忧的是晶状体僵硬引起的角膜内皮损伤,以及炎症细胞在 IOL 表面的积聚,这可能导致虹膜粘连到 IOL、葡萄膜炎和视力丧失等并发症。这些问题促使人们不断更新 IOL 设计和材料选择。与原来坚硬笨重的 PMMA IOL 相比,现在常见的 IOL 具有柔软和可折叠的特点。
最广泛使用的可折叠 IOL AcrySof 是由苯乙基丙烯酸酯和苯乙基甲基丙烯酸酯的共聚物与交联剂和紫外线吸收发色团制成的。与 PMMA(n=1.49)相比,其改进的光学特性(即更高的折射率(n=1.55))允许更薄的 IOL 配置。共聚物的机械特性导致 IOL 展开缓慢且控制性更好,这有助于显著减少后囊膜混浊 (PCO)。用于可折叠 IOL 制造的其他材料包括硅酮弹性体、亲水性丙烯酸树脂(含水量高于 18%)和胶原共聚物(表 5.1)。虽然亲水性丙烯酸 IOL 由于减少了蛋白质吸附和巨噬细胞粘附而表现出良好的葡萄膜生物相容性,但它们往往具有更高的 PCO 率并导致前囊膜混浊,从而降低了其在市场上的应用。
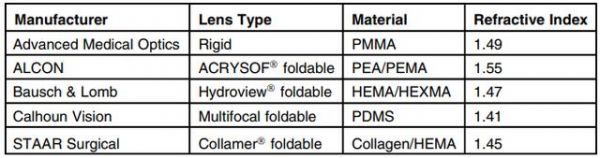
表 5.1 IOL 生物材料示例。
5.2.3 聚合物人工角膜
角膜是位于眼睛前部的透明组织。它是眼部光学系统的主要元素,起着各种作用,从将光线折射到视网膜上形成图像,到充当脆弱的内部眼组织的保护屏障。角膜损伤会导致视力丧失,这是继白内障之后全球第二大失明原因。最广泛接受的角膜失明治疗方法是移植人类供体角膜。然而,供体角膜组织的可用性有限,要求设计和开发人工角膜替代品。人工角膜,也称为角膜假体,有多种形式,从完全合成的到组织工程的。本讨论的重点是基于聚合物的合成角膜假体。有几篇关于人工角膜的优秀综合评论可供进一步阅读。
角膜组织复杂、无血管、高度神经支配且具有免疫特权。它排列在三个主要细胞层中:外层复层上皮、内层单层内皮,夹在基质层之间,基质层决定角膜的光学特性。虽然复制天然角膜的复杂结构具有挑战性,但可以构建一个可以模拟天然角膜物理特征并恢复一定功能水平视力的人工角膜。理想的人工角膜应满足以下具体要求:(1)透明,前表面光滑,曲率适当;(2)折射率合适;(3)柔韧,抗拉强度足以进行手术操作;(4)能与宿主角膜愈合;(5)能促进和维持人工角膜前表面上皮的生长;(6)能避免角膜后成纤维细胞膜的形成;(7)生物相容性。早期的人工角膜由多种不同的疏水性聚合物制成,如聚甲基丙烯酸甲酯、尼龙、聚四氟乙烯(PTFE)、聚氨酯(PU)和聚对苯二甲酸乙二醇酯(Dacron)。设计从一种按钮状的整片材料发展到更广泛使用的“芯裙”结构,其中芯由具有良好光学性能的透明材料制成,裙边由相同或不同的材料制成,以确保与宿主的整合。在这些聚合物中,PMMA 可以说是应用最广泛的,因为它具有出色的光学特性,如上文 IOL 部分所述。尽管 PMMA 在人工角膜中的应用仍在继续,但相关的并发症,如假体后膜形成、青光眼、挤压、眼内炎和排斥反应,导致了软性水凝胶基人工角膜的开发。大多数研究都针对 HEMA 基水凝胶。关于 HEMA 的一个有趣观察是,当单体在 40% 或更少的水存在下聚合时,它会形成均匀透明的水凝胶;当水含量较高时,聚合过程中会发生相分离,所得水凝胶是不均匀且不透明的。利用这些特性,第一个“芯裙”水凝胶基人工角膜是使用 HEMA 创建的,该装置在商业上被称为 AlphaCor 。核心是透明的、含水量较低的 PHEMA,裙部是相分离的大孔不透明 PHEMA。尽管 PHEMA 被认为是亲水性聚合物,但其含水量仍远低于天然角膜中的含水量(78%)。如此高的含水量对于上皮的稳定性和存活至关重要,因为它有助于营养物质的扩散。为了增加人工角膜的含水量,人们探索了各种策略。例子包括 HEMA 与离子丙烯酸酯 MAA 的共聚,以及由聚乙烯醇 (PVA) 均聚物制成的水凝胶,在平衡状态下可含 80% 以上的水。一些研究小组还报告了制造用于人工角膜的仿生水凝胶。由于角膜的细胞外基质主要由 I 型胶原蛋白组成,因此它已用于制备基于 N-异丙基丙烯酰胺 (NIPAAm)、丙烯酸、N-丙烯酰氧基琥珀酰亚胺和胶原蛋白的共聚物水凝胶。工程水凝胶本质上是一个由胶原蛋白组成的网络,胶原蛋白使用琥珀酰亚胺侧链基团与丙烯酸和 NIPAAm 的共聚物交联。这种材料已展示出用于角膜移植的生物力学特性和所需的光学清晰度。体内动物研究表明宿主角膜上皮、基质和神经可以成功再生。目前正在进行临床试验,以评估该材料对人类的治疗用途。
互穿聚合物网络 (IPN) 也已用于人工角膜应用。IPN 代表聚合物网络的混合物,其中一种聚合物在另一种聚合物网络存在下交联以形成两种不同聚合物的网状物。IPN 的主要优势在于它将两种聚合物的有益特性结合到最终材料中。IPN 在人工角膜中的早期应用是在光学核心和周边裙边之间的连接处,其中 IPN 的相互扩散区为 PHEMA 海绵裙边与 PHEMA 核心提供了永久可靠的结合。最近的努力集中在将 IPN 纳入整个人工角膜结构中。一种设计基于聚(二甲基硅氧烷) (PDMS) 和 PNIPAAm 的 IPN,其中 PDMS 的机械强度、透明度和透氧性与 PNIPAAm 的亲水性和营养渗透性相结合,形成功能性人工角膜。另一个例子是中性交联聚乙二醇 (PEG) 和带电、松散交联聚丙烯酸 (PAA) 的 IPN。这种 IPN 具有光学透明度、良好的机械性能和与天然角膜相当的葡萄糖扩散系数。虽然大多数人工角膜在动物模型中表现出令人满意的生物相容性,但确保材料无毒、无免疫原性、无致突变性,并且不会导致角膜混浊至关重要。
5.3 高分子生物材料在骨科中的应用
传统上,骨科生物材料主要是金属材料,这很大程度上是因为其与骨组织的特性非常相似,例如高强度、硬度和断裂韧性。多年来,聚合物也已用于骨科,它们在骨组织工程中越来越受到关注。从历史上看,聚合物在骨科中的应用主要是那些能够很好地固定结构装置并在膝关节和髋关节置换术等循环承重条件下表现良好的聚合物。尽管市场上有数百种骨科应用,但只有几种类型的聚合物占主导地位,包括超高分子量聚乙烯 (UHMWPE) 和 PMMA。
5.3.1 聚乙烯
(东莞市富临塑胶原料有限公司供应:植入级UHMWPE复丝/绳)
UHMWPE 是一种线性聚乙烯,分子量通常在 200 万到 600 万之间。UHMWPE 的断裂韧性、低摩擦系数、高冲击强度和低密度使其成为髋关节、膝关节、踝关节和肩关节等关节置换的关节表面的热门选择。尽管 UHMWPE 具有许多吸引人的体积和表面特性,但这些特性可能会因灭菌过程中使用的电离辐射导致体积中存在长期自由基而受到影响。这些自由基可以与氧相互作用,导致含氧官能团的产生,并导致表面和体积性能的恶化,特别是在磨损过程中颗粒的产生率。磨损碎片的过量产生与植入物附近组织的炎症反应有关。这种不良的组织反应将导致肉芽肿性病变、骨溶解、骨吸收和植入物失败。为了克服氧化,目前使用了许多添加剂,如抗氧化剂a-生育酚和维生素C,来延缓氧化和增强表面性能。由于磨损问题,UHMWPE被认为是任何全关节置换术中的薄弱环节。为了提高耐磨性,已经生产出高度交联的UHMWPE并用于关节置换术。交联是通过用电子束或伽马射线辐照UHMWPE来实现的,然后进行熔化步骤以消除辐照过程中产生的自由基。目前,关于交联和UHMWPE的临床性能存在争议。支持者已提供证据证明高交联 UHMWPE 在减少全关节置换术中的磨损和相关的假体周围骨溶解方面是有效的。反对者指出,通过交联提高耐磨性是以降低静态机械性能为代价的,例如拉伸强度和屈服强度以及疲劳裂纹扩展阻力,这可能会影响植入物的寿命,尤其是在全膝关节置换术中。有关高交联 UHMWPE 的最终长期性能的完整数据将有助于解决科学争论。
5.3.2 聚丙烯酸酯
Charnley 首次证明了 PMMA 作为骨固定剂的应用。PMMA 骨水泥由液态单体 MMA、部分聚合的 PMMA 粉末、引发剂(常用的过氧化二苯甲酰)、活化剂(N,N-二甲基对甲苯胺)、放射性不透光剂(X 射线下可见)如硫酸钡或氧化锆以及影响水泥混合和处理的共聚物组成。在某些情况下,配方中含有抗生素(例如庆大霉素),以尽量减少植入期间的感染。聚合由活化剂和引发剂之间的相互作用引发,产生与单体反应的自由基。固化的聚合物能够确保假体在骨骼中牢固固定。尽管丙烯酸骨水泥在骨科中得到广泛应用,但其使用存在一些缺点。残留的单体可能泄漏到体内并导致脂肪栓塞。聚合过程的放热性质可能是周围组织坏死的潜在原因。最关键的缺点是无菌性松动,即水泥内的植入物松动。无菌性松动的原因可能是机械和/或生物化学的。从机械角度来看,植入物的循环负荷可能导致水泥疲劳断裂。从生物化学角度来看,聚乙烯成分的磨损碎片可能迁移到骨水泥界面并引发炎症反应,导致骨溶解并削弱植入物界面。为了改善 PMMA 固定,一种可能的策略是通过增加水泥的机械强度来避免水泥断裂。研究人员使用浸渍有生物活性玻璃陶瓷的双酚 A-二甲基丙烯酸缩水甘油酯 (Bis-GMA) 基树脂,开发出具有比传统 PMMA 更高的粘结强度和压缩模量的骨水泥。另一种方法是利用复合材料,用羟基磷灰石 (HA) 和生物活性玻璃增强 PMMA,将强度和弹性与生物活性相结合。
另一种丙烯酸酯骨水泥以聚甲基丙烯酸乙酯 (PEMA) 和正丁基甲基丙烯酸酯 (n-BMA) 单体为基础。与 PMMA 水泥相比,PEMA-n-BMA 水泥在聚合过程中产生的热量较少,并且该聚合物具有相对较低的模量和较高的延展性,从而减少了断裂问题。PEMA-n-BMA 骨水泥的生物相容性非常好。但人们发现这些骨水泥容易蠕变。为了提高抗蠕变性,加入了生物活性 HA 颗粒。尽管 HA 改善了水泥的生物活性和蠕变行为,但水泥在较低的循环次数下就会失效。
5.3.3 天然聚合物
天然聚合物在骨置换和硬组织增强领域的应用越来越多。理想情况下,用于此目的的材料应具有生物相容性;能够模拟骨骼和硬组织的三维特征、物理和机械性质;能够支持适当的细胞功能;并能被再生的新组织逐渐取代。人们使用了各种天然聚合物,包括细胞外基质蛋白,如胶原蛋白;多糖,如壳聚糖、藻酸盐、淀粉和纤维素;以及糖胺聚糖,如透明质酸。一些天然聚合物可以为仿生磷灰石的形成提供模板,这对于诱导快速骨定植非常有利。研究人员最近的研究揭示了具有骨替代潜力的细菌纤维素/羟基磷灰石复合材料的形成和特性。可降解和不可降解的细菌纤维素都被用来形成复合材料。复合材料中的羟基磷灰石具有有序的纳米针状颗粒,其非化学计量组成与人体骨骼中观察到的相似。结合的生物活性和生物相容性证实了这种复合材料在骨科应用方面的潜力。
5.4 心血管疾病中的聚合物生物材料
生物材料在心血管疾病的治疗中发挥着至关重要的作用;应用示例包括心脏瓣膜假体、血管移植物、支架、留置导管、心室辅助装置、全植入式人工心脏、起搏器、自动内部心律转复除颤器、主动脉内球囊泵等。心血管应用(尤其是血液接触设备)对材料的一个关键要求是血液相容性,即不形成血栓。其他要求包括特定于应用的机械和表面特性。调查心血管应用中使用的聚合物领域发现,聚氨酯、聚对苯二甲酸乙二醇酯 (PET) 和膨体聚四氟乙烯 (ePTFE) 是最常用的。本节将回顾这三种聚合物中的每一种,然后简要介绍用于心血管领域的其他新兴聚合物。
5.4.1 聚氨酯
(东莞市富临塑胶原料有限公司供应:植入级聚氨酯材料)
聚氨酯是血液接触医疗器械最常用的生物医学聚合物之一。它们可用于血液透析血管、导管、支架、起搏器导线绝缘体、心脏瓣膜、血管移植物和补片、左心室辅助装置 (LVAD) 等。PU 的特点是具有广泛机械和血液接触性能的分段嵌段共聚物,只需改变软段和偶联剂的类型和/或分子量即可。生物医学 PU 中的氨基甲酸酯键 —NH—C(=O)—O— 可通过两步工艺形成。第一步是涉及大分子二醇软段(例如聚醚、聚酯、聚碳酸酯和聚硅氧烷)与二异氰酸酯封端以形成预聚物的反应。第二步是预聚物与低分子量链延长剂(通常是二醇或二胺)的偶联。硬段通常是指链延长剂和二异氰酸酯组分的组合。
由于软段和硬段之间的化学不相容性,PU 的形态由硬段聚集形成的区域组成,这些区域分散在由软段形成的基质中。这种独特的形态决定了生物医学 PU 卓越的机械性能和生物相容性。例如,根据硬段和软段的相对分子量和数量,获得的 PU 可以是弹性的或刚性的。PU 的机械性能也可以通过改变链扩展剂的化学性质来定制。通常,用脂肪族链扩展剂制备的 PU 比用芳香族链扩展剂制备的 PU 更软。PU 的生物相容性也与链扩展剂和软段的化学性质密切相关。研究人员的早期研究表明,聚丙烯软段分子量的变化会影响蛋白质的吸附。在可生物降解聚氨酯的合成中,赖氨酸二异氰酸酯和六亚甲基二异氰酸酯比芳香族二异氰酸酯更受青睐,部分原因是芳香族二异氰酸酯具有致癌性。最近的研究报告称,使用天然聚合物(如几丁质和壳聚糖)作为链延长剂来改善聚氨酯的生物相容性。
生物稳定性一直是聚氨酯研究的主要重点。根据预期的医疗应用,聚氨酯所需的生物稳定性各不相同。例如,用作起搏器导线覆盖层的聚氨酯应具有优异的长期稳定性,而用作构建工程组织结构以替换患病心血管组织的支架的聚氨酯应具有生物降解性。维持聚氨酯体内长期生物稳定性的挑战在于聚氨酯的生物降解是一个复杂且多因素介导的过程。导致聚氨酯生物降解的机制包括 (1) 水解、(2) 氧化降解、金属或细胞催化、(3) 酶降解、(4) 表面开裂、(5) 环境应力开裂和 (6) 钙化。众所周知,含有聚酯软段的聚氨酯水解稳定性较差,而含有聚醚软段的聚氨酯容易发生氧化降解。在对导致聚氨酯生物降解的分子途径进行广泛研究并收集到宝贵信息的指导下,多年来人们设计出了更具生物抗性的聚氨酯。这些策略包括使用聚碳酸酯大分子二醇、醚基之间具有较大烃段的聚醚大分子二醇和硅氧烷基大分子二醇。另一方面,生物可吸收聚氨酯作为弹性组织工程支架正受到越来越多的关注。对于该类聚氨酯,最常用的是聚乳酸或聚乙醇酸交酯、聚己内酯和聚环氧乙烷等软段。此外,硬段还设计了降解功能。酶敏感键已整合到硬段中,导致特异性酶降解,而非特异性水解降解。硬段中另一个有趣的添加物是抗菌药物等生物活性分子。因此,聚合物降解将导致药物自由释放,使得此类聚氨酯对于生物医学应用非常有吸引力。
5.4.2 聚对苯二甲酸乙二醇酯
(东莞市富临塑胶原料有限公司供应:医用PET热缩管)
PET 是工程聚酯家族的一员。它是一种半结晶聚合物,在工业上可用作合成纤维、饮料和食品容器。在医疗领域,PET 广泛用作纤维或织物形式的人工血管移植物、缝合线和伤口敷料(商业上称为涤纶)。尽管存在水解可裂解的酯键,但 PET 在体内相对稳定,这主要是由于其高结晶度和疏水性。它是临床上使用的两种人工血管移植物标准生物材料之一。它广泛用于较大的血管(直径 >6 毫米)应用。用于血管应用的 PET 可以编织或针织制成,这将决定移植物的孔隙率和机械性能。通常,编织饰面的孔隙率低于针织移植物,因此减少了透壁血液外渗的机会。涤纶血管移植物坚固而坚硬,顺应性远低于天然动脉。这种顺应性不匹配被认为是导致移植物在很长一段时间内(>6个月)失去通畅性的原因。与PET移植物相关的另一个主要并发症是其血栓形成性。当移植物与血液接触时,血浆蛋白会吸附到管腔和囊膜表面,导致血栓形成和炎症反应。人们已经探索了各种使移植物表面抗血栓的策略,包括用白蛋白钝化表面、用氟聚合物涂层、用亲水聚合物涂层、抗凝剂肝素白蛋白的共价或离子结合、抗血栓剂血栓调节蛋白的共价连接等。尽管在急性血栓形成方面已报告了一些改进,但要实现PET基血管移植物令人满意的长期功能还有很长的路要走。
5.4.3 膨体聚四氟乙烯
(东莞市富临塑胶原料有限公司供应:植入级膨体聚四氟乙烯ePTFE管、膜)
膨体聚四氟乙烯,商业上也称为 Gore-Tex,是临床使用的两种标准人工血管移植物生物材料之一。除了血管用途外,膨体聚四氟乙烯还用作软组织再生的补片,例如疝修补和手术缝合线。它通过一系列挤压、拉伸和加热工艺生产,形成一种微孔材料,孔径范围为 30 到 100 毫米左右。与 PET 类似,ePTFE 具有高度结晶性、疏水性和高度稳定性。它具有极低的摩擦系数,易于操作。它具有极低的摩擦系数,易于处理。其拉伸强度和拉伸模量低于 PET。尽管膨体聚四氟乙烯移植物顺应性相对较低,但与天然动脉相比仍然太高。通常,与 PET 相比,膨体聚四氟乙烯是绕过较小血管的最佳选择。然而,它仍然面临通畅性问题。使用 ePTFE 进行股腘动脉重建的 5 年通畅率为 40-50%,而使用自体静脉移植可实现 70-80%。与 PET 类似,通畅率低的原因是材料的血栓形成性。据报道,移植物未能在移植物管腔侧形成内皮细胞的完全覆盖。为了解决这个问题,一种方法是增加孔隙率以促进组织内生。但它需要谨慎的平衡以防止如前所述血液元素的泄漏。其他方法侧重于降低表面血栓形成性,包括碳涂层以增加表面电负性、附着抗凝剂或抗血栓剂,以及用纤维蛋白胶浸渍以提供可促进内皮化的生长因子。这些治疗的实际益处尚未通过长期体内研究确定。
小直径血管修复带来的挑战促使人们研究替代生物材料,以匹配或超越自体移植。一项值得注意的努力是使用合成的可生物降解支架在体外构建组织工程移植物。从概念上讲,这种移植物将具有与天然组织非常相似的机械性能,而不用担心合成材料通常引起的慢性炎症反应。迄今为止,各种可生物降解的聚合物已被用于构建此类结构,包括聚(a-羟基酯);聚(乙醇酸)(PGA);聚(乳酸)(PLA);及其共聚物聚(乳酸-共-乙醇酸)(PLGA)、聚己内酯、聚酐、聚羟基烷酸酯和多肽。有几篇优秀的评论讨论了材料作为血管组织工程支架的现状。
聚合物有望产生重大影响的另一种心血管应用是可生物降解支架。目前的支架主要由金属材料制成,例如不锈钢、钴铬合金或镍钛合金。然而,与金属支架相关的长期并发症促使人们研究完全可降解的替代品。聚合物支架必须满足几个关键要求,其中最重要的两个是机械性能和降解特性。在降解方面,降解产物应具有生物相容性,降解过程在长达 6 个月的时间内不应损害装置的结构完整性。至于机械性能,聚合物应能承受部署和血管收缩。这两个要求都具有挑战性,但只要充分了解底层生物学和聚合物结构-性能关系的多功能性,不久的将来就有可能出现更新的材料。例如,研究人员正在将降解和形状记忆能力赋予能够随时间自我膨胀和降解的聚合物。
5.5 用于伤口闭合的聚合物生物材料
手术伤口可以通过各种方式闭合,包括缝合线、粘合剂、胶带、钉书钉和激光组织焊接。在这些方法中,缝合线是最常用的。缝合线是无菌细丝,用于接近和维持组织,直到愈合为伤口提供适当的强度以承受机械应力。缝合线可根据材料来源分为天然或合成;材料性能分为可吸收或不可吸收;物理结构分为单丝、多丝、编织或扭曲。一般而言,用于缝合线的聚合物除了具有纤维形成流变特性外,还应引起最小的不良生物反应。缝合线必须具有最小的组织阻力、良好的强度保持性和结头安全性。为了提高润滑性并减少组织阻力,通常在缝合线上涂上四氟乙烯和硅酮等涂层。以下各节将讨论目前市面上常见的一些不可吸收和可吸收聚合物缝合线。
一般来说,不可吸收缝合线可以保持其拉伸强度超过 2 个月。用于制造不可降解缝合线的合成聚合物包括聚丙烯 (PP)、聚酰胺、聚酯(如 PET 和聚对苯二甲酸丁二醇酯 (PBT))以及基于聚(四亚甲基二醇)、1,4-丁二醇和二甲基对苯二甲酸的聚醚酯。表 5.2 总结了常见不可吸收缝合线的基础聚合物和细丝配置。
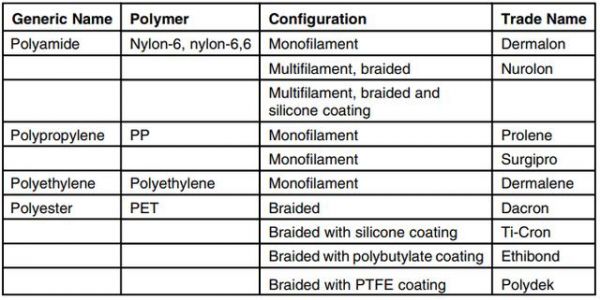
表 5.2 市售不可吸收缝合线材料清单。
PP 单丝缝合线由等规聚丙烯制成。在制备过程中,PP 单丝要经过一系列纺丝后操作,包括退火,旨在提高结晶度。尽管 PP 缝合线具有很强的抗水解降解性,但它可能会发生热氧化降解。由于 PP 缝合线易受电离辐射(例如通常用于辐射灭菌的钴-60 源的 g 辐射)的影响,因此通常使用环氧乙烷或高压灭菌器对其进行灭菌。就性能而言,PP 缝合线引起的组织反应最低。
聚酰胺缝合线通常由尼龙-6 和尼龙-6,6 制成。尼龙-6 由己内酰胺开环聚合而成,而尼龙-6,6 由己二酸和六亚甲基二胺缩聚而成。这些聚酰胺缝合线被加工成单丝、编织多丝和芯鞘结构。编织多丝尼龙缝合线通常经过涂层(例如,硅胶涂层)以减少组织阻力。观察到的强度保持率随时间下降与尼龙结构中酰胺键易受水解降解的影响有关。尼龙缝合线的抗拉强度每年下降约 15-25%。组织对尼龙缝合线的反应似乎与结构无关,编织线和单丝线的反应性都较低。
由于需要缝合非常精细和复杂的组织,因此人们开发和使用了基于氟聚合物的缝合线,例如 PTFE 和聚偏氟乙烯 (PVDF) 以及 PVDF 和六氟丙烯 (HFP) 的共聚物。PTFE 是一种稳定的 (Tm =327 ℃) 半结晶线性聚合物。ePTFE 缝合线是通过湿纺 PTFE 粉末和纤维素黄原酸酯的水混合物制备的高度结晶微孔纤维。ePTFE 纤维的形态由通过控制拉伸强度的细结晶纤维连接的结节组成。机械性能、生物反应和操作可与 PTFE 纤维的孔隙率直接相关。由于微孔结构,ePTFE 缝合线的弯曲刚度较低,但多孔结构也会导致强度降低。PVDF 也具有高度结晶性 (Tm =175 ℃)。由 PVDF 制备的缝合线表现出良好的抗蠕变性和拉伸强度保持性。形态学研究表明,PVDF 缝合线具有较高的表面稳定性,即没有明显的体积或表面断裂迹象。PVDF 缝合线易受热氧化降解影响,但可以用 g 辐射轻松灭菌。PVDF 引发与 PP 缝合线类似的中等组织和细胞反应行为。PVDF 和 HFP 共聚物制成的缝合线最初设计用于将 PVDF 和 PP 的有益处理特性和生物反应结合到一种材料中。此外,PVDF/HFP 缝合线还设计用于模拟聚酯缝合线的耐用性。PVDF/HFP 缝合线的拉伸强度、尺寸、生物反应和处理可以通过操纵共聚物成分来定制。PVDF/HFP 缝合线的主要使用目标领域是心血管、神经和眼科手术期间的伤口闭合。这些 PVDF/HFP 缝合线通常用作无涂层单丝。
最常用的聚酯基不可吸收缝合线包括 PET 和 PBT。此外,还有由聚(四亚甲基醚对苯二甲酸酯)和聚(四亚甲基对苯二甲酸酯)的共聚物(称为聚醚酯)制成的聚酯基缝合线。PET 由乙二醇和对苯二甲酸缩聚而成。PET 是一种熔点约为 265℃ 的聚合物。PET 的热稳定性使其能够进行熔融纺丝,形成具有可变轮廓的单丝纤维。在加工过程中,纤维经过热拉伸,增强了分子取向、结晶度和拉伸强度。PET 缝合线在市场上有涂层或无涂层单丝或编织多丝配置。PET 缝合线的表面处理包括 PTFE 和硅树脂涂层。PET 缝合线在生物环境中非常稳定,没有水解降解的迹象。PET 缝合线的强度保持时间较长。组织对 PET 缝合线的反应取决于结构,编织多丝和单丝分别具有中等和低组织反应性。与 PET 相比,PBT 缝合线通常不易碎且不易僵硬,这是因为聚合物结构中的脂肪族链段较长。聚丁酯缝合线由 PBT 和聚(四亚甲基醚)乙二醇对苯二甲酸酯 (PTMG) 的嵌段共聚物制成。在共聚物中,PBT 是硬链段,PTMG 是柔性链段。硬 PBT 和软 PTMG 嵌段之间的化学不相容性使这些共聚物具有弹性。这种独特的机械行为使聚丁酯缝合线成为易形成水肿的伤口的理想选择。
合成可吸收缝合线由能够在生物环境中降解而不会产生不良影响的聚合物制成。可吸收缝合线的一个总体优势是无需就诊即可拆除。这些缝合线要么是均聚物,要么是基于可降解聚合物单元(如聚乙醇酸、聚乳酸或聚对二氧杂环己酮)的共聚物。
聚乙醇酸 (PGA) 可以通过缩合或开环聚合合成。基于 PGA 的缝合线是第一种可吸收缝合线。PGA 缝合线在市场上有涂层或无涂层的编织结构。乙醇酸已与乳酸、三亚甲基碳酸酯和 3-己内酯共聚。乙醇酸与 L- 或 DL- 乳酸共聚形成无规共聚物。乙醇酸-L-丙交酯缝合线的性能取决于成分。乙醇酸-L-丙交酯缝合伤口的初始拉伸强度和愈合过程中的保持力直接取决于可结晶乙醇酸单体的浓度。

聚乙醇酸 (PGA) 可通过缩合或开环聚合合成。基于 PGA 的缝合线是第一种可吸收缝合线。PGA 缝合线在市场上有涂层或无涂层的编织结构。乙醇酸已与乳酸、三亚甲基碳酸酯和 3-己内酯共聚。乙醇酸与 L- 或 DL- 乳酸共聚形成无规共聚物。乙醇酸-L-丙交酯缝合线的性能取决于成分。乙醇酸-L-丙交酯缝合伤口的初始拉伸强度和愈合过程中的保持力直接取决于可结晶乙醇酸单体的浓度。基于 DL-丙交酯的共聚物不表现出与 L-丙交酯共聚物相同的成分依赖性。乙交酯与三亚甲基碳酸酯共聚形成三嵌段共聚物,其中中间嵌段是乙交酯和三亚甲基碳酸酯的无规共聚物,末端嵌段基于乙交酯。这些缝合线可用作无涂层单丝。乙交酯和 3-己内酯的共聚形成分段共聚物。在这些共聚物中,乙交酯和 3-己内酯分别形成软段和硬段。
聚对二氧杂环己酮 (PDS) 是通过 1,4-二氧杂环己酮-2,5-二酮的开环聚合合成的。单丝缝合线通过熔融纺丝生产。纤维经过拉伸工艺以提高拉伸强度和性能。最近,人们尝试将 PDS 与 PGA 和 PLLA 共聚以生产具有不同特性的缝合线目前伤口缝合线的研究重点是除了闭合伤口之外,还为缝合线增加额外的功能。这些努力包括通过开发抗菌缝合线来控制伤口感染,并使用几丁质等生物活性材料加速伤口愈合过程,或提供可影响伤口愈合反应的治疗方法。
5.6 体外人工器官中的聚合物生物材料
体外人工器官提供传质操作以支持衰竭或受损的器官系统。常见的例子包括肾脏替代品、血液透析、心肺旁路 (CPB)、血液分离疗法、腹膜透析、肺替代和辅助以及血浆分离。体外人工器官中涉及的一个关键组件是用于将不需要的物质从血液或血浆中分离出来的膜。理想情况下,在这些特定应用中用作膜的材料应具有适当的细胞和分子渗透性,以及血液相容性(即血液相容性)。多年来,天然和合成聚合物都被用作膜材料。
最广泛使用的天然膜是纤维素膜。以血液透析为例,早期透析器中纤维素膜的应用使用的是再生纤维素,即在重复的糖单元上未取代且富含羟基的纤维素。研究发现,再生纤维素的血液相容性较差。它会激活补体系统,导致炎症和其他严重的免疫反应。补体激活的原因是膜上羟基浓度高,使其具有亲核性并易受蛋白质沉积的影响,尤其是 C3b。这一观察结果促使后来研究使用取代纤维素作为透析膜,例如醋酸纤维素和三醋酸纤维素,在这两种情况下,一小部分羟基都被醋酸官能团取代。这些改性纤维素材料通过消除补体蛋白相互作用的活性表面位点,极大地限制了补体激活。除了化学阻断补体相互作用外,还探索了使用空间位阻效应的方法。已经使用大化学基团(例如苄基取代基或叔胺基)来取代羟基,以在空间上最小化补体蛋白与膜的相互作用。
目前的透析膜大多由合成聚合物制成,包括聚砜、聚醚砜、聚丙烯腈、PMMA、聚酰胺和聚丙烯中空纤维。与天然纤维素膜相比,合成膜不易被补体激活。补体相容性提高的原因是表面亲核试剂 C3b 沉积水平降低。此外,一些合成膜表面富含负电荷,可以吸收活化的阳离子补体肽(例如 C5a)并最大限度地减少随后的炎症级联。合成膜通常具有比纤维素膜大得多的孔径和更高的水力渗透性。因此,合成膜是高通量应用的选择。较大的孔径还可以去除分子量在 500 至 2000 Da 之间的中分子,这些分子被认为具有生物活性并可能具有潜在的生物学影响。大多数合成膜的疏水性使其具有吸附有害化合物(如白细胞介素-1、肿瘤坏死因子、白细胞介素-6 和 β2-微球蛋白)的能力。PMMA 和聚丙烯腈通常表现出最显着的吸附能力。无论其来源如何,这些膜要么用于最常见的中空纤维设计,要么用作平行板设计的片状薄膜。
5.7 用于神经再生的聚合物生物材料
由于神经系统的生理复杂性,受损神经的修复面临着巨大的挑战。尽管过去几十年取得了进展,但仍然不可能完全修复损伤,从而恢复神经系统失去的功能。神经系统通常分为中枢神经系统 (CNS) 和周围神经系统 (PNS)。人们已经探索了各种用于中枢神经系统和周围神经系统神经修复的策略,包括引导导管、带有细胞移植的支架和治疗剂的递送。本节将主要关注神经引导导管方法中使用的聚合物。
人们普遍认为,轴突(从神经元细胞体延伸并传导电信号的长突起)的物理引导在神经修复中起着关键作用。神经引导导管的设计目的是 (1) 引导轴突从近端神经末端跨过病变部位生长,(2) 为受伤神经末端分泌的生物分子的扩散提供通道,以及 (3) 减少疤痕组织对再生区的侵入。为了实现这些功能,理想的神经引导导管应该是半透性的,导管内部具有定向的地形特征,支持电活动,能够传递生物活性因子,并能够支持细胞粘附和迁移。聚合物的多功能性使其成为神经引导导管工程的首选。早期研究使用了不可降解的合成聚合物,包括硅胶和 ePTFE。尽管硅胶神经导管已成功填补了 10 毫米以内的间隙,但它们无法支持更大缺损处的再生。因此,人们已将精力转向开发可生物降解的导管。使用可降解材料的优势在于可以最大限度地减少纤维化反应和神经压迫等长期并发症。材料的降解特性应满足以下要求:(1) 降解曲线应与轴突生长曲线相匹配,以便导管在再生过程中保持足够的机械支撑;(2) 降解产物应引起最小甚至零的组织反应。已经使用了一系列可降解聚合物,包括可生物降解的聚酯,如 PGA、PLA、PLGA 和聚己内酯;聚磷腈;聚氨酯;和聚(3-羟基丁酸酯)。
自从有研究表明电荷会影响体外神经突延伸并改善体内神经再生以来,能够提供电刺激的聚合物已被纳入引导导管的开发中。这些聚合物包括压电聚合物(如 PVDF 及其共聚物)和导电聚合物(如聚吡咯及其生物改性衍生物)。其他电活性聚合物(如聚苯胺)也可能为神经生长提供支持,因为研究表明其对心脏成肌细胞有令人鼓舞的结果。
神经导管可以是空心的,也可以充满基质以支持轴突伸长。一种流行的填充剂选择是天然聚合物凝胶。理想情况下,凝胶应柔软,机械性能与神经组织相匹配,多孔以允许轴突长入,可生物降解和生物相容。已经研究了许多天然聚合物,包括琼脂糖、壳聚糖、甲基纤维素、透明质酸、藻酸盐、纤维蛋白凝胶、胶原蛋白、角蛋白和自组装肽支架。琼脂糖是一种热可逆多糖水凝胶。可以通过改变附着在糖残基上的功能团来改变其胶凝温度。它还可以用各种生物基序进行功能化,例如层粘连蛋白衍生的肽序列 RGD、YIGSR 和 IKVAV,以增强神经突延伸。纤维蛋白是一种天然的伤口愈合基质,可在再生的早期阶段找到。它由血液凝固级联形成,以恢复止血并启动组织修复。使用纤维蛋白凝胶作为填充物可以紧密模拟在连接短神经间隙的导管中形成的天然基质,其中纤维蛋白线通常由神经末端受损血管渗出的血清形成。肽序列也已交联到填充纤维蛋白基质中以进一步诱导神经突延伸。除了凝胶填充剂外,导管中还使用了合成或天然的纵向丝,以使生长的轴突沿再生方向对齐。用于制备细丝的材料包括聚酰胺、羊肠线、聚二氧化酮、聚乳酸、聚(丙烯腈-甲基丙烯酸酯共聚物)、胶原蛋白、PLA、PGA 等。
最近,神经引导导管的材料研究已提升到一个新的水平,旧的被动材料范式已转向新的生物活性材料设计。化学信使(例如神经递质)已聚合到聚合物主链中,从而为所得生物材料赋予神经活性。这种新型聚合物的第一个例子是多巴胺与二缩水甘油酯聚合形成可生物降解的材料,该材料在体外表现出旺盛的神经突生长,在体内表现出良好的组织相容性。另一种新型生物活性聚合物的例子是聚唾液酸及其水凝胶。聚唾液酸是神经细胞粘附分子的动态调节翻译后修饰。它已被证明可以显着改善体外细胞粘附和活力。随着对神经再生生物学原理的了解不断加深,预计未来将开发出更多生物活性材料,以实现神经损伤的及时功能恢复。
5.8 结论和未来展望
聚合物对生物医学研究和医疗实践产生了重大影响,并将继续成为二十一世纪生物材料的主要劳动力。这里介绍的聚合物生物材料及其应用只是冰山一角。随着对现有生物材料的生物反应的了解不断加深,以及对人体器官组成、功能、生物力学和疾病病因的更好掌握,化学家和聚合物科学家应继续与生物学家、医生和工程师合作,开发用于生物医学应用的定制聚合物。与旧的惰性合成聚合物相比,生物活性、仿生和智能聚合物将成为中心舞台。此外,由于生物系统与聚合物的相互作用发生在界面上,表面相关研究将继续蓬勃发展,尤其是表面表征和表面改性。我们可以期待,借助新一代生物材料,我们可以更好地管理疾病,并将生物材料无缝整合到人体中。
富临塑胶于2016年成立,公司位于广东省东莞市樟木头镇,专注于医疗行业,秉持以客户为中心的理念,供应客户所需材料与协助提供解决方案,是医疗产业链整合供应商。
相关知识
医疗保险对健康状况的影响研究综述
科学家推进“健康”分娩研究和实践—论文—科学网
科学家推进“健康”分娩研究和实践—新闻—科学网
人工智能(AI)对智慧医疗的影响及其未来研发方向
聚光+生物医药丨林强:从“临床医生”到“新药研发探路者”,为患者生命健康护航
科学网—健康医疗大数据研究迫在眉睫
“为残疾人提供更优质温暖的诊疗服务”——中国康复研究中心康复医学科诊疗实践观察
生物化学双语教学实践
孕期全氟烷基化合物暴露对胎儿生长发育影响的研究进展
多种化学污染物对儿童健康影响的研究
网址: 聚合物对生物医学研究和医疗实践影响 https://m.trfsz.com/newsview336681.html
