产左旋肉碱的重组菌及其构建方法与应用与流程
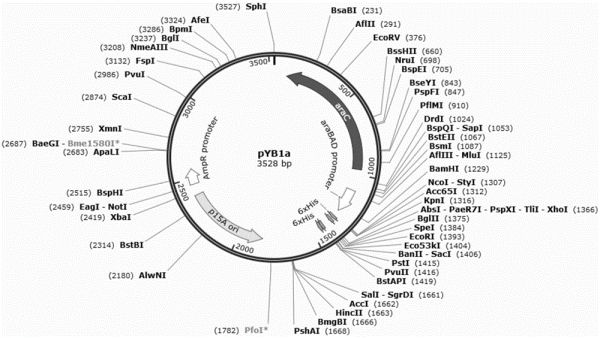
本发明涉及产左旋肉碱的重组菌及其构建方法与应用,属于生物
技术领域:
。
背景技术:
:左旋肉碱(l-carnitine),又称l-肉碱或音译卡尼丁,是一种促使脂肪转化为能量的类氨基酸,红色肉类是左旋肉碱的主要来源,对人体无毒副作用,极易吸潮。左旋肉碱的主要生理功能是促进脂肪转化成能量,服用左旋肉碱能够在减少身体脂肪、降低体重的同时,不减少水分和肌肉,在2003年被国际肥胖健康组织认定为最安全无副作用的减肥营养补充品。左旋肉碱的营养价值和医用价值以及良好的市场前景,吸引了世界各国科学家对其进行广泛和深入的研究。目前世界上只有瑞士、意大利、日本等为左旋肉碱的主要生产国。我国大部分左旋肉碱需求还是依靠进口,价格昂贵,亟待研发新进展,以填补国内空白。因此,不断开发低成本、高合成率、易于实现工业化生产的左旋肉碱合成新路线,显得尤为重要。左旋肉碱的制备方法很多,其制备可通过从动物肉浸膏中提取、生物合成和化学合成等方法。提取法产量低,纯化步骤多,成本高且难以形成规模化生产。化学合成法主要采取2种途径:(1)先制取出外消旋肉碱,利用拆分剂析出左旋体;(2)以不同的化学物质为原料进行合成。生物合成法制备左旋肉碱主要有两种方法,一是微生物发酵法,二是利用酶法转化。全细胞生物转化是一种高效、绿色的生物转化过程,已成功运用在多种产品的工业生产上,全细胞催化通过细胞壁的保护使酶更加稳定,弥补了体外酶法转化酶活不稳定的缺点。因此利用全细胞催化方法生产左旋肉碱值得深入研究。技术实现要素:本发明所要解决的技术问题是提供左旋肉碱产量高的重组菌及其构建方法与应用。为了解决上述问题,本发明首先提供了一种产左旋肉碱的重组菌的构建方法。本发明提供的产左旋肉碱的重组菌的构建方法为如下1)或2):1)包括如下步骤:将γ-丁基甜菜碱羟化酶基因和肉碱转运蛋白基因导入受体菌得到产左旋肉碱的重组菌;2)包括如下步骤:将γ-丁基甜菜碱羟化酶基因导入受体菌得到产左旋肉碱的重组菌;所述受体菌为突变型大肠杆菌或野生型大肠杆菌;所述突变型大肠杆菌为下述a1至a7中的任一种:a1、所述突变型大肠杆菌为对所述野生型大肠杆菌进行下述a1、a3和a5的改造后得到的所述野生型大肠杆菌的突变体,将其记作大肠杆菌突变体s7;a2、所述突变型大肠杆菌为对所述野生型大肠杆菌进行下述a1和a5的改造后得到的所述野生型大肠杆菌的突变体,将其记作大肠杆菌突变体s6;a3、所述突变型大肠杆菌为对所述野生型大肠杆菌进行下述a1、a2和a3的改造后得到的所述野生型大肠杆菌的突变体,将其记作大肠杆菌突变体s5;a4、所述突变型大肠杆菌为对所述野生型大肠杆菌进行下述a1和a4的改造后得到的所述野生型大肠杆菌的突变体,将其记作大肠杆菌突变体s4;a5、所述突变型大肠杆菌为对所述野生型大肠杆菌进行下述a1和a3的改造后得到的所述野生型大肠杆菌的突变体,将其记作大肠杆菌突变体s3;a6、所述突变型大肠杆菌为对所述野生型大肠杆菌进行下述a1和a2的改造后得到的所述野生型大肠杆菌的突变体,将其记作大肠杆菌突变体s2;a7、所述突变型大肠杆菌为对所述野生型大肠杆菌进行下述a1的改造后得到的所述野生型大肠杆菌的突变体,将其记作大肠杆菌突变体s1;a1、将所述野生型大肠杆菌基因组中的α-酮戊二酸脱氢酶基因(suca)敲除;a2、将所述野生型大肠杆菌基因组中的异柠檬酸裂合酶基因(acea)敲除;a3、用乙酰辅酶a合成酶基因(acs)替换所述野生型大肠杆菌基因组中的丙酮酸氧化酶基因(poxb);a4、将所述野生型大肠杆菌基因组中的巴豆甜菜碱还原酶基因(caia)、甜菜碱/肉碱辅酶a转移酶基因(caib)、辅酶a连接酶基因(caic)、巴豆甜菜碱coa水合酶基因(caid)、肉碱消旋酶及肉碱脱水酶活性诱导基因(caie)构成的caiabcde基因簇敲除;a5、将所述野生型大肠杆菌基因组中的肉碱转运蛋白基因(cait)、巴豆甜菜碱还原酶基因(caia)、甜菜碱/肉碱辅酶a转移酶基因(caib)、辅酶a连接酶基因(caic)、巴豆甜菜碱coa水合酶基因(caid)、肉碱消旋酶及肉碱脱水酶活性诱导基因(caie)构成的caitabcde基因簇敲除,且将所述caitabcde基因簇上游的操纵子fixabcx基因簇敲除。上述方法中的敲除和替换均可以通过本领域技术人员利用本领域熟知的手段实现,也可以是通过花费创造性劳动实现。在本发明的具体实施例中,所述敲除和所述替换均通过同源重组实现。进一步的,被导入所述受体菌的所述γ-丁基甜菜碱羟化酶基因编码的蛋白质为b1)或b2)所示的蛋白质:b1)由seqidno.1所示的氨基酸序列组成的蛋白质;b2)由seqidno.1所示的氨基酸序列中经过取代和/或缺失/或添加一个或几个氨基酸残基得到的具有γ基丁基甜菜碱羟化酶活性的由b1)衍生的蛋白质;被导入所述受体菌的所述肉碱转运蛋白基因编码的蛋白质为b3)或b4)所示的蛋白质:b3)由seqidno.3所示的氨基酸序列组成的蛋白质;b4)由seqidno.3所示的氨基酸序列中经过取代和/或缺失/或添加一个或几个氨基酸残基得到的具有肉碱转运蛋白活性的由b3)衍生的蛋白质;所述α-酮戊二酸脱氢酶基因编码的蛋白质为c1)或c2)所示的蛋白质:c1)由genbank号为aac73820.1所示的氨基酸序列组成的蛋白质;c2)由genbank号为aac73820.1所示的氨基酸序列中经过取代和/或缺失/或添加一个或几个氨基酸残基得到的具有α-酮戊二酸脱氢酶活性的由c1)衍生的蛋白质;所述异柠檬酸裂合酶基因编码的蛋白质为d1)或d2)所示的蛋白质:d1)由genbank号为aac76985.1所示的氨基酸序列组成的蛋白质;d2)由genbank号为aac76985.1所示的氨基酸序列中经过取代和/或缺失/或添加一个或几个氨基酸残基得到的具有异柠檬酸裂合酶活性的由d1)衍生的蛋白质;所述乙酰辅酶a合成酶基因编码的蛋白质为e1)或e2)所示的蛋白质:e1)由genbank号为aac77039.1所示的氨基酸序列组成的蛋白质;e2)由genbank号为aac77039.1所示的氨基酸序列中经过取代和/或缺失/或添加一个或几个氨基酸残基得到的具有乙酰辅酶a合成酶活性的由e1)衍生的蛋白质;所述丙酮酸氧化酶基因编码的蛋白质为g1)或g2)所示的蛋白质:g1)由genbank号为aac73958.1所示的氨基酸序列组成的蛋白质;g2)由genbank号为aac73958.1所示的氨基酸序列中经过取代和/或缺失/或添加一个或几个氨基酸残基得到的具有丙酮酸氧化酶活性的由g1)衍生的蛋白质;所述巴豆甜菜碱还原酶基因编码的蛋白质为h1)或h2)所示的蛋白质:h1)由genbank号为aac73150.1所示的氨基酸序列组成的蛋白质;h2)由genbank号为aac73150.1所示的氨基酸序列中经过取代和/或缺失/或添加一个或几个氨基酸残基得到的具有巴豆甜菜碱还原酶活性的由h1)衍生的蛋白质;所述甜菜碱/肉碱辅酶a转移酶基因编码的蛋白质为i1)或i2)所示的蛋白质:i1)由genbank号为aac73149.1所示的氨基酸序列组成的蛋白质;i2)由genbank号为aac73149.1所示的氨基酸序列中经过取代和/或缺失/或添加一个或几个氨基酸残基得到的具有甜菜碱/肉碱辅酶a转移酶活性的由i1)衍生的蛋白质;所述辅酶a连接酶基因编码的蛋白质为j1)或j2)所示的蛋白质:j1)由genbank号为aac73148.2所示的氨基酸序列组成的蛋白质;j2)由genbank号为aac73148.2所示的氨基酸序列中经过取代和/或缺失/或添加一个或几个氨基酸残基得到的具有辅酶a连接酶活性的由j1)衍生的蛋白质;所述巴豆甜菜碱coa水合酶基因编码的蛋白质为k1)或k2)所示的蛋白质:k1)由genbank号为aac73147.2所示的氨基酸序列组成的蛋白质;k2)由genbank号为aac73147.2所示的氨基酸序列中经过取代和/或缺失/或添加一个或几个氨基酸残基得到的具有巴豆甜菜碱coa水合酶活性的由k1)衍生的蛋白质;所述肉碱消旋酶及肉碱脱水酶活性诱导基因编码的蛋白质为l1)或l2)所示的蛋白质:l1)由genbank号为aac73146.2所示的氨基酸序列组成的蛋白质;l2)由genbank号为aac73146.2所示的氨基酸序列中经过取代和/或缺失/或添加一个或几个氨基酸残基得到的具有肉碱消旋酶及肉碱脱水酶活性诱导活性的由l1)衍生的蛋白质;所述fixabcx基因簇中的fixa基因编码的蛋白质为m1)或m2)所示的蛋白质:m1)由genbank号为aac73146.2所示的氨基酸序列组成的蛋白质;m2)由genbank号为aac73146.2所示的氨基酸序列中经过取代和/或缺失/或添加一个或几个氨基酸残基得到的具有fixa蛋白活性的由m1)衍生的蛋白质;所述fixabcx基因簇中的fixb基因编码的蛋白质为n1)或n2)所示的蛋白质:n1)由genbank号为aac73153.1所示的氨基酸序列组成的蛋白质;n2)由genbank号为aac73153.1所示的氨基酸序列中经过取代和/或缺失/或添加一个或几个氨基酸残基得到的具有fixb蛋白活性的由n1)衍生的蛋白质;所述fixabcx基因簇中的fixc基因编码的蛋白质为p1)或p2)所示的蛋白质:p1)由genbank号为aac73154.1所示的氨基酸序列组成的蛋白质;p2)由genbank号为aac73154.1所示的氨基酸序列中经过取代和/或缺失/或添加一个或几个氨基酸残基得到的具有fixc蛋白活性的由p1)衍生的蛋白质;所述fixabcx基因簇中的fixx基因编码的蛋白质为q1)或q2)所示的蛋白质:q1)由genbank号为acc73155.1所示的氨基酸序列组成的蛋白质;q2)由genbank号为acc73155.1所示的氨基酸序列中经过取代和/或缺失/或添加一个或几个氨基酸残基得到的具有fixx蛋白活性的由q1)衍生的蛋白质。更进一步的,被导入所述受体菌的所述γ-丁基甜菜碱羟化酶基因为b11)-b13)中的任一种dna分子:b11)seqidno2的cnda分子或基因组dna;b12)在严格条件下与b11)限定的dna分子杂交且编码所述γ-丁基甜菜碱羟化酶的cdna分子或基因组dna;b13)与b11)或b12)限定的dna分子具有90%以上的同一性且编码所述γ-丁基甜菜碱羟化酶的cdna分子或基因组dna;被导入所述受体菌的所述肉碱转运蛋白基因为b31)-b33)中的任一种dna分子:b31)seqidno.4的cnda分子或基因组dna;b32)在严格条件下与b31)限定的dna分子杂交且编码所述肉碱转运蛋白的cdna分子或基因组dna;b33)与b31)或b32)限定的dna分子具有90%以上的同一性且编码所述肉碱转运蛋白的cdna分子或基因组dna;所述α-酮戊二酸脱氢酶基因为c11)-c13)中的任一种dna分子:c11)大肠杆菌k12基因组序列第758706-761507位所示的cnda分子或基因组dna;c12)在严格条件下与c11)限定的dna分子杂交且编码所述α-酮戊二酸脱氢酶的cdna分子或基因组dna;c13)与c11)或c12)限定的dna分子具有90%以上的同一性且编码所述α-酮戊二酸脱氢酶的cdna分子或基因组dna;所述异柠檬酸裂合酶基因为d11)-d13)中的任一种dna分子:d11)大肠杆菌k12基因组序列第4217109-4218413位所示的cnda分子或基因组dna;d12)在严格条件下与d11)限定的dna分子杂交且编码所述异柠檬酸裂合酶的cdna分子或基因组dna;d13)与d11)或d12)限定的dna分子具有90%以上的同一性且编码所述异柠檬酸裂合酶的cdna分子或基因组dna;所述乙酰辅酶a合成酶基因为e11)-e13)中的任一种dna分子:e11)大肠杆菌k12基因组序列第4285413-4287371位所示的cnda分子或基因组dna;e12)在严格条件下与e11)限定的dna分子杂交且编码所述乙酰辅酶a合成酶的cdna分子或基因组dna;e13)与e11)或e12)限定的dna分子具有90%以上的同一性且编码所述乙酰辅酶a合成酶的cdna分子或基因组dna;所述丙酮酸氧化酶基因为g11)-g13)中的任一种dna分子:g11)大肠杆菌k12基因组序列第909331-911049位所示的cnda分子或基因组dna;g12)在严格条件下与g11)限定的dna分子杂交且编码所述丙酮酸氧化酶的cdna分子或基因组dna;g13)与g11)或g12)限定的dna分子具有90%以上的同一性且编码所述丙酮酸氧化酶的cdna分子或基因组dna;所述巴豆甜菜碱还原酶基因为h11)-h13)中的任一种dna分子:h11)大肠杆菌k12基因组序列第39244-40386位所示的cnda分子或基因组dna;h12)在严格条件下与h11)限定的dna分子杂交且编码所述巴豆甜菜碱还原酶的cdna分子或基因组dna;h13)与h11)或h12)限定的dna分子具有90%以上的同一性且编码所述巴豆甜菜碱还原酶的cdna分子或基因组dna;所述甜菜碱/肉碱辅酶a转移酶基因为i11)-i13)中的任一种dna分子:i11)大肠杆菌k12基因组序列第37898-39115位所示的cnda分子或基因组dna;i12)在严格条件下与i11)限定的dna分子杂交且编码所述甜菜碱/肉碱辅酶a转移酶的cdna分子或基因组dna;i13)与i11)或i12)限定的dna分子具有90%以上的同一性且编码所述甜菜碱/肉碱辅酶a转移酶的cdna分子或基因组dna;所述辅酶a连接酶基因为j11)-j13)中的任一种dna分子:j11)大肠杆菌k12基因组序列第36271-37824位所示的cnda分子或基因组dna;j12)在严格条件下与j11)限定的dna分子杂交且编码所述辅酶a连接酶的cdna分子或基因组dna;j13)与j11)或j12)限定的dna分子具有90%以上的同一性且编码所述辅酶a连接酶的cdna分子或基因组dna;所述巴豆甜菜碱coa水合酶基因为k11)-k13)中的任一种dna分子:k11)大肠杆菌k12基因组序列第35377-36162位所示的cnda分子或基因组dna;k12)在严格条件下与k11)限定的dna分子杂交且编码所述巴豆甜菜碱coa水合酶的cdna分子或基因组dna;k13)与k11)或k12)限定的dna分子具有90%以上的同一性且编码所述巴豆甜菜碱coa水合酶的cdna分子或基因组dna;所述肉碱消旋酶及肉碱脱水酶活性诱导基因为l11)-l13)中的任一种dna分子:l11)大肠杆菌k12基因组序列第34781-35371位所示的cnda分子或基因组dna;l12)在严格条件下与l11)限定的dna分子杂交且编码肉碱消旋酶及肉碱脱水酶活性诱导蛋白的cdna分子或基因组dna;l13)与l11)或l12)限定的dna分子具有90%以上的同一性且编码肉碱消旋酶及肉碱脱水酶活性诱导蛋白的cdna分子或基因组dna;所述fixabcx基因簇基因为m11)-m13)中的任一种dna分子:m11)大肠杆菌k12基因组序列第42403-45750位所示的cnda分子或基因组dna;m12)在严格条件下与m11)限定的dna分子杂交且编码fixabcx基因簇的cdna分子或基因组dna;m13)与m11)或m12)限定的dna分子具有90%以上的同一性且编码fixabcx基因簇的cdna分子或基因组dna。上述严格条件是在2×ssc,0.1%sds的溶液中,在68℃下杂交并洗膜2次,每次5min,又于0.5×ssc,0.1%sds的溶液中,在68℃下杂交并洗膜2次,每次15min;或,0.1×sspe(或0.1×ssc)、0.1%sds的溶液中,65℃条件下杂交并洗膜。上述“同一性”指与天然核酸序列的序列相似性。包括与本发明的编码上述蛋白质的核苷酸序列具有90%或更高,或95%或更高,或96%或更高,或97%或更高,或98%或更高,或99%或更高同一性的核苷酸序列。“同一性”可以用肉眼或计算机软件进行评价。使用计算机软件,两个或多个序列之间的同一性可以用百分比(%)表示,其可以用来评价相关序列之间的同一性。上述方法中,所述1)中,所述γ-丁基甜菜碱羟化酶基因和所述肉碱转运蛋白基因是通过含有γ-丁基甜菜碱羟化酶基因和肉碱转运蛋白基因的表达盒的重组表达载体导入所述受体菌中。所述γ-丁基甜菜碱羟化酶基因和肉碱转运蛋白基因的表达盒是指能够在宿主细胞中表达γ-丁基甜菜碱羟化酶基因和肉碱转运蛋白基因的dna,该dna不但可包括启动γ-丁基甜菜碱羟化酶基因和肉碱转运蛋白基因转录的启动子,还可包括终止γ-丁基甜菜碱羟化酶基因和肉碱转运蛋白基因转录的终止子。进一步的,所述表达盒还可包括增强子序列。更进一步的,启动所述γ-丁基甜菜碱羟化酶基因和肉碱转运蛋白基因转录的启动子为pbad启动子。在本发明的一个实施例中,所述γ-丁基甜菜碱羟化酶基因和所述肉碱转运蛋白基因是通过重组载体pyb1a-bbox-cait导入所述受体菌中。所述重组载体pyb1a-bbox-cait为将pyb1a载体的bglii和psti酶切位点间的片段替换为seqidno.2所示的γ-丁基甜菜碱羟化酶基因,且将psti和ecori位点间的片段替换为seqidno.4所示的肉碱转运蛋白cait基因,且保持pyb1a载体的其他序列不变后得到的载体。所述2)中,所述γ-丁基甜菜碱羟化酶基因是通过含有γ-丁基甜菜碱羟化酶基因的表达盒的重组表达载体导入所述受体菌中。所述γ-丁基甜菜碱羟化酶基因的表达盒是指能够在宿主细胞中表达γ-丁基甜菜碱羟化酶基因的dna,该dna不但可包括启动γ-丁基甜菜碱羟化酶基因转录的启动子,还可包括终止γ-丁基甜菜碱羟化酶基因转录的终止子。进一步的,所述表达盒还可包括增强子序列。更进一步的,启动所述γ-丁基甜菜碱羟化酶基因和肉碱转运蛋白基因转录的启动子为pbad启动子。在本发明的另一个实施例中,所述γ-丁基甜菜碱羟化酶基因是通过重组载体pyb1a-bbox导入所述受体菌中;所述重组载体pyb1a-bbox为将pyb1a载体的bglii和psti酶切位点间的片段替换为seqidno.2所示的γ-丁基甜菜碱羟化酶基因,且保持pyb1a载体的其他序列不变后得到的载体。所述1)和所述2)中,所述pbad启动子的核苷酸序列同专利cn104805047中的核苷酸序列。上述方法中,所述野生型大肠杆菌为大肠杆菌k12。所述大肠杆菌突变体s1是将大肠杆菌k12的α-酮戊二酸脱氢酶基因(suca)替换为两端带有frt位点的卡那霉素抗性基因从而将大肠杆菌k12的α-酮戊二酸脱氢酶基因(suca)敲除(缺失)的大肠杆菌k12突变体。所述大肠杆菌突变体s2是将大肠杆菌突变体s1的异柠檬酸裂合酶基因(acea)替换为两端带有frt位点的卡那霉素抗性基因从而将大肠杆菌突变体s1的异柠檬酸裂合酶基因(acea)敲除(缺失)的大肠杆菌k12突变体。所述大肠杆菌突变体s3是将大肠杆菌突变体s1的丙酮酸氧化酶基因(poxb)替换为乙酰辅酶a合成酶基因(acs)和卡那霉素抗性基因得到的大肠杆菌k12突变体。所述大肠杆菌突变体s4是将s1△kan(删除了卡那霉素抗性基因的大肠杆菌突变体s1)的巴豆甜菜碱还原酶基因(caia)、甜菜碱/肉碱辅酶a转移酶基因(caib)、辅酶a连接酶基因(caic)、巴豆甜菜碱coa水合酶基因(caid)、肉碱消旋酶及肉碱脱水酶活性诱导基因(caie)构成的基因簇整段替换为卡那霉素抗性基因得到的大肠杆菌k12突变体。所述大肠杆菌突变体s5是将大肠杆菌突变体s2的丙酮酸氧化酶基因(poxb)替换为乙酰辅酶a合成酶基因(acs)和卡那霉素抗性基因得到的大肠杆菌k12突变体。所述大肠杆菌突变体s6是将s1△kan的肉碱转运蛋白基因(cait)、巴豆甜菜碱还原酶基因(caia)、甜菜碱/肉碱辅酶a转移酶基因(caib)、辅酶a连接酶基因(caic)、巴豆甜菜碱coa水合酶基因(caid)、肉碱消旋酶及肉碱脱水酶活性诱导基因(caie)以及上游的操纵子基因簇(fixabcx)整段替换为卡那霉素抗性基因得到的大肠杆菌k12突变体。所述大肠杆菌突变体s7是将大肠杆菌突变体s6的丙酮酸氧化酶基因(poxb)替换为乙酰辅酶a合成酶基因(acs)和卡那霉素抗性基因得到的大肠杆菌k12突变体。为了解决上述技术问题,本发明又提供了上述方法制备的产左旋肉碱的重组菌。在本发明的具体实施例中,产左旋肉碱的重组菌具体为将pyb1a-bbox-cait导入所述大肠杆菌突变体s1得到的重组菌s1/pyb1a-bbox-cait,pyb1a-bbox-cait导入所述大肠杆菌突变体s2得到的重组菌s2/pyb1a-bbox-cait,pyb1a-bbox-cait导入所述大肠杆菌突变体s3得到的重组菌s3/pyb1a-bbox-cait,pyb1a-bbox-cait导入所述大肠杆菌突变体s4得到的重组菌s4/pyb1a-bbox-cait,pyb1a-bbox-cait导入所述大肠杆菌突变体s5得到的重组菌s5/pyb1a-bbox-cait,pyb1a-bbox-cait导入所述大肠杆菌突变体s6得到的重组菌s6/pyb1a-bbox-cait,pyb1a-bbox-cait导入所述大肠杆菌突变体s7得到的重组菌s7/pyb1a-bbox-cait,pyb1a-bbox-cait导入所述大肠杆菌突变体s7得到的重组菌s7/pyb1a-bbox-cait,pyb1a-bbox导入野生型大肠杆菌k12得到的重组菌k12/pyb1a-bbox,pyb1a-bbox导入所述大肠杆菌突变体s1得到的重组菌s1/pyb1a-bbox,pyb1a-bbox-cait导入野生型大肠杆菌k12得到的重组菌k12/pyb1a-bbox-cait。上述方法制备的产左旋肉碱的重组菌在制备左旋肉碱中的应用也属于本发明的保护范围。为了解决上述技术问题,本发明最后提供了一种制备左旋肉碱的方法。本发明提供的制备左旋肉碱的方法包括将上述产左旋肉碱的重组菌经阿拉伯糖诱导培养得到诱导后重组菌,用所述诱导后重组菌催化γ-丁基甜菜碱得到左旋肉碱。上述制备左旋肉碱的方法中,所述阿拉伯糖诱导培养在阿拉伯糖浓度为0.2g/100ml的培养基中进行,所述诱导培养的温度可为20-37℃,所述诱导培养时间可为10-30小时。进一步的,所述诱导培养的温度可为30-37℃(如30℃),所述诱导培养时间可为12-20小时(如16小时)。实验证明,本发明所制备的左旋肉碱的重组菌的左旋肉碱的产量为30mm-50mm,具体如下:s1/pyb1a-bbox-cait的左旋肉碱产量为30.62mm,s2/pyb1a-bbox-cait的左旋肉碱产量为34.21mm,s3/pyb1a-bbox-cait的左旋肉碱产量为39.99mm,s4/pyb1a-bbox-cait的左旋肉碱产量为37.37mm,s5/pyb1a-bbox-cait的左旋肉碱产量为31.06mm,s6/pyb1a-bbox-cait的左旋肉碱产量为39.55mm,s7/pyb1a-bbox-cait的左旋肉碱产量为50.67mm。本发明在大肠杆菌中实现了左旋肉碱的生产,并通过代谢工程改造,解决左旋肉碱合成中辅因子的供给与循环,从而提高了左旋肉碱的产量。附图说明图1为pyb1a的物理图谱。图2为s4和s6的pcr验证。图2a为s4的pcr验证。图2b为s6的pcr验证。m:marker。图3为工程菌中γ-丁基甜菜碱羟化酶蛋白表达和肉碱转运蛋白表达的电泳检测结果。m:蛋白质分子量标准;1:k12/pyb1a-bbox的破碎上清液;2:s1/pyb1a-bbox的破碎上清液;3:k12/pyb1a-bbox-cait的破碎上清液;4:s1/pyb1a-bbox-cait的破碎上清液;5:s2/pyb1a-bbox-cait的破碎上清液;6:s3/pyb1a-bbox-cait的破碎上清液;7:s4/pyb1a-bbox-cait的破碎上清液;8:s5/pyb1a-bbox-cait的破碎上清液;9:s6/pyb1a-bbox-cait的破碎上清液;10:s7/pyb1a-bbox-cait的破碎上清液。图4为左旋肉碱标准品的hplc图谱。图5为s7/pyb1a-bbox-cait全细胞催化转化产物的hplc图谱。具体实施方式以下的实施例便于更好地理解本发明,但并不限定本发明。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的试验材料,如无特殊说明,均为自常规生化试剂商店购买得到的。以下实施例中的定量试验,均设置三次重复实验,结果取平均值。下述实施例中大肠杆菌k12记载于文献“babat,arat,hasegawam,takaiy,okumuray,babam,datsenkoka,tomitam,wannerbl,morih:constructionofescherichiacolik-12in-frame,single-geneknockoutmutants:thekeiocollection.molsystbiol2006,2:2006.0008.”中,是一株非病原菌,遗传背景清楚,世代时间短,容易培养且培养基原料低廉。大肠杆菌k12的全基因组序列的genbankaccession为u00096.3(gi:545778205,updatedate是aug01,2014,version是3)。公众可从中国科学院微生物研究所获得,该生物材料只为重复本发明的相关实验所用,不可作为其它用途使用。下述实施例中的pyb1a载体的核苷酸序列如seqidno.5所示,载体图谱如图1所示,包括如下片段:(1)arac-arabad-mcs片段(含阿拉伯糖诱导启动子、多克隆位点);(2)p15a复制起始位点片段;(3)氨苄霉素抗性基因ampr片段。下述实施例中的大肠杆菌突变体的基因型如表1所示。其中,大肠杆菌突变体s1、s2、s3和s5均记载于专利cn104805047及文献“baixuelin,keqiangfan,jianzhao,junjieji,linjunwu,keqianyang*,yongtao*.reconstitutionoftcacyclewithdaocstoengineere.coliintoanefficientwholecellcatalystofpenicilling.procnatlacadsciusa112(32):9855-9(2015).”中,公众可从中国科学院微生物研究所获得,该生物材料只为重复本发明的相关实验所用,不可作为其它用途使用。表1、大肠杆菌突变体的基因型菌株性状s1△suca::kans2△suca△acea::kans3△suca△poxb::acs-kans4△suca△caiabcde::kans5△suca△poxb::acs△acea::kans6△suca△caitabcde△fixabcx::kans7△suca△poxb::acs△caitabcde△fixabcx::kan下述实施例中涉及的蛋白及基因序列如下:α-酮戊二酸脱氢酶基因(suca)序列如ecogene:eg10979所示(由2802个核苷酸组成),α-酮戊二酸脱氢酶基因编码的α-酮戊二酸脱氢酶的氨基酸序列的genbank:aac73820.1(由933个氨基酸组成);异柠檬酸裂合酶基因(acea)序列如ecogene:eg10022(由1305个核苷酸组成),异柠檬酸裂合酶基因编码的异柠檬酸裂合酶的氨基酸序列的genbank:aac76985.1(由434个氨基酸组成);乙酰辅酶a合成酶基因(acs)序列如ecogene:eg11448(由1959个核苷酸组成),乙酰辅酶a合成酶基因编码的乙酰辅酶a合成酶的氨基酸序列的genbank:aac77039.1(由652个氨基酸组成);丙酮酸氧化酶基因(poxb)序列如ecogene:eg10754(由1719个核苷酸组成),丙酮酸氧化酶基因编码的丙酮酸氧化酶的氨基酸序列的genbank:aac73958.1(由572个氨基酸组成);巴豆甜菜碱还原酶基因(caia)序列如ecogene:eg11560所示(由1143个核苷酸组成),巴豆甜菜碱还原酶基因编码的巴豆甜菜碱还原酶的氨基酸序列的genbank:aac73150.1(由380个氨基酸组成)。甜菜碱/肉碱辅酶a转移酶基因(caib)序列如ecogene:eg11559所示(由1218个核苷酸组成),甜菜碱/肉碱辅酶a转移酶基因编码的甜菜碱/肉碱辅酶a转移酶的氨基酸序列的genbank:aac73149.1(由405个氨基酸组成)。辅酶a连接酶基因(caic)序列如ecogene:eg11558所示(由1554个核苷酸组成),辅酶a连接酶基因编码的辅酶a连接酶的氨基酸序列的genbank:aac73148.2(由517个氨基酸组成)。巴豆甜菜碱coa水合酶基因(caid)序列如ecogene:eg11557所示(由786个核苷酸组成),巴豆甜菜碱coa水合酶基因编码的巴豆甜菜碱coa水合酶的氨基酸序列的genbank:aac73147.2(由261个氨基酸组成)。肉碱消旋酶及肉碱脱水酶活性诱导基因(caie)序列如ecogene:eg12608所示(由591个核苷酸组成),肉碱消旋酶及肉碱脱水酶活性诱导基因编码的肉碱消旋酶及肉碱脱水酶活性诱导蛋白的氨基酸序列的genbank:aac73146.2(由196个氨基酸组成)。fixabcx基因簇基因序列如大肠杆菌k12基因组序列第42403-45750位所示(由3348个核苷酸组成),fixabcx基因簇基因序列编码的fixabcx基因簇的氨基酸序列的genbank分别为aac73152.2、aac73153.1、aac73154.1和aac73155.1(分别由256,313,428和95个氨基酸组成)。实施例1、构建表达γ-丁基甜菜碱羟化酶的重组质粒pyb1a-bbox构建表达γ-丁基甜菜碱羟化酶的重组质粒pyb1a-bbox。具体步骤如下:1、以合成的γ-丁基甜菜碱羟化酶基因(seqidno.2所示)为模板,采用引物对psvlb120-bbox-f(bglii):agcctcgagggtagatctatgggtaacgcaattgctga和psvlb120-bbox-r(ecori):cagaccgagctcaccgaattcttaacgttgcagcaccagga进行pcr扩增,得到γ-丁基甜菜碱羟化酶的编码基因(bbox)。pcr条件如下:95℃,5min;95℃,30sec;55℃,30sec(30循环);72℃,1min;72℃,5min。通过1%的琼脂糖凝胶电泳检测,片段大小约1190bp,与目的片段相符。2、将步骤1获得的bbox基因用bglii和ecori酶切,回收bbox基因片段。3、将pyb1a载体用bglii和ecori酶切后,回收载体大片段。4、将步骤2回收的bbox基因片段与步骤3回收的载体大片段用gibson方法(gibsondg,youngl,chuangry,venterjc,hutchisonca,3rd,smithho:enzymaticassemblyofdnamoleculesuptoseveralhundredkilobases.natmethods2009,6:343-345.)进行连接,连接产物转化t1感受态细胞(北京全式金生物,产品目录号为cd501),涂布于含氨苄霉素的lb固体平板上。37℃过夜,挑取单克隆提取质粒,进行pcr验证,正确的克隆送测序。将测序正确的重组质粒命名为重组载体pyb1a-bbox。重组载体pyb1a-bbox为将pyb1a载体的bglii和psti酶切位点间的片段替换为seqidno.2所示的γ-丁基甜菜碱羟化酶基因,且保持pyb1a载体的其他序列不变后得到的载体。seqidno.2(由1158个核苷酸组成)所示的γ-丁基甜菜碱羟化酶基因序列编码seqidno.1(由385个氨基酸组成)所示的γ-丁基甜菜碱羟化酶。其中,启动γ-丁基甜菜碱羟化酶基因转录的启动子为pbad启动子。实施例2、构建表达γ-丁基甜菜碱羟化酶和肉碱转运蛋白的重组质粒pyb1a-bbox-cait构建表达γ-丁基甜菜碱羟化酶和肉碱转运蛋白的重组质粒pyb1a-bbox-cait。具体步骤如下:1、以bw25113基因组为模板,采用引物对psvlb120-bbox-cait-f(ecori):ctggtgctgcaacgttaagaattcaaggagatataatgaagaatgaaaagag和psvlb120-bbox-cait-r(psti):ggctgccgcgcggcaccagctgcagttaatctttccagttctgtt进行pcr扩增,得到转运蛋白cait的编码基因(cait)。pcr条件如下:95℃,5min;95℃,30sec;55℃,30sec(30循环);72℃,1min;72℃,5min。通过1%的琼脂糖凝胶电泳检测,片段大小约1500bp,与目的片段相符。2、将步骤1获得的cait基因用ecori和psti酶切后,回收cait基因片段。3、将实施例1获得的重组载体pyb1a-bbox用ecori和psti酶切后,回收pyb1a-bbox大片段。4、将步骤2回收的cait基因片段与步骤3回收的pyb1a-bbox大片段用gibson方法(gibsondg,youngl,chuangry,venterjc,hutchisonca,3rd,smithho:enzymaticassemblyofdnamoleculesuptoseveralhundredkilobases.natmethods2009,6:343-345.)进行连接,连接产物转化t1感受态细胞,涂布于含氨苄霉素的lb固体平板上。37℃过夜,挑取单克隆提取质粒,进行验证,正确的克隆送测序。将测序正确的重组质粒命名为重组载体pyb1a-bbox-cait。重组载体pyb1a-bbox-cait为将pyb1a载体的bglii和psti酶切位点间的片段替换为seqidno.2所示的γ-丁基甜菜碱羟化酶基因,且将psti和ecori位点间的片段替换为seqidno.4所示的肉碱转运蛋白cait基因,且保持pyb1a载体的其他序列不变后得到的载体。seqidno.2(由1158个核苷酸组成)所示的γ-丁基甜菜碱羟化酶基因序列编码seqidno.1(由385个氨基酸组成)所示的γ-丁基甜菜碱羟化酶;seqidno.4(由1515个核苷酸组成)所示的肉碱转运蛋白cait基因序列编码seqidno.3(由504个氨基酸组成)所示的肉碱转运蛋白。重组载体pyb1a-bbox-cait表达γ-丁基甜菜碱羟化酶和肉碱转运蛋白的融合蛋白。其中,启动γ-丁基甜菜碱羟化酶基因和肉碱转运蛋白基因转录的启动子为pbad启动子。实施例3、大肠杆菌突变体s1,s2,s3,s4,s5,s6,s7的构建本实施例将大肠杆菌k12进行不同的单基因敲除,构建s1,s2,s3,s4,s5,s6,s7大肠杆菌突变体。一、大肠杆菌突变体s1,s2,s3,s5的构建大肠杆菌突变体s1,s2,s3和s5分别为专利cn104805047中记载的大肠杆菌突变体pg01、pg16、pg03和pg05。具体构建方法参见专利cn104805047中的具体步骤。大肠杆菌突变体s1是将大肠杆菌k12的α-酮戊二酸脱氢酶基因(suca)替换为两端带有frt位点的卡那霉素抗性基因从而将大肠杆菌k12的α-酮戊二酸脱氢酶基因(suca)敲除(缺失)得到的大肠杆菌k12突变体。s1△kan为删除了卡那霉素抗性基因的大肠杆菌突变体s1。大肠杆菌突变体s2是将大肠杆菌突变体s1的异柠檬酸裂合酶基因(acea)替换为两端带有frt位点的卡那霉素抗性基因从而将大肠杆菌突变体s1的异柠檬酸裂合酶基因(acea)敲除(缺失)得到的大肠杆菌k12突变体。大肠杆菌突变体s3是将大肠杆菌突变体s1的丙酮酸氧化酶基因(poxb)替换为乙酰辅酶a合成酶基因(acs)和卡那霉素抗性基因得到的大肠杆菌k12突变体。所述大肠杆菌突变体s5是将大肠杆菌突变体s2的丙酮酸氧化酶基因(poxb)替换为乙酰辅酶a合成酶基因(acs)和卡那霉素抗性基因得到的大肠杆菌k12突变体。二、大肠杆菌突变体s4的构建大肠杆菌突变体s4是将s1△kan(删除了卡那霉素抗性基因的大肠杆菌突变体s1)的巴豆甜菜碱还原酶基因(caia)、甜菜碱/肉碱辅酶a转移酶基因(caib)、辅酶a连接酶基因(caic)、巴豆甜菜碱coa水合酶基因(caid)、肉碱消旋酶及肉碱脱水酶活性诱导基因(caie)构成的基因簇整段替换为卡那霉素抗性基因得到的大肠杆菌k12突变体。具体构建方法如下:1、宿主菌的制备将大肠杆菌突变体s1中的卡那霉素抗性基因删除,得到大肠杆菌突变体s1△kan(简称s1△kan)。具体删除方法如下:首先,利用表达flp重组酶的质粒pcp20(购自clontech公司)化学转化s1,将s1的frt位点之间的卡那霉素抗性基因删除,敲除s1的卡那霉素抗性,得到大肠杆菌突变体s1△kan(简称s3△kan)。s1△kan在涂布卡那霉素抗性的lb平板(卡那霉素浓度为50μg/ml)上不生长,表明已经消除s1的卡那霉素抗性。将pkd46质粒(购自clontech公司)通过化学转化法转化消除了卡那霉素抗性的大肠杆菌突变体s1△kan(简称s1△kan),得到含有质粒pkd46的重组大肠杆菌pkd46/s1△kan。重组大肠杆菌pkd46/s1△kan在阿拉伯糖诱导后,表达λ噬菌体的重组蛋白,宿主菌就具有了同源重组的能力。2、s4的构建以pkd13质粒(购自clontech公司)为模板,采用上游引物caiaup-red-f:agaactggaaagattaattaacccccaaaatatcaagaggttgaaagatgattccggggatccgtcgacc和下游引物caiedown-red-r:atccagcaaccaggtcgcatccggcaagatcaccgtttaggcgtcacagaagttcctatactttctagag进行pcr扩增,得到大小为1382bp的caiaup-kan-caiedown打靶片段。将获得的caiaup-kan-caiedown片段电转入步骤1获得的重组大肠杆菌pkd46/s1△kan感受态细胞中,在含卡那霉素的lb平板上(卡那霉素浓度为50μg/ml)筛选阳性克隆。采用caia-up567-f(tatgctatccagatgatcttcc)和caie-d326-r(cacagaaataagctgcgaagttaag)进行pcr验证(引物结合位点分别是大肠杆菌caia基因的上游和caie基因的下游区域,阳性克隆的扩增产物大小为2300bp),pcr鉴定结果如图2a所示,正确的克隆送测序。将测序正确的克隆命名为大肠杆菌突变体s4,基因型为△suca△caiabcde-kan。测序结果表明:s4的基因组上没有caiabcde片段。三、大肠杆菌突变体s6的构建大肠杆菌突变体s6是将s1△kan(删除了卡那霉素抗性基因的大肠杆菌突变体s1)的肉碱转运蛋白基因(cait)、巴豆甜菜碱还原酶基因(caia)、甜菜碱/肉碱辅酶a转移酶基因(caib)、辅酶a连接酶基因(caic)、巴豆甜菜碱coa水合酶基因(caid)、肉碱消旋酶及肉碱脱水酶活性诱导基因(caie)以及上游的操纵子基因簇(fixabcx)整段替换为卡那霉素抗性基因得到的大肠杆菌k12突变体。具体构建方法如下:1、宿主菌的制备将pkd46质粒(购自clontech公司)通过化学转化法转化消除了卡那霉素抗性的大肠杆菌突变体s1△kan(简称s1△kan),得到含有质粒pkd46的重组大肠杆菌pkd46/s1△kan。重组大肠杆菌pkd46/s1△kan在阿拉伯糖诱导后,表达λ噬菌体的重组蛋白,宿主菌就具有了同源重组的能力。2、s6的构建以pkd13质粒为模板,采用上游引物fixxdown-red-f(tcagtgcggcgttacgtatcaaaccaacatcagccgtaacggacctccacaattccggggatccgtcgacc)和下游引物caiedown-red-r(atccagcaaccaggtcgcatccggcaagatcaccgtttaggcgtcacagaagttcctatactttctagag)进行pcr扩增,扩增得到大小为1383bp的fixxdown-kan-caiedown打靶片段。将获得的fixxdown-kan-caiedown打靶片段电转入步骤1获得的重组大肠杆菌pkd46/s1△kan感受态细胞中,利用含卡那霉素的lb平板上(卡那霉素浓度为50μg/ml),筛选阳性克隆。采用fixx-d346-f(gatatcacgccgatggcgatg)和caie-d326-r(cacagaaataagctgcgaagttaag)进行pcr验证(引物结合位点分别是大肠杆菌caie基因的下游和fixx基因的下游区域,阳性克隆的扩增产物大小为2100bp),pcr鉴定结果如图2b所示,正确的克隆送测序。将测序正确的克隆命名为大肠杆菌突变体s6,基因型为△suca△fixabcx△caitabcde-kan。测序结果表明:s6的基因组上没有fixabcx-caitabcde片段。四、大肠杆菌突变体s7的构建大肠杆菌突变体s7是将大肠杆菌突变体s6的丙酮酸氧化酶基因(poxb)替换为乙酰辅酶a合成酶基因(acs)和卡那霉素抗性基因得到的大肠杆菌k12突变体。具体构建方法如下:1、宿主菌的制备按照步骤二的1中的方法将s3的frt位点之间的卡那霉素抗性基因删除,得到大肠杆菌突变体s3△kan(简称s3△kan)。2、s7的构建以pkd13质粒为模板,采用上游引物fixxdown-red-f(tcagtgcggcgttacgtatcaaaccaacatcagccgtaacggacctccacaattccggggatccgtcgacc)和下游引物caiedown-red-r(atccagcaaccaggtcgcatccggcaagatcaccgtttaggcgtcacagaagttcctatactttctagag)进行pcr扩增,扩增得到大小为1383bp的fixxdown-kan-caiedown打靶片段。将fixxdown-kan-caiedown打靶片段电转入重组大肠杆菌pkd46/s3△kan感受态细胞中,利用含卡那霉素的lb平板上(卡那霉素浓度为50μg/ml),筛选阳性克隆。将测序正确的克隆命名为大肠杆菌突变体s7,基因型为△suca△poxb::acs△fixabcx△caitabcde-kan。测序结果表明:s7的基因组上没有fixabcx-caitabcde片段。实施例4、基因工程菌的构建将实施例1和实施例2中构建的表达载体pyb1a-bbox或pyb1a-bbox-cait用化学转化法转化大肠杆菌k12及实施例3中构建的大肠杆菌突变体s1,s2、s3、s4、s5、s6或s7,在含氨苄霉素的lb平板(氨苄霉素的浓度为50μg/ml)上筛选阳性克隆。其中,将pyb1a-bbox转化大肠杆菌k12得到的阳性克隆菌株命名为k12/pyb1a-bbox;pyb1a-bbox转化大肠杆菌突变体s1得到的阳性克隆菌株命名为s1/pyb1a-bbox;pyb1a-bbox-cait转化大肠杆菌k12得到的阳性克隆菌株命名为k12/pyb1a-bbox-cait;pyb1a-bbox-cait转化大肠杆菌突变体s1得到的阳性克隆菌株命名为s1/pyb1a-bbox-cait;pyb1a-bbox-cait转化大肠杆菌突变体s2得到的阳性克隆菌株命名为s2/pyb1a-bbox-cait;pyb1a-bbox-cait转化大肠杆菌突变体s3得到的阳性克隆菌株命名为s3/pyb1a-bbox-cait;pyb1a-bbox-cait转化大肠杆菌突变体s4得到的阳性克隆菌株命名为s4/pyb1a-bbox-cait;pyb1a-bbox-cait转化大肠杆菌突变体s5得到的阳性克隆菌株命名为s5/pyb1a-bbox-cait;pyb1a-bbox-cait转化大肠杆菌突变体s6得到的阳性克隆菌株命名为s6/pyb1a-bbox-cait;pyb1a-bbox-cait转化大肠杆菌突变体s7得到的阳性克隆菌株命名为s7/pyb1a-bbox-cait。实施例5、工程菌的诱导培养及全细胞催化生成左旋肉碱一、工程菌的诱导培养以实施例4中构建的10株菌中的任一株菌单独为工程菌,均同时进行如下实验:将工程菌划线到含有质量百分比浓度为1.6%的琼脂和浓度为100μg/ml的氨苄霉素的lb平板上,37℃培养12小时,挑取平板上所长的单克隆,接种到含有浓度为100μg/ml氨苄霉素的液体lb培养基中,37℃过夜震荡培养8-10小时。转速200转/分钟;将过夜培养物以体积百分比为2%的接种量接种至装有150ml2yt培养基(蛋白胨16g/l,酵母膏:10g/l,氯化钠5g/l,100μg/ml氨苄霉素)的容量为250ml挡板三角瓶中,37℃以200转/分钟的转速震荡生长4小时后,加入阿拉伯糖(阿拉伯糖的浓度为0.2g/100ml),30℃以200转/分钟的转速诱导培养16小时,得到诱导后的细胞。实验重复三次,每次每种工程菌3瓶。离心收集到的菌体采用超声波破碎,得到细胞破碎液,对细胞破碎液进行离心分别取上清液进行sds-page分析。结果如图3所示。本发明构建的如下7种工程菌:s1/pyb1a-bbox-cait、s2/pyb1a-bbox-cait、s3/pyb1a-bbox-cait、s4/pyb1a-bbox-cait、s5/pyb1a-bbox-cait、s6/pyb1a-bbox-cait和s7/pyb1a-bbox-cait均表达得到大小为43kda的γ-丁基甜菜碱羟化酶和56kda的肉碱转运蛋白。二、全细胞催化生成左旋肉碱及其产量检测将步骤一获得的诱导后的细胞,在8000转/分钟、4℃条件下离心10min,收集菌体;然后先用预冷的生理盐水(0.85%氯化钠水溶液)洗涤两次,再用转化底物液重悬,使其最终od600nm值为30。转化底物液配方如下:100mmtris-hcl(调ph7.5),50mmγ-丁基甜菜碱盐酸盐(调ph7.5),1%葡萄糖,1mmfe2+,1mmvc。转化条件为30℃条件下,1ml转化底物液于50ml大试管中进行全细胞催化6h。转化反应完成后,取反应体系,检测其中的左旋肉碱含量,具体步骤如下:(1)取反应体系,常温、12000rpm离心2min,收集上清液。(2)用蒸馏水稀释上清液10倍,经0.22μm滤膜过滤得到上样液。(3)取上样液,采用高效液相色谱法hplc检测左旋肉碱含量。色谱柱:agilentxdb-c18;流动相:a液:10mm辛烷磺酸钠,0.125%kh2po4,0.125%k2hpo4(磷酸调ph3.0);b液:100%乙腈;a液:b液=92:8(v:v);流速:0.3ml/min;温度:25℃;检测器:dad;检测波长:210nm;进样量10ul;hplc系统:agilent1260。以左旋肉碱标准品(上海蓝木化工有限公司,selleckchemicalsllcs2388)保留时间定性和采用标准曲线法(外标法)进行定量分析。实验设置三次重复,结果取平均值。左旋肉碱标准品的hplc图谱如图4所示,从图中可见,左旋肉碱标准品的保留时间为20.4min。各菌株催化结果如表2所示,结果表明上述7株工程菌的转化产物的hplc图谱中均有保留时间为20.4min的左旋肉碱的峰。其中,s7/pyb1a-bbox-cait的转化产物的hplc图谱如图5所示。结果表明:k12/pyb1a-bbox-cait的左旋肉碱产量为1.21mm。s1/pyb1a-bbox-cait的左旋肉碱产量为30.62mm,说明敲除suca后,有利于提高左旋肉碱的产量;s2/pyb1a-bbox-cait的左旋肉碱产量为34.21mm,s3/pyb1a-bbox-cait的左旋肉碱的产量为39.99mm,s4/pyb1a-bbox-cait的左旋肉碱的产量为37.37mm,三个双敲菌株转化均高于单敲suca菌,说明敲除suca和acea,敲除suca且将poxb替换为acs以及敲除suca和caiabcde基因簇,均有助于提高左旋肉碱的转化。s5/pyb1a-bbox-cait的左旋肉碱产量为31.06mm,s6/pyb1a-bbox-cait的左旋肉碱产量为39.55mm,说明在双敲菌(suca和acea)基础上进一步敲除基因poxb替换为acs,或进一步敲除基因簇fixabcx也有利于左旋肉碱的转化。在s6基础上进一步敲除基因poxb替换为acs得到s7菌株,s7/pyb1a-bbox-cait的左旋肉碱的产量为50.67mm,底物100%被转化,说明组合△suca△poxb::acs△caitabcde△fixabcx性状,对产左旋肉碱有利,可大大提高全细胞转化的效率。表2、各个工程菌的左旋肉碱含量工程菌左旋肉碱产量(mm)左旋肉碱产量(g/l)k12/pyb1a-bbox0.1±0.020.016±0.003s1/pyb1a-bbox0.3±0.040.048±0.006k12/pyb1a-bbox-cait1.21±1.580.20±0.25s1/pyb1a-bbox-cait30.62±0.674.94±0.11s2/pyb1a-bbox-cait34.21±4.045.52±0.65s3/pyb1a-bbox-cait39.99±2.906.45±0.47s4/pyb1a-bbox-cait37.37±3.206.02±0.52s5/pyb1a-bbox-cait31.06±2.815.01±0.45s6/pyb1a-bbox-cait39.55±5.136.37±0.83s7/pyb1a-bbox-cait50.67±0.588.17±0.09序列表<110>中国科学院微生物研究所<120>产左旋肉碱的重组菌及其构建方法与应用<160>5<170>patentinversion3.5<210>1<211>385<212>prt<213>人工序列(artificialsequence)<400>1metglyasnalailealaasptyrargthrpheproleuileserpro151015leualaseralaalaserphealaglyglyvalservalthrtrpala202530aspglyargvalserprophehisasnleutrpleuargaspasncys354045procysglyaspcysvaltyrgluvalthrarggluglnvalpheleu505560valalaaspvalprogluaspileglnvalglnalavalthrilegly65707580glyaspglyargleuvalvalglntrpaspaspglyhisalaserala859095tyrhisproglytrpleuargalahisalatyraspalaglnserleu100105110alagluargglualaalaargprohislyshisargtrpmetglngly115120125leuserleuprovaltyrasphisglyalavalmetglnaspaspasp130135140thrleuleuglutrpleuleualavalargaspvalglyleuthrgln145150155160leuhisglyvalprothrgluproglyalaleuileproleualalys165170175argileserpheilearggluserasnpheglyvalleupheaspval180185190argserlysalaaspalaaspserasnalatyrthralapheasnleu195200205proleuhisthraspleuprothrarggluleuglnproglyleugln210215220pheleuhiscysleuvalasnaspalathrglyglyasnserthrphe225230235240valaspglyphealailealaglualaleuargileglualaproala245250255alatyrargleuleucysgluthrprovalglupheargasnlysasp260265270arghisserasptyrargcysthralaprovalilealaleuaspser275280285serglygluvalarggluileargleualaasnpheleuargalapro290295300pheglnmetaspalalysargmetproasptyrtyrleualatyrarg305310315320argpheileglnmetthrarggluproargphecysphethrargarg325330335leuglualaglyglnleutrpcyspheaspasnargargvalleuhis340345350alaargaspalapheaspproalaserglyasparghispheglngly355360365cystyrvalaspargaspgluleuleuserargileleuvalleugln370375380arg385<210>2<211>1158<212>dna<213>人工序列(artificialsequence)<400>2atgggtaacgcaattgctgattatcgcacctttccgctgatctctccgctggcaagtgcg60gcctccttcgcaggcggtgtcagtgtgacgtgggcggatggtcgcgtttccccgtttcat120aacctgtggctgcgtgacaattgcccgtgtggcgattgcgtttacgaagtcacccgtgaa180caggtgttcctggttgcggacgtcccggaagatattcaggtgcaagccgttacgatcggc240ggtgatggtcgcctggtggttcagtgggatgacggtcatgcgtcagcctatcacccgggc300tggctgcgtgcacacgcttacgatgcccaatcgctggcagaacgtgaagcagctcgcccg360cataaacaccgctggatgcagggtctgagcctgccggtgtatgatcatggcgcagttatg420caagatgacgataccctgctggaatggctgctggcggtccgtgatgtgggtctgacccag480ctgcacggtgtgccgacggaaccgggcgccctgattccgctggcaaaacgtatttcattt540atccgcgaatcgaactttggcgttctgttcgatgtccgcagcaaagcggacgccgattct600aacgcctataccgcatttaatctgccgctgcataccgatctgccgacccgtgaactgcaa660ccgggtctgcaattcctgcactgcctggttaacgacgccaccggcggtaatagtacgttt720gtcgatggcttcgcaattgctgaagcactgcgtatcgaagcaccggcggcatatcgtctg780ctgtgcgaaaccccggttgaatttcgtaacaaagaccgccatagcgattaccgctgtacg840gctccggtcattgcgctggatagctctggtgaagtgcgtgaaatccgcctggctaatttt900ctgcgtgcgccgttccagatggacgctaaacgtatgccggattattacctggcatatcgt960cgctttattcagatgacccgtgaaccgcgcttttgcttcacgcgtcgcctggaagccggc1020caactgtggtgtttcgacaatcgtcgcgtgctgcatgctcgcgacgcgtttgatccggcg1080agcggtgatcgtcacttccagggctgttacgttgaccgtgatgaactgctgtctcgcatc1140ctggtgctgcaacgttaa1158<210>3<211>504<212>prt<213>人工序列(artificialsequence)<400>3metlysasnglulysarglysthrglyilegluprolysvalphephe151015proproleuileilevalglyileleucystrpleuthrvalargasp202530leuaspalaalaasnvalvalileasnalavalphesertyrvalthr354045asnvaltrpglytrpalapheglutrptyrmetvalvalmetleuphe505560glytrpphetrpleuvalpheglyprotyralalyslysargleugly65707580asngluproproglupheserthralasertrpilephemetmetphe859095alasercysthrseralaalavalleuphetrpglyserilegluile100105110tyrtyrtyrileserthrpropropheglyleugluproasnserthr115120125glyalalysgluleuglyleualatyrserleuphehistrpglypro130135140leuprotrpalathrtyrserpheleuservalalaphealatyrphe145150155160phephevalarglysmetgluvalileargproserserthrleuval165170175proleuvalglyglulyshisalalysglyleupheglythrileval180185190aspasnphetyrleuvalalaleuilephealametglythrserleu195200205glyleualathrproleuvalthrglucysmetglntrpleuphegly210215220ileprohisthrleuglnleuaspalaileileilethrcystrpile225230235240ileleuasnalailecysvalalacysglyleuglnlysglyvalarg245250255ilealaseraspvalargsertyrleuserpheleumetleuglytrp260265270valpheilevalserglyalaserpheilemetasntyrphethrasp275280285servalglymetleuleumettyrleuproargmetleuphetyrthr290295300aspproilealalysglyglypheproglnglytrpthrvalphetyr305310315320trpalatrptrpvaliletyralaileglnmetserilepheleuala325330335argileserargglyargthrvalarggluleucyspheglymetval340345350leuglyleuthralaserthrtrpileleutrpthrvalleuglyser355360365asnthrleuleuleuileasplysasnileileasnileproasnleu370375380ilegluglntyrglyvalalaargalaileilegluthrtrpalaala385390395400leuproleuserthralathrmettrpglyphepheileleucysphe405410415ilealathrvalthrleuvalasnalacyssertyrthrleualamet420425430serthrcysarggluvalargaspglyglugluproproleuleuval435440445argileglytrpserileleuvalglyileileglyilevalleuleu450455460alaleuglyglyleulysproileglnthralaileilealaglygly465470475480cysproleuphephevalasnilemetvalthrleuserpheilelys485490495aspalalysglnasntrplysasp500<210>4<211>1515<212>dna<213>人工序列(artificialsequence)<400>4atgaagaatgaaaagagaaaaacgggaatagaaccgaaggttttctttccgccgttaata60atcgtcggcatactttgttggcttacagtcagagatctggatgcagcgaatgtcgttatt120aatgctgtattcagttacgtcaccaatgtatggggatgggcatttgaatggtatatggtg180gtgatgcttttcggttggttctggctggtgtttggcccgtatgccaaaaagcgtttaggt240aacgaaccgccagaatttagcaccgccagttggatctttatgatgttcgcctcctgtacg300tctgctgccgtactgttctggggatcgattgagatctactactacatctccaccccgccg360tttggcttagaaccgaactcgacaggggcgaaagagttggggctggcttacagcttgttc420cactggggacctctgccgtgggccacttacagcttcctttcagtcgccttcgcttacttc480ttctttgtccgcaaaatggaagtgattcgccccagctcgacactggtgccgctggtaggt540gaaaaacacgccaaagggttgttcggcactatcgtcgacaacttctatctcgtcgccttg600atcttcgcgatgggtaccagtctgggccttgccacgccgctggtgaccgagtgtatgcaa660tggttgtttggcattccgcataccctgcaactggacgctatcatcattacctgctggatt720atcctcaacgccatttgcgtcgcttgcggtctgcaaaaaggggtacgtatcgccagtgac780gtgcgtagttacctgagcttcctgatgctgggttgggtgttcattgtcagcggtgccagc840ttcatcatgaactacttcaccgattcggtggggatgttgctgatgtatctgccgcgcatg900ttgttctataccgatcccatcgctaaaggcggcttcccgcagggctggaccgtgttctac960tgggcatggtgggtgatttatgctatccagatgagtatcttcctcgcccgcatctcccgt1020ggtcgtactgtgcgtgaactgtgcttcggcatggtgctggggctgacagcgtcaacctgg1080atcctgtggactgtactcggtagtaacactctgctgttgatagataaaaacatcatcaac1140attccaaatctgatcgaacagtacggtgtggcgcgcgccatcattgaaacctgggccgct1200ctgccactcagcaccgccaccatgtggggcttcttcatcctctgctttattgccaccgtt1260acgctggttaacgcctgctcttataccctggcgatgtccacttgccgcgaagtacgcgat1320ggtgaagaaccacctctgctggtgcgtatcggttggtcaattctggttggcattatcggt1380attgttctgctggcgctcggcggcctgaaaccgattcaaaccgccattatcgccggagga1440tgcccgctgttcttcgtcaacattatggtgacgctctcctttattaaagacgcgaaacag1500aactggaaagattaa1515<210>5<211>3528<212>dna<213>人工序列(artificialsequence)<400>5aatgtgcctgtcaaatggacgaagcagggattctgcaaaccctatgctactccgtcaagc60cgtcaattgtctgattcgttaccaattatgacaacttgacggctacatcattcacttttt120cttcacaaccggcacggaactcgctcgggctggccccggtgcattttttaaatacccgcg180agaaatagagttgatcgtcaaaaccaacattgcgaccgacggtggcgataggcatccggg240tggtgctcaaaagcagcttcgcctggctgatacgttggtcctcgcgccagcttaagacgc300taatccctaactgctggcggaaaagatgtgacagacgcgacggcgacaagcaaacatgct360gtgcgacgctggcgatatcaaaattgctgtctgccaggtgatcgctgatgtactgacaag420cctcgcgtacccgattatccatcggtggatggagcgactcgttaatcgcttccatgcgcc480gcagtaacaattgctcaagcagatttatcgccagcagctccgaatagcgcccttcccctt540gcccggcgttaatgatttgcccaaacaggtcgctgaaatgcggctggtgcgcttcatccg600ggcgaaagaaccccgtattggcaaatattgacggccagttaagccattcatgccagtagg660cgcgcggacgaaagtaaacccactggtgataccattcgcgagcctccggatgacgaccgt720agtgatgaatctctcctggcgggaacagcaaaatatcacccggtcggcaaacaaattctc780gtccctgatttttcaccaccccctgaccgcgaatggtgagattgagaatataacctttca840ttcccagcggtcggtcgataaaaaaatcgagataaccgttggcctcaatcggcgttaaac900ccgccaccagatgggcattaaacgagtatcccggcagcaggggatcattttgcgcttcag960ccatacttttcatactcccgccattcagagaagaaaccaattgtccatattgcatcagac1020attgccgtcactgcgtcttttactggctcttctcgctaaccaaaccggtaaccccgctta1080ttaaaagcattctgtaacaaagcgggaccaaagccatgacaaaaacgcgtaacaaaagtg1140tctataatcacggcagaaaagtccacattgattatttgcacggcgtcacactttgctatg1200ccatagcatttttatccataagattagcggatcctacctgacgctttttatcgcaactct1260ctactgtttctccatacccgttttttgggctaacaggaggaattaaccatgggtacctct1320catcatcatcatcatcacagcagcggcctggtgccgcgcggcagcctcgagggtagatct1380ggtactagtggtgaattcggtgagctcggtctgcagctggtgccgcgcggcagccaccac1440caccaccaccactaatacagattaaatcagaacgcagaagcggtctgataaaacagaatt1500tgcctggcggcagtagcgcggtggtcccacctgaccccatgccgaactcagaagtgaaac1560gccgtagcgccgatggtagtgtggggtctccccatgcgagagtagggaactgccaggcat1620caaataaaacgaaaggctcagtcgaaagactgggcctttcgtcgacgtgcgtcagcagaa1680tatgtgatacaggatatattccgcttcctcgctcactgactcgctacgctcggtcgttcg1740actgcggcgagcggaaatggcttacgaacggggcggagatttcctggaagatgccaggaa1800gatacttaacagggaagtgagagggccgcggcaaagccgtttttccataggctccgcccc1860cctgacaagcatcacgaaatctgacgctcaaatcagtggtggcgaaacccgacaggacta1920taaagataccaggcgtttccccctggcggctccctcgtgcgctctcctgttcctgccttt1980cggtttaccggtgtcattccgctgttatggccgcgtttgtctcattccacgcctgacact2040cagttccgggtaggcagttcgctccaagctggactgtatgcacgaaccccccgttcagtc2100cgaccgctgcgccttatccggtaactatcgtcttgagtccaacccggaaagacatgcaaa2160agcaccactggcagcagccactggtaattgatttagaggagttagtcttgaagtcatgcg2220ccggttaaggctaaactgaaaggacaagttttggtgactgcgctcctccaagccagttac2280ctcggttcaaagagttggtagctcagagaaccttcgaaaaactgccctgcaaggcggttt2340tttcgttttcagagcaagagattacgcgcagaccaaaacgatctcaagaagatcatctta2400ttaatcagataaaatatttctagatttcagtgcaatttatctcttcaaatgtagcacgcg2460gccgcggaacccctatttgtttatttttctaaatacattcaaatatgtatccgctcatga2520gacaataaccctgataaatgcttcaataatattgaaaaaggaagagtatgagtattcaac2580atttccgtgtcgcccttattcccttttttgcggcattttgccttcctgtttttgctcacc2640cagaaacgctggtgaaagtaaaagatgctgaagatcagttgggtgcacgagtgggttaca2700tcgaactggatctcaacagcggtaagatccttgagagttttcgccccgaagaacgttttc2760caatgatgagcacttttaaagttctgctatgtgatacactattatcccgtattgacgccg2820ggcaagagcaactcggtcgccgcatacactattctcagaatgacttggttgagtactcac2880cagtcacagaaaagcatcttacggatggcatgacagtaagagaattatgcagtgctgcca2940taaccatgagtgataacactgcggccaacttacttctgacaacgatcggaggaccgaagg3000agctaaccgcttttttgcacaacatgggggatcatgtaactcgccttgatcgttgggaac3060cggagctgaatgaagccataccaaacgacgagcgtgacaccacgatgcctgtagcaatgc3120caacaacgttgcgcaaactattaactggcgaactacttactctagcttcccggcaacaat3180taatagactgaatggaggcggataaagttgcaggaccacttctgcgctcggcccttccgg3240ctggctggtttattgctgataaatctggagccggtgagcgtgggtctcgcggtatcattg3300cagcactggggccagatggtaagcgctcccgtatcgtagttatctacaccacggggagtc3360aggcaactatggatgaacgaaatagacagatcgctgagataggtgcctcactgattaagc3420attggtaactgtcagaccaagtttactcatatatactttagattgatttaaaacttcatt3480tttaatttaaaaggatctaggtgaagatcctttttgataatcgcatgc3528当前第1页12
相关知识
左旋肉碱的作用与危害
左旋肉碱与减肥
左旋肉碱的作用?
畅宜左旋肉碱(快速燃脂!畅宜左旋肉碱的功效与作用)
左旋肉碱的四大功效 吃左旋肉碱的方法有哪些
吃左旋肉碱的副作用 左旋肉碱真的能减肥吗
左旋肉碱作用与功效副作用
左旋肉碱 CAS#: 541
左旋肉碱(绿茶胶囊 )(左旋肉碱)
左旋肉碱怎么服用 左旋肉碱的正确吃法
网址: 产左旋肉碱的重组菌及其构建方法与应用与流程 https://m.trfsz.com/newsview512976.html