肾脏代谢
【编者按】肾脏是代谢活跃的器官场所,为何SGLT2抑制剂有这么好的肾脏保护作用,其背后的机制离不开肾脏对糖的代谢改善,这篇经典综述非常详细地介绍了肾脏对于葡萄糖和果糖代谢,一起来学习第一部分:肾脏对葡萄糖的转运。
Compr Physiol. 2021 Dec 29;12(1):2995-3044.
摘要
近端肾小管程序化重吸收所有过滤过的葡萄糖和果糖。葡萄糖由顶侧钠-葡萄糖协同转运蛋白SGLT2和SGLT1摄取,而SGLT5以及SGLT4和GLUT5可能与顶侧果糖摄取有关。
近端小管吸收的葡萄糖通常不代谢,而是通过基底外侧促进葡萄糖转运体GLUT2离开,返回体循环或通过GLUT1吸收成为远端小管段的能量来源。近端小管在代谢性酸中毒和吸收后阶段产生新的葡萄糖, 果糖作为重要的底物。其实,在生理条件和生理摄入量下,近端肾小管摄取的果糖主要用于糖异生。
在糖尿病肾脏中,葡萄糖被潴留,糖异生增强,后者部分由果糖驱动。这是一种不良的反应,因为这种反应维持了高血糖。
此外,肾葡萄糖潴留通过SGLT2和SGLT1与钠潴留相结合,从而诱导继发性有害效应 。SGLT2抑制剂是新型的降糖药物,可以保护肾脏和心脏免受肾功能和糖尿病的影响。
膳食中过量的果糖也会诱发肾小管损伤。在病理条件下,肾脏生成果糖会放大这种损伤。果糖代谢与尿酸的形成有关,这部分解释了果糖诱导的肾小管损伤、炎症和血流动力学的改变。
果糖代谢倾向于糖酵解,而不是线粒体呼吸,因为尿酸盐抑制三羧酸循环中的顺乌头酸酶,这可能与有害的有氧糖酵解(Warburg效应)相关。
详细版的分界线
介绍
肾脏处理大量的D-葡萄糖。D-葡萄糖天然存在于植物和蔬菜,也可以由动物形成。相比之下,L-葡萄糖在自然界中不是自然存在的,但可以在实验室中合成。以下内容中, “葡萄糖”指的是D-葡萄糖。
葡萄糖是一种宝贵的能量底物,身体不想浪费或失去。考虑到健康成人的GFR约为180 L /d,血浆葡萄糖浓度为5 ~ 10mM (90 ~ 180 mg/dL) , 大量葡萄糖(180克/天)被肾小球滤过,随后被肾脏重吸收,重吸收主要位于近端肾小管(345,388)。此外,和肝脏一样,肾脏通过糖异生过程产生新的葡萄糖。后一过程也存在于近端肾小管,有助于维持全身葡萄糖稳态,但也有助于酸碱平衡,因为它涉及新的碳酸氢盐的生成(366)。近端小管细胞,重吸收大部分过滤后的葡萄糖并产生新的葡萄糖,通常不利用葡萄糖作为能量来源,可能是为了防止无效循环。相比之下, 远端肾小管利用葡萄糖作为初级能量底物(388)。近端小管葡萄糖处理在健康个体中很重要,在酸负荷和禁食期间具有额外的影响,并在疾病状态中具有病理生理相关性 。这尤其包括糖尿病或高血糖状态,但也与非糖尿病环境相关(388,438)。
在糖尿病患者中,肾脏葡萄糖潴留是一种不良的反应,并且能加重高血糖。因此,抑制肾脏葡萄糖重吸收的药物已被开发出来, 以促进尿葡萄糖丢失和降低高血糖。然而,这些药物也可以保护肾脏和心血管系统,涉及的多效机制不仅限于葡萄糖稳态(409,410,413)。与葡萄糖类似,果糖是一种己糖和单糖,在人体肾脏中代谢。果糖是蔗糖的一种成分,蔗糖是果糖和葡萄糖的双糖。果糖比葡萄糖更甜,它包含在高果糖玉米糖浆 (high fructose corn syrup,HFCS)中,在许多食物中都添加了甜味和味道。膳食中只有一小部分果糖能逃脱肝脏代谢,到达体循环,血浆果糖浓度通常仅在0.1-0.8mM(227)。由于血浆浓度较低 , 健康的肾脏滤过的果糖比葡萄糖少10倍。滤过的果糖主要在近端小管中被重吸收 (6,172),在生理条件下,它主要被用作糖异生的底物, 以帮助维持系统的葡萄糖浓度(255)。此外,肾脏能够通过激活多元醇途径从葡萄糖中内源性生成果糖(197,255)。然而,在病理条件下观察到的过量的膳食果糖摄入或异常的内源性果糖产生, 会对肾脏产生有害影响。事实上,肾脏内过量的内源性果糖生成已被认为参与多种肾脏疾病的发展和进展,包括糖尿病肾病和缺血-再灌注急性肾损伤,但也在衰老的肾脏中发现(255)。
果糖对肾脏的有害影响与尿酸相关,尿酸是果糖代谢的副产物,与多种病理过程相关,包括胰岛素抵抗、内皮功能障碍和肾小管损伤(175,254,260)。因此,在治疗特定肾脏疾病的过程中,可以考虑阻断果糖代谢的特定方面(112,159,161,255)。
这篇综述文章讨论了肾脏对葡萄糖和果糖的处理。这包括参与它们的运输、生成和代谢的分子角色,以及在健康肾脏中的生理整合。本文讨论了这两种糖分子的病理生理学意义及其相互作用,以及影响它们的治疗策略。感兴趣的读者参考了作者最近对该主题的评论,形成了当前工作的基础(99、159、161、255-257、259、268、388、389、395、409、413) 以及其他作者(45、82、170、345、349、366、367、438)的基础。关于葡萄糖在其他器官和物种中的转运的更广泛的讨论,见参考文献186。
肾葡萄糖转运的生理学研究
包括人类在内的许多生物体内,D-葡萄糖的细胞摄取和代谢提供了重要的能量来源 (191,453)。为了维持正常的功能,仅大脑就需要持续的葡萄糖供应和每天大约125 克的葡萄糖摄取。为了保证持续输送,血糖被高度控制。这种调节包括胰高血糖素和胰岛素等激素,它们控制细胞对葡萄糖的摄取、葡萄糖的储存、内源性生产(191,453)。
葡萄糖是一种分子量为180的小分子,未带电并在肾小球中被自由滤过。在健康个体中 , 假设肾小球滤过率(GFR ≈180升/天)和血糖浓度(约100 mg/dL)正常,肾脏每天过滤160-180克葡萄糖。过滤后的葡萄糖约等于每日能量消耗的三分之一,如果这些能量不能通过肾小管系统恢复,将随尿液流失。相反,在血糖正常的情况下,>99%滤过的葡萄糖被完肾小管系统重吸收。在狗、大鼠和小鼠的微穿刺研究中发现,这种葡 萄糖的重吸收主要发生在近端小管(92,314,402,429)(见图1)。
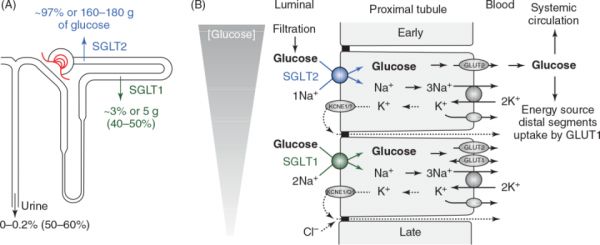
对大鼠的微穿刺研究表明,葡萄糖通过近端小管的通透性很小,因此,在正常的自由流动条件下,被动转运成分对葡萄糖的重吸收没有作用(220)。如以下几节所讨论的,葡萄糖通过两个钠离子偶联葡萄糖协同转运蛋白SGLT2和SGLT1从肾小球重吸收,SGLT2和SGLT1分别位于 近处和远处近端肾小管的刷状缘膜。葡萄糖通过这些转运体的重吸收是一个可饱和的 过程。据报道,在女性和男性健康个体中,葡萄糖的最大肾转运能力(Tmax)分别约为 430克和500克/天(78,247)。这些最大转运速率约等于肾小球过滤葡萄糖负荷的3倍,即在正常情况下,葡萄糖摄取的小管机制不存在饱和。理论上,在正常的GFR下,在血糖阈值为280 mg/dL时,葡萄糖开始出现在尿液中。然而,即使在健康的成年人中,单个肾单位的Tmax也有变化,因此,在大约180-200 mg/dL的血糖水平适度升高时,小部分葡萄糖可以溢出到尿液中。当血糖浓度超过270~290 mg/dL时,葡萄糖排泄量呈线性增加(见图2)。
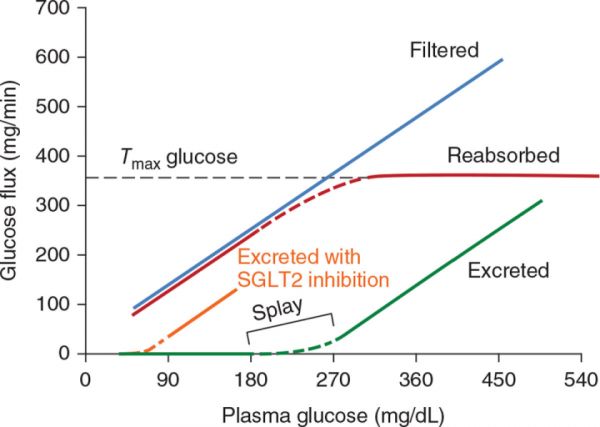
当GFR升高时, 比如在糖尿病或妊娠期间,葡萄糖尿可能发生在较低的血糖水平。在肾脏疾病中,当 GFR降低时,葡萄糖尿可能需要更高的血糖水平,除非肾小管的葡萄糖转运能力同样受损。
早期近端小管中的SGLT2主要负责肾葡萄糖的重吸收
20世纪80年代初,Barfuss和Schafer利用兔离体近端肾小管节段进行了研究 , 表明近处和远处近端小管节段有不同的摄取葡萄糖的速率和亲和力(19)。
Turner和Moran认为这是因为在刷状缘存在两种不同的葡萄糖转运蛋白(383)。这些观察和随访研究确定了Na+-葡萄糖共转运体SGLT2(SLC5A2)和SGLT1(SLC5A1)是肾脏中葡萄糖重吸收的关键基因和转运途径。这些研究包括对兔和大鼠肾单位片段的mRNA表达 分析以及膜囊中葡萄糖转运的研究,最后由Wright和Hediger实验室,在很大程度上完成于1981年至1995年完成(19,135,166,206,302,383, 428, 437, 439, 444)。这些研究明确了大部分葡萄糖重吸收发生在近处近端小管或S1/2段,并通过低亲和力高容量的顶端膜SGLT2介导。相比之下,与SGLT2相比,SGLT1对葡萄糖具有更高的亲和力,但运输能力较低,它被认为可以吸收远处近端小管大部分剩余的腔内葡萄糖,即S2/S3段(见图1)。
通过使用充分验证良好的抗体,SGLT2和SGLT1分别在近处和远处近端小管的刷状边界膜上的初级表达已在啮齿动物和人类肾脏中得到证实(17,319,402,418)。关于SGLT1在远处近端小管中的最高表达水平的位置,可能存在一些物种差异:在小鼠肾 脏,SGLT1蛋白表达S2段高于S3段的髓放线和外条纹(228),而在人类肾脏中,最强的表达SGLT1位于S3段(418)。基于显微解剖的肾小管段的RNA测序的小鼠肾上皮细 胞细胞图谱(“Mouse-RNA”数据库),证实了Sglt2(Slc5a2)和Sglt1(Slc5a1)分别在 S1和S2/S3节段的表达存在差异(表1)。在大鼠肾上皮细胞图谱(“大鼠-rna”数据库 ) 的显微解剖大鼠小管段中也记录了SGLT2 mRNA的主要表达, 由于某些原因没有在近端小管中检测到SGLT1信号(205,表2略)。
显微解剖大鼠肾小管节段的蛋白质组学分析(“大鼠-蛋白质”数据库)同样证实了SGLT2和SGLT1分别在S1和S2/S3段的优势表达(213,表3略)。与SGLT2和 SGLT1沿近端小管的不同表达模式一致,自由流肾微穿刺研究显示,缺乏SGLT2的小鼠早期近端小管缺乏葡萄糖重吸收(402)(见图3A),而缺乏SGLT1的小鼠葡萄糖重吸收至晚期近端曲小管(对应于S2段)仅从97%减少到94%(120)。
SGLT1除在近端小管远处表达外,关于小鼠以及人类肾脏的近期研究表明, SGLT1还在髓祥升支粗段的管腔膜以及致密斑上表达。
与此同时,小鼠rna、大鼠rna和大鼠蛋白数据库显示cTAL中有额外的SGLT1表达(表1-3略)。SGLT1在致密斑中的独特作用将在后面部分讨论。大鼠蛋白数据库还显示, cTAL和DCT等更远远端节段的SGLT2蛋白信号与大鼠rna和小鼠rna数据库中的一些 mRNA信号相关(表1-3),但相关性尚不清楚。
与上述讨论一致,人类携带SGLT1基因突变(SLC5A1)和SGLT2(SLC5A2)具有非常不同的肾脏表型。SGLT2突变的人存在“家族性肾性糖尿症”(OMIM 233100),即非常明显的糖尿(1 ~ 100 g/d),而肠道葡萄糖处理是正常的,因为SGLT2在该组织中不表达(326)。在SGLT2功能缺失突变的个体中,没有一致地观察到或报道过其他显著的问题(如肾功能受损或尿路感染)(326,438)。虽然这些突变并不常见,因此信息量有限,但这些见解支持了靶向SGLT2作为一种潜在安全的药理学策略的基本原理(下文将详细讨论)。
与SGLT2相比,SGLT1突变的个体很少或没有糖尿。然而, 由于SGLT1 在肠道葡萄糖重吸收中的决定性重要性,这些个体存在肠道葡萄糖半乳糖吸收不良(在线孟德尔遗传[OMIM] 182380)(185,233,438)。例如,给SGLT1突变的新生儿或缺乏SGLT1的基因靶向小鼠(120)喂养半乳糖或葡萄糖可诱发危及生命的腹泻。
与人类表型一致,SGLT2基因失活的小鼠模型出现了糖尿(222,298,402 )。此外,在正常血糖小鼠中,遗传和药物抑制显示,大约97%的葡萄糖被SGLT2重吸收 , 而SGLT1“清除”了剩下的约2%至3%(120,312,402)(见图1和3C)。
图3 定义SGLT2和SGLT1对肾葡萄糖重吸收的贡献。(A)左两组:通过微穿刺进行自由流动的肾小管液体收集,以建立沿肾脏表面可接近的近端小管的葡萄糖部分重吸收和液体部分重吸收的大致情况。在缺乏SGLT2的小鼠中,近处近端小管中的葡萄糖重吸收被阻止(Sglt2-/-),但在远处近端小管中增强,提示SGLT1的代偿作用。右图:在肾菊粉清除率研究中,Sglt2-/-小鼠肾葡萄糖重吸收的部分减少与过滤葡萄糖的量相关。(B)在代谢笼研究中,SGLT2抑制剂剂量依赖性地增加了WT小鼠的葡萄糖排泄。反应曲线向左移动,Sglt1-/-小鼠的最大反应增加了一倍。两种剂量-反应曲线之间的差异反映了WT小鼠通过SGLT1进行的葡萄糖重吸收。当SGLT1介导的葡萄糖摄取最大时(红色箭头),葡萄糖尿开始见于WT小鼠。在所有较高剂量(相同长度的垂直绿线)下,曲线之间的差异保持不变,表明在这个剂量范围内,药物对SGLT2和SGLT1的选择性。(C)使用基因敲除模型和药理工具在肾脏菊粉清除研究中表明,SGLT2敲除或抑制期间保留的葡萄糖重吸收(约40%)是由SGLT1介导的。SGLT2抑制剂恩格列净在低剂量和高剂量下使用,以建立接近IC50(约1-2 nM)或高出10倍的小鼠SGLT2的自由血浆浓度(类似于肾小球滤液中的浓度)。经RiegT等人许可重用,2014(312);VallonV等人,2011(402)
SGLT2的阻断揭示了SGLT1大量的肾葡萄糖转运能力
如上所述,SGLT2几乎重新吸收了正常肾脏中所有过滤过的葡萄糖。然而,在人类和 啮齿类动物中进行的研究表明,在选择性SGLT2抑制剂的存在下,肾脏葡萄糖重吸收分数保存在40%至50% (138,190,342)(见图1和图3)。同样在缺乏SGLT2的正常血糖小鼠中,肾脏对葡萄糖的重吸收分数在10% ~ 60%之间变化,并与过滤的葡萄糖量成反比,平均值约为40%(402)(见图3A)。这一难题在随后的研究中得到了解决,研究表明,在抑制SGLT2的过程中,下游SGLT1的大量运输能力被揭示出来(见图1和3)。第一份证据来自SGLT2基因敲除小鼠的微穿刺研究,在近处近端肾小管缺乏葡萄糖的净重吸收,与野生型小鼠相比,在近曲小管的后段部分,净葡萄糖重吸收显著且增强,这 与小鼠S2片段中SGLT1的高表达相一致(402)(见图3A)。
代谢笼研究表明,在SGLT1基因敲除小鼠中,选择性SGLT2抑制剂的尿糖排泄剂量-反应曲线向左移动(312 ) (图3b)。换句话说,当SGLT1不存在时,低剂量的SGLT2抑制剂出现了糖尿,因为它不能再补偿。此外,研究表明在野生型小鼠中,只有在SGLT1介导的葡萄糖转运饱和后,SGLT2抑制剂才能导致糖尿,这与SGLT1位于SGLT2下游并进行补偿一致。
最后,在没有SGLT1的情况下,SGLT2抑制剂诱导的最大糖尿反应增加了一倍,这与当SGLT2被抑制时,SGLT1可以重新吸收大约50%的过滤葡萄糖的观点一致(312)(见图3B)。相关的肾脏清除率研究表明,高剂量的选择性SGLT2抑制剂可将野生型小鼠的部分肾葡萄糖重吸收降低至 44%,并阻止SGLT1基因敲除小鼠的任何净肾葡萄糖重吸收(见图3C)。此外,在携带 SGLT2/SGLT1双敲除的雌性和雄性小鼠中,也发现了净肾葡萄糖重吸收的缺失(312 ) (见图3C)。这些研究证实,SGLT2和SGLT1共同参与了非糖尿病小鼠和血糖正常 小鼠肾脏葡萄糖的净重吸收(312)。因此,SGLT1具有相当大的肾脏葡萄糖转运能力 , 这与体外研究中观察到的人类SGLT1的最高葡萄糖转运率一致(150)。
当更多的葡萄糖被提供给SGLT1时,例如在SGLT2抑制期间,这种运输能力被揭示并参与进来。因此,在非糖尿病和糖尿病小鼠中显示(298,312,354),在小鼠、大鼠和狗中使用双SGLT2/SGLT1抑制剂的研究表明(299),SGLT1和SGLT2的双重抑制比 SGLT2的双重抑制加倍。此外,上述研究的结果被用来估计非糖尿病小鼠肾脏中SGLT2与SGLT1的葡萄糖重吸收能力的比例为3:1至5:1(99)。
近端小管吸收大量的葡萄糖,但与远端节段相比,糖酵解活性很少
健康肾脏将大部分滤过的葡萄糖通过SGLT2进入近处近曲小管,剩余小部分通过SGLT1进入远处近曲小管和近直小管(见上文)。然而,这些细胞没有强大的有氧和无氧糖酵解能力,而葡萄糖对这些片段的细胞代谢也没有实质性的贡献(124,182,384 ) 。事实上,葡萄糖被管腔膜吸收或由近端小管新形成(如下所述),主要通过促 进葡萄糖转运体穿过基底膜进入小管间质,主要是GLUT2(见图1;如下所述)。
在20世纪后期,许多研究表明,与肾单位和集合管系统的远端部分相比,近端肾小管的糖酵解潜能相当低。例如,己糖激酶(HK),磷酸果糖激酶(PFK)和丙酮酸激酶(PKM ),它们都是糖酵解的关键酶(见图4),在近端肾小管上皮细胞中都没有高表达(124, 335)(表1-3),特别是在S1节段,其中大部分葡萄糖通过SGLT2被重吸收。
因此,葡萄糖代谢的门户酶己糖激酶(将葡萄糖磷酸化为葡萄糖6-磷酸[Glc6P])(见 图4)在近端肾小管中活性较低(近处近端小管<近端直小管),并且相对于整个肾单位 (124)的活性较低。
图4 葡萄糖和果糖代谢。大部分过滤后的葡萄糖被近端小管S1段的SGLT2吸收,并通过基底外侧GLUT2离开(未显示)。这是因为与肾单位和集合管系统的进一步远端部分相比,近端小管的糖酵解能力相当低。因此,己糖激酶(HK)是葡萄糖代谢的门户酶,可磷酸化葡萄糖为葡萄糖-6-磷酸(Glc6P),相对于其他肾单位和集合管,在近端小管中活性较低。在近端小管内,HK(I、II)的表达和活性最高的是S2/S3节段。糖酵解的其他关键酶包括磷酸果糖激酶(PFK)和丙酮酸激酶(PKM)。与葡萄糖相比,果糖主要被S2/S3片段的SGLT5吸收,很容易被果糖激酶(称为酮己糖激酶,KHK)磷酸化,产生果糖1-磷酸果糖(Fru1P)。Fru1P随后被醛缩酶B(AldoB)裂解为磷酸二羟基丙 酮(DHAP)和甘油醛(GA)。DHAP和GA通过果糖1,6-二磷酸(Fru1,6BP)进入糖异生,或通过甘油醛-3-磷酸(G3P)进入糖酵解。G3P进入PFK远端糖酵解途径,形成 Fru1,6BP。PFK是调控最重要的酶,被认为是糖酵解的门控步骤,而果糖代谢则绕过了这种酶,缺乏负调控步骤。同时,果糖激酶的激活隔离了一个磷酸盐,从而使细胞内的磷酸盐和ATP水平短暂地降低。磷酸盐的快速还原从而激活AMP脱氨酶(AMPD),它将AMP裂解成IMP。AldoB对Fru1P相对较慢的代谢减弱了磷酸盐水平的下降 。后者被抑制AldoB的IMP的增加进一步减慢。IMP的代谢驱动尿酸盐的形成。果糖代谢与磷酸戊糖途径(PPP)相关以生成核苷酸和氨基酸,但是也生成脂质生成如甘油三酯和胆固醇,以及乳酸形成作为替代能量形式。尿酸抑制三羧酸循环中的乌头酸酶,从而有利于糖酵解而不是线粒体氧化磷酸化(OXPHOS),类似于Warburg效应。在糖异生过程中,DHAP、G3P和Fru1 ,6BP被代谢为葡萄糖(红色箭头)。TK,三糖激酶。
近端肾小管的葡萄糖重吸收率约为35pmol /min/mm,而己糖激酶活性约为2pmol /min/mm,表明只有葡萄糖的5%进入细胞的近端曲小管磷酸化为糖酵解(92)。相比之下,远端肾小管的糖酵解酶活性以及蛋白和mRNA表达(包括己糖激酶)要高得多(表1-3)。研究发现,大鼠髓袢升支粗段的己糖激酶活性比近端小管高15倍(336)。同样,丙酮酸激酶(一种催化糖 酵解途径中另一个不可逆步骤的酶)在集合管中的活性是在近端肾小管中的10 ~ 20 倍(335)。
Chamberlin等人基于对分离的兔肾小管节段的研究,提出糖酵解可以满足包括髓袢升支粗段在内的远端肾节段的能量需求(49)。值得注意的是,葡萄糖主要通过GLUT1通过基底外侧膜进入远端小管段(见下文)。
肾葡萄糖转运的分子基础
钠偶联葡萄糖通过顶端膜共转运
Na+肾小管系统的重吸收是由Na+/K+atp酶驱动的,该酶位于基底外侧膜,是主要的主动和atp消耗运输步骤。Na+/K+atp酶降低胞质Na+浓度从而建立浓度梯度,Na+以及继发吸收其他分子与Na+管腔刷状缘进入小管细胞(见图1和5)。
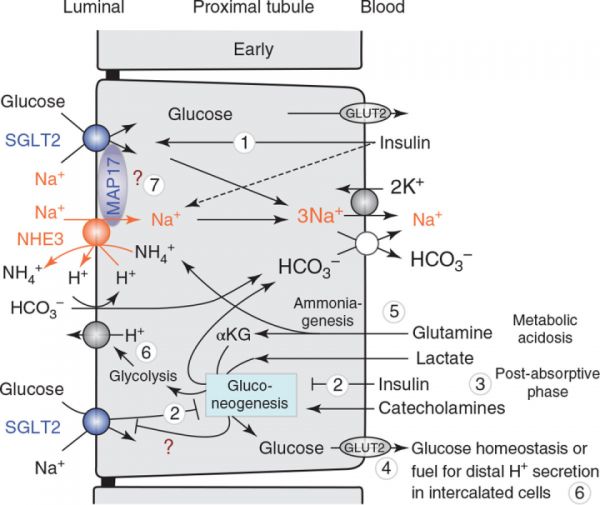
图5 近端小管中葡萄糖转运和糖异生的协调 (1)胰岛素是SGLT2的一种生理刺激物,在血糖水平升高的情况下,例如餐后,它可以最大限度地提高肾脏葡萄糖的重吸收能力。(2)同时,增强了钠+-葡萄糖摄取和胰岛素抑制肾糖异生。(3)相比之下,后者在吸收后阶段(禁食)被增加的儿茶酚胺和降低的胰岛素水平所刺激,主要涉及乳酸作为前体。(4)新形成的葡萄糖通过基底外侧GLUT2 传递到体循环。(5)在代谢性酸中毒中,谷氨酰胺产生的糖异生的增加与(i)铵(NH4+ 的形成有关),一种肾排出的酸当量,(ii)新的碳酸氢盐,进入循环。Na+-H+-交换子NHE3有助于顶端H+/NH4+的分泌和Na+/碳酸氢盐的重吸收。(6)新形成的葡萄糖可作为近端小管的分泌H+能量,或在细胞间转移后,为闰细胞H+分泌做能量来源(7)SGLT2和NHE3均受到胰岛素的刺激,以增强Na+和葡萄糖的重吸收,它们的功能可能通过支架蛋白MAP17呈正相关。?,表示需要进一步确认的路径。经许可修改,摘自VallonV,2020年(388)
1960年,Crane提出了Na+葡萄糖共转运假说。该假说认为,肠道上皮中活跃的葡萄糖运输是由细胞膜上的Na+ 梯度激活的(表达SGLT1)(查阅参考文献438)。这一概念很快被应用于其他分子和离子,包括Na+与葡萄糖在肾脏中的共转运(438)。
SGLT1和SGLT2属于人类SLC5溶质载体家族,共包含12个成员。其中,SGLT1和SGLT2的特征最为明显。六个成员被确定为SGLTs,他们对偶联的偏好不同:葡萄糖、半乳糖、果糖、甘露糖、肌醇和胆碱,但也有短链脂肪酸类和其他阴离子(438)。所有的SGLTs都有15个外显子,编码的蛋白质有580 - 718个氨基酸,分子量为60 - 80kDa(438)。
Wright、Hediger和他们的团队率先研究SGLT的分子性质包括SGLT1和SGLT2的克隆(参见文献127、438对SLC5家族的回顾)。人类SGLT1和SGLT2的氨基酸同源性为59%(439)。为了进一步定义Na+和糖共转运的分子模型,Wright的研究小组使用了副溶血性弧菌中半乳糖钠细菌亚型的晶体结构。根据该模型,外部通道通过Na+ 与转运蛋白的外部结合而打开。这使得糖可以从外部结合并被捕获。这导致了一个确认的变化,向内的门打开导致Na+和糖共同释放到细胞质中。转运周期是通过从无配体的内向状态到无配体的外向状态的构象变化来完成的(77,438)
通过电生理技术在各种表达系统中的应用,克隆的SGLT的糖的选择性和转运动力学被研究。研究表明SGLT1对葡萄糖和半乳糖具有相似的亲和力。相比之下, 葡萄糖而非半乳糖是SGLT2的底物,两者都不运输果糖(438)。在转染的人胚胎肾(HEK) 293T细胞中研究表明人SGLT2和人SGLT1对D-葡萄糖的亲和力(Km)在分别为5和2mM,即它们相当相似(150) 。Na+是糖与转运体结合所必需的,而人类SGLT2和人类SGLT1的Na+转运的Km值分别为 25和70mM(150)。数据表明,在正常血糖条件下,肾小球滤液的葡萄糖水平在SGLT2 的Km的范围内,而管腔Na+浓度,接近血浆浓度约140mM,远高于SGLT2的km,因此没有限速。
SGLT2和SGLT1的Na+-葡萄糖偶联比分别为1:1和2:1(150)。这增强了SGLT1的葡萄糖浓度功率,从而增强了其在远处近端小管中重新吸收葡萄糖的能力,尽管上游 SGLT2活性导致腔内葡萄糖浓度下降(见图1)。Na+-葡萄糖共运输的电致特性需要细胞旁Cl-重吸收和细胞间K+分泌来帮助保持膜电位,从而保持动力。钾离子通道 KCNE1/KCNQ1位于中后段近端小管管腔膜,在Na离子依赖性葡萄糖摄取过程中,与膜电位稳定有关(397,398)(见图1)。在小鼠近处近端小管中也可以检测到KCNE1,而不是KCNQ1,这表明KCNE1的β亚基可能与近处近端小管中的另一个K+通道α亚基相互作用。
除了SGLT2和SGLT1, SLC5家族的另外三个成员有在肾脏的mRNA水平上检测到与葡萄糖处理有关,即SGLT3、SGLT4和SGLT5(436)。SGLT3(SLC5A4)的存在促进了质膜的去极化, 以适应钠离子依赖性的葡萄糖转运,这可以被SGLT抑制剂黄酮醇苷(phlorizin)阻断。有人提出SGLT3作为葡萄糖传感器,然而,它的肾蛋白表达,它的位置和具体功能仍有待确定(356)。而Sglt3(Slc5a4)则没有在Rat-protein和Rat-mRNA数据库中检测到微弱信号,在Mouse-mRNA数据库中相关性不明确(表1-3)。
相比之下,Sglt4(Slc5a9)mRNA分别在小鼠S1到S3和大鼠S1/S2片段中表达,并在大鼠近端小管S2和 S3中检测到蛋白表达(表1-3)。对COS-7细胞的研究显示,SGLT4可以运输葡萄糖, 但其对甘露糖的亲和力要高得多,高于葡萄糖(Ki 0.15 vs. 8mM),表明SGLT4可能在甘露糖转运(369),并且可能是果糖的转运(如下文所讨论)。
SGLT5 (SLC5A10)的mRNA和蛋白表达在S2/S3片段中检测到(表1-3),这是一种Na+依赖性糖转运蛋白,与葡萄糖和半乳糖相比,对甘露糖和果糖具有相对较高的亲和力和能力(107,123)。在 肾皮质中检测到高水平的Sglt5mRNA(52,123),并在相关的基因敲除小鼠中进行了研 究,发现SGLT5是主要的管腔膜转运体,负责肾脏果糖的再吸收(95),详见下文。因此,SGLT1和SGLT2是顶端膜的主要通道,肾小管系统的葡萄糖摄取情况与上述功能研究一致。
葡萄糖通过基底外侧膜的易化转运
如上所述,通过管腔膜被吸收或新形成的葡萄糖在近端小管(如下文所讨论)通常不被代谢,但主要是穿过肾小管细胞基底膜。这一步骤主要通过易化性[编者注:易化运输(facilitated transport)是一种被动运输方式,通过细胞膜上的特定蛋白质(如载体蛋白或通道蛋白)来帮助某些分子或离子跨过细胞膜。这种运输不需要能量(ATP),而是依靠分子的浓度梯度进行。易化运输常见于大分子或带电荷的分子(如葡萄糖、氨基酸、离子等),它们无法通过简单扩散穿过细胞膜。载体蛋白或通道蛋白与这些分子结合,改变其构象,帮助它们顺浓度梯度穿过细胞膜。]葡萄糖转运体GLUT2发生(71),并由葡萄糖浓度梯度驱动(见图1)。葡萄糖随后通过对流和开窗内皮细胞进入小管周围毛细血管。在肾脏内,葡萄糖亲和力较低的“肝型”葡萄糖转运蛋 白GLUT2 (SLC2A2) (Km为15-20mM)主要表达于S1和S2节段的基底外侧膜,在S3节段表达较少或不表达(54)(见表1 - 3)。关于SLC2家族的综述,请参见参考文献145。
GLUT2是近曲小管中葡萄糖的基底侧出口(70,376,433)。相比之下,在大鼠肾脏中,很少或没有发现更高亲和力的表达,“红系/脑型”转运体GLUT1(SLC2A1)在S1段(Km;1-2mm),而在S3段特别检测到一个强大的信号,该转运体被认为是近端小管直线部分的细胞外葡萄糖转运(70,376,433)(表2,3)。在小鼠肾脏中,Glut1(Slc2a1) mRNA表达较多且均匀分布在S1至S3段(表1)。然而,在这两个物种中,肾GLUT1的最高表达量出现在远端小管段的基底膜中。正如在大鼠肾脏中分析的那样,这包括髓袢升支粗段和细段有着类似连接段和集合管中发现的高水平表达,包括主细胞和闰细胞,后者具有特别突出的表达(376),并且在小鼠中记录了类似的mRNA表达模式(表1-3)。
GLUT1的表达与细胞凋亡密切相关,肾单位和集合管节段的糖酵解活性与这一概念一致,葡萄糖通过基底外侧GLUT1进入特定的远端肾小管段进行能量供应 。应用正电子发射断层显像的小鼠实验表明,敲除GLUT2基因可消除肾脏对葡萄糖的重吸收,这支持在近端小管基底外侧,GLUT2比GLUT1在葡萄糖转出方面发挥更大作用 (见图1), (320)。这与在人类中观察到的GLUT2功能突变缺失导致Fanconi-Bickel综合征(以小管病变为特征)一致,其特征是近端肾小管功能损害,包括糖尿、氨基酸尿、磷尿、高尿酸血症和蛋白尿(288,327,328)。由此产生的广泛性近端肾小管功能损害,可能反映了当葡萄糖不能穿过基底外侧膜离开细胞时,葡萄糖细胞内蓄积所致的糖毒性。相比之下,GLUT1突变主要引起神经系统问题,而无明显的肾脏表型(288,341)。
[编者注:Fanconi-Bickel综合征是一种罕见的遗传性代谢疾病,属于糖原贮积病(Glycogen Storage Disease)的一种类型,具体是第XI型。该综合征由编码葡萄糖转运蛋白2(GLUT2)的基因突变引起。GLUT2主要在肝脏、肾脏、小肠和胰腺中表达,负责葡萄糖和其他单糖的转运。Fanconi-Bickel综合征的主要临床特征包括:1. 肾小管功能障碍(Fanconi综合征):包括氨基酸尿、糖尿、磷酸盐尿和碳酸氢盐尿。2. 肝脏异常:包括肝肿大(肝脏糖原堆积)和肝功能异常。3. 生长迟缓:从婴儿期开始表现出生长迟缓和发育迟缓。4. 骨骼异常:包括骨质疏松和肋骨畸形等。该综合征通常在婴儿期或儿童早期被诊断,主要通过基因检测确认。治疗主要是对症处理,旨在管理和缓解症状,包括补充缺失的电解质和营养物质,以及定期监测肝脏和肾脏功能。]
据报道,SLC2基因家族的其他一些成员在肾脏中表达,可能与葡萄糖转运有关,然而 , 关于它们的功能相关性的可用信息有限(251)。在这方面, 已经在大鼠肾脏的TAL中 检测到GLUT4,包括mRNA和蛋白水平(55)(也见表2和表3)。
此外,GLUT4与胰岛素样生长因子IGF-I共表达,TAL中Na+转运的刺激剂抗利尿激素也增加了GLUT4的表达。因此,我们推测GLUT4可能在该节段的局部能量控制中发挥潜在作用(55)。在小鼠TAL中也检测到Glut4(Slc2a4)mRNA(表1)。
Glut5(Slc2a5)表达于大鼠和小鼠的S2和S3节的顶端膜中,并被认为主要作为果糖转运蛋白(55,362)(也见表1-3),如下文所讨论。GLUT12 (SLC2A12) 能够转运葡萄糖,并已被认为在大鼠的远端小管和集合管的顶端膜中表达,但其功能相关性仍有待确定(215)。在一些小鼠和大鼠的远端节段中检测到Glut12 (Slc2a12) mRNA(表1和2)。
相关知识
肝脏代谢不好的症状
肝脏对脂类代谢的功能
世界肾脏日
水液代谢与哪些脏腑关系密切
护肾9大法宝 肾脏不生病
肾脏健康很重要 这样做能滋养肾脏
肾脏的基本结构和功能
如何促进肝脏代谢脂肪
科学饮水,守护肾脏
养肾=养命!肾脏生病,苦不堪言!“救肾”6招,快学起来!
网址: 肾脏代谢 https://m.trfsz.com/newsview593683.html