肿瘤代谢免疫治疗前沿
肿瘤发生过程中无论是肿瘤细胞还是免疫细胞均会发生代谢重塑,靶向肿瘤发生发展过程中的代谢改变就成为了药物研发的重要靶点。
在合成代谢过程中,二氢乳酸脱氢酶(DHODH)是嘧啶合成的关键限速酶,抑制DHODH能够抑制细胞增殖。
DHODH的肿瘤治疗潜力
在DHODH抑制剂中,最经典的一款是于1998年上市由赛诺菲开发的Leflunomide(来氟米特,简称LEFL),也是首款获FDA批准的药物,用于治疗类风湿关节炎、狼疮肾炎、银屑病等。
它通过抑制DHODH减少嘧啶合成,造成嘧啶饥饿影响T细胞增殖来发挥免疫抑制作用。
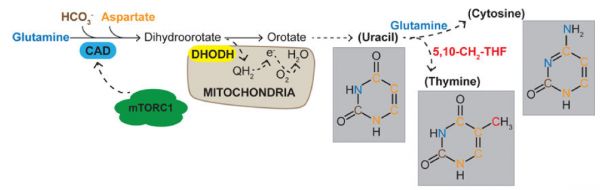
Nat Rev Mol Cell Biol. 2019 Jul;20(7):436-450.
看起来抑制DHODH产生的免疫抑制功能与肿瘤治疗是矛盾的,但近两年Leflunmide已开始被用于治疗实体瘤。
最新的一项研究表明,使用Leflunomide只会短期抑制效应T细胞,而不影响记忆T细胞。
Leflunomide能够抑制T细胞扩增,但对于接受Teriflunomide(特立氟胺,leflunomide的体内代谢活性成分,简称TFL)治疗的MS患者,其EBV、CMV特异性T细胞的数量并有明显差别。只有CMV特异性Tcm细胞数量具有差异(D)。
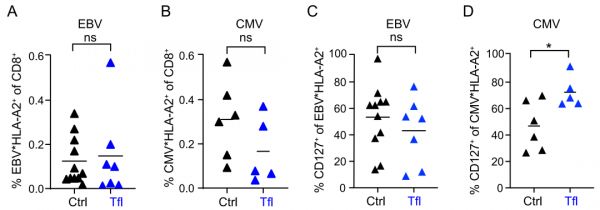
Nat Immunol. 2023 Feb 16.
在小鼠中,使用Leflunomide后脾中T细胞数量在短期内降低,但30天之后实验与对照组之间差异消失,若将实验组记忆T细胞移植到新小鼠中会表现出正常的分化增殖能力。
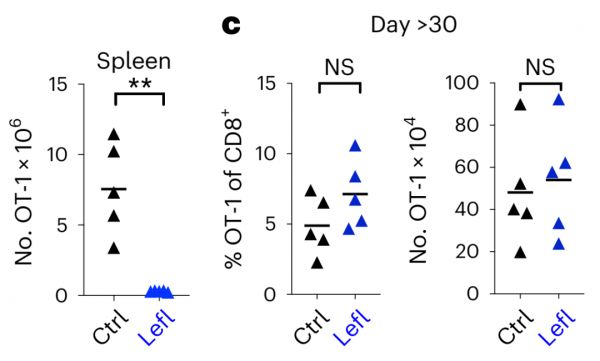
Nat Immunol. 2023 Feb 16.
使用Leflunomide后T细胞转录组发生改变,其中效应T细胞相关基因表达降低,记忆T细胞相关基因表升高,这种变化也会在30天后消失。
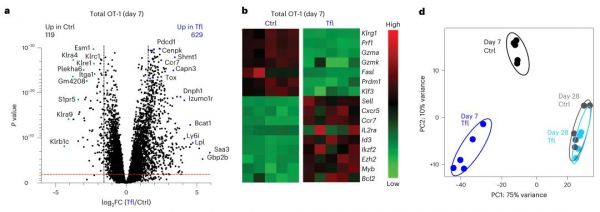
Nat Immunol. 2023 Feb 16.
通过以上实验得知使用Leflunomide抑制DHOHD后对效应T细胞和记忆T细胞的影响是不同的。
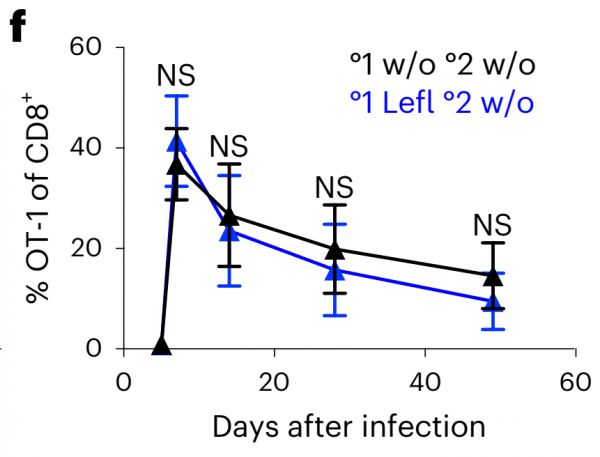
进一步的试验发现,在使用Leflunomide后2.75天,此时T细胞分裂次数由正常的3-6次减少到1-3次(b),但具有增殖能力的细胞数量在两组之间却无差别(c),CD 62L/C D69细胞亚群数量也相似。
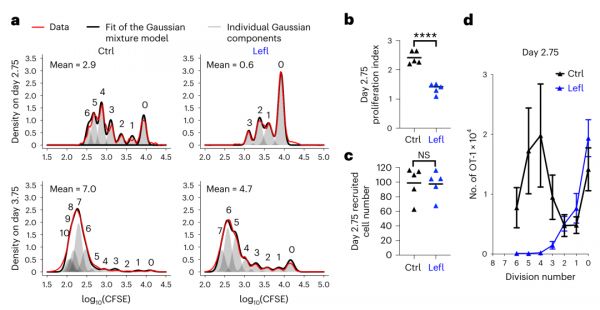
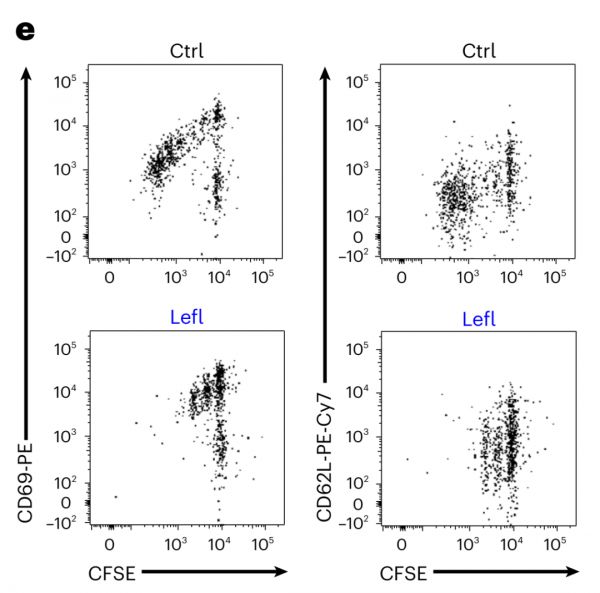
Nat Immunol. 2023 Feb 16.
因此,Leflunomide抑制DHODH后影响的主要是原始T细胞(Tnaive)向Teff的分化过程,而对Tem的形成无影响。
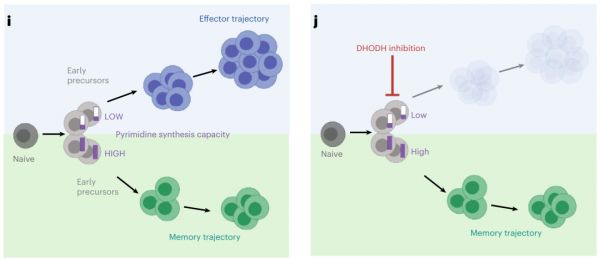
Nat Immunol. 2023 Feb 16.
DHODH抑制铁死亡
铁死亡是代谢性调控细胞死亡的一种方式,主要发生在病理情况下。在肿瘤发生过程中,肿瘤细胞对于铁的需求量大大增加,诱导铁死亡就成为治疗肿瘤的一个方向。
肿瘤细胞抵抗铁死亡的机制有以下三种:
谷胱甘肽过氧化物酶(GPX4)
GPX4位于胞质和线粒体中,能通过减少谷胱甘肽(GSH)的生成来减少脂质氢过氧化物造成的毒性。
铁死亡抑制蛋白(FSP1)
FSP1位于质膜,是一种不依赖GSH的铁死亡抑制因子。它能够将CoQ还原为CoQH2,而CoQH2是一种捕获自由基的亲脂性抗氧化剂,可以抑制脂质过氧化物抵抗铁死亡。
二氢乳酸脱氢酶(DHODH)
DHODH位于线粒体,是在上面两种分子之后新发现的铁死亡抑制因子。
DHOHD是嘧啶合成中的关键限速酶,催化底物二氢乳酸(DHO)来生成乳清酸(OA)。其中,DHO能减弱GPX4的铁死亡抑制作用,而OA可以增强细胞对GPX4的敏感性。
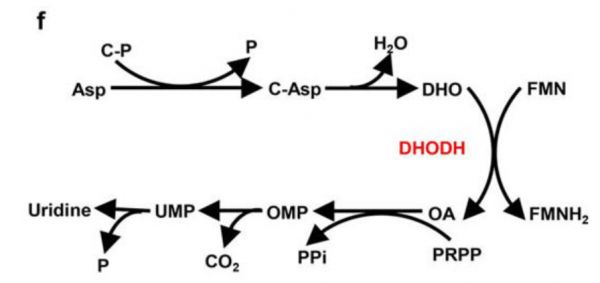
Nature. 2021 May;593(7860):586-590.
使用DHODH抑制剂具有治疗GPX4low肿瘤的潜力。
在研药物
目前以DHODH作为实体瘤治疗靶点的药还仍然只有Leflunomide。
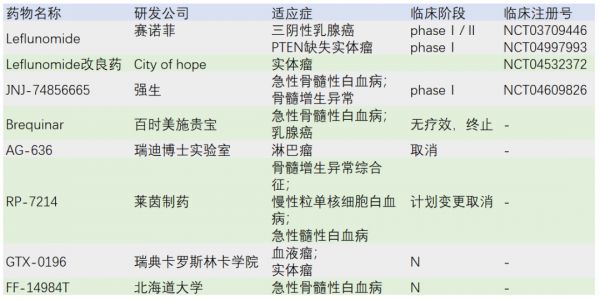
clinicaltrials.gov
小结
相较于Teff细胞在执行免疫功能后失活,Tm才是肿瘤治疗中的中坚力量。
鉴于Teff与Tm对抑制DHODH的敏感性不同,以及肿瘤细胞对DHODH的依赖性,以DHODH作为免疫检查点开发靶向抑制药物具有很大的肿瘤治疗潜力。
参考资料
Zhu J et al . Metabolic regulation of cell growth and proliferation. Nat Rev Mol Cell Biol. 2019 Jul;20(7):436-450.
Scherer S et al. Pyrimidine de novo synthesis inhibition selectively blocks effector but not memory T cell development. Nat Immunol. 2023 Feb 16.
Mao C et al. DHODH-mediated ferroptosis defence is a targetable vulnerability in cancer. Nature. 2021 May;593(7860):586-590.
clinicaltrials.gov
来源:闲谈 Immunology 2023-03-03
本文由“健康号”用户上传、授权发布,以上内容(含文字、图片、视频)不代表健康界立场。“健康号”系信息发布平台,仅提供信息存储服务,如有转载、侵权等任何问题,请联系健康界(jkh@hmkx.cn)处理。
相关知识
【论肿道麻】Nature Reviews Immunology:肿瘤免疫疗法的代谢屏障
【论肿道麻】靶向代谢改善肿瘤微环境的抗肿瘤免疫疗法
靶向代谢治疗,推动免疫治疗革命
体内稳态和肿瘤免疫中的T细胞代谢
小药综述:肿瘤代谢重编程与免疫应答
【论肿道麻】Nature Cell Biology: 肿瘤免疫微环境中的代谢通讯
mRNA疗法:肿瘤免疫治疗的新曙光?
STAT调控肿瘤脂质代谢
【论肿道麻】肿瘤脂肪酸代谢在治疗抵抗和肥胖中的作用
肿瘤化疗会导致免疫力下降吗
网址: 肿瘤代谢免疫治疗前沿 https://m.trfsz.com/newsview625854.html