科研丨Nature子刊(IF: 17.69): 母体通过肠道微生物代谢物调节新生儿胆道疾病
编译:微科盟听雪斋,编辑:微科盟居居、江舜尧。
微科盟原创微文,欢迎转发转载,转载须注明来源《微生态》公众号。
导读 新生儿微生物组的母体播种促进了持久的生物足迹,但其如何影响生命早期的疾病易感性仍然未知。本研究假设给怀孕小鼠喂食丁酸盐会影响新生儿对胆道闭锁的易感性,胆道闭锁是新生儿的一种严重胆道疾病。
在本研究中,我们发现给母鼠服用丁酸盐可使新生小鼠抵抗炎症和胆管损伤,并提高存活率。肝免疫细胞活化和存活特性的预防与拟杆菌和梭菌的粪便特征有关,并增加新生小鼠粪便代谢物中的谷氨酸/谷氨酰胺和次黄嘌呤。在患有胆道闭锁的人类新生儿中,这些细菌的粪便微生物组特征表现不足,谷氨酸/谷氨酰胺受到抑制,次黄嘌呤途径增加。直接给新生小鼠施用丁酸盐或谷氨酰胺可减轻疾病表型,但只有谷氨酰胺可使胆管上皮细胞对自然杀伤细胞的细胞毒性产生抗性。因此,母体摄入丁酸盐会影响新生小鼠的粪便微生物群和代谢物以及实验性胆道闭锁的表型表达,谷氨酰胺会促进胆管上皮细胞的存活。
论文ID
原名:Maternal regulation of biliary disease in neonates via gut microbial metabolites
译名:母体通过肠道微生物代谢物调节新生儿胆道疾病
期刊:Nature Communications
IF:17.694
发表时间:2022.1
通讯作者:Shao-tao Tang & Jorge A. Bezerra
通讯作者单位:美国辛辛那提大学医学院;美国辛辛那提儿童医院医疗中心
DOI号:10.1038/s41467-021-27689-4
实验设计
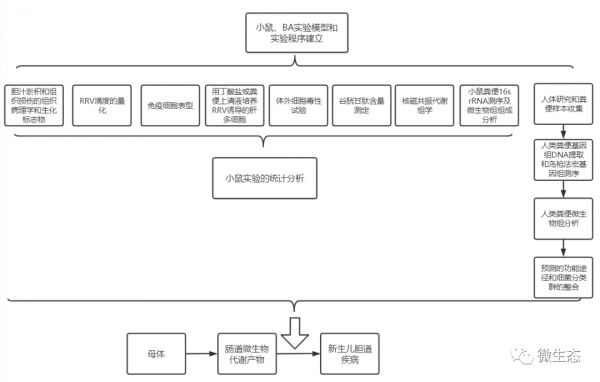
结果
1 母体摄入丁酸盐可保护新生儿免受胆管损伤
本研究给怀孕小鼠喂食丁酸盐并评估新生小鼠对病毒感染的结果。在整个妊娠期和分娩后的前4周,将丁酸盐添加到雌性BALB/c小鼠的饮用水中(200 mmol/L,pH调节至7.5);另一组仅接受饮用水作为对照(图1A)。在分娩后24 h内,我们给后代腹腔注射1.5 × 106荧光形成单位(ffu)的恒河猴轮状病毒(RRV)(或相似体积的磷酸盐缓冲盐水[PBS]来控制新生小鼠)。
在水喂养母亲的小鼠中,轮状病毒感染会导致进行性黄疸并在14天内导致80%的死亡率,剩下的20%代表在该小鼠模型中可以观察到的严重程度的微小变化。相比之下,丁酸盐喂养母亲的小鼠的临床进化分为一小群小鼠,它们具有相似的进行性黄疸和死亡率(40%的幼崽,称为“患病”)和仅表现出短暂性黄疸的第二个存活组(60%的幼鼠,称为“抗性”)。
该“抗性”组的幼鼠血清总胆红素(胆汁淤积的标志物)和丙氨酸氨基转移酶(ALT;肝损伤的标志物)水平低于有症状的同窝幼鼠和对照组(图1B-E)。与临床和生化改善相一致的是,丁酸盐喂养母亲的幼鼠肝外胆管(EHBD)是通畅的,肝脏炎症仅限于门静脉,而轮状病毒感染的对照组则有完全的胆管阻塞和广泛的肝损伤(图1F和图S1A-C)。在RRV感染后第7天,丁酸盐喂养母亲的小鼠的组织炎症和损伤减少与肝脏或胆管中的病毒滴度无关(图1G)。
为了控制丁酸盐诱导的肠道内容物酸化对疾病表型保护的潜在影响,我们根据用于丁酸盐的相同实验方案。我们发现妊娠期丙酸喂养不能保护新生小鼠免受RRV诱导的BA的影响,这可以通过黄疸的均匀发作和进展、到第14天100%的死亡率、高血清ALT和胆红素以及EHBD和门静脉完全阻塞来证明炎症(图S2A-F)。这些实验支持母体丁酸盐喂养在保护新生小鼠胆道损伤方面可能具有致病作用。
基于丁酸盐的免疫调节特性,我们通过流式细胞术分析在轮状病毒感染后7天(导管阻塞时间)对肝单个核细胞(MNCs)进行了量化,发现辅助T细胞(TH、CD3+CD4+)、细胞毒性T细胞(TC、CD3+CD8+)和NK (CD3–CD49b+)细胞显著减少,调节性T细胞(TREG、CD3+CD4+CD25+Foxp3+)和IL-10+ TREG细胞优先增加,但对巨噬细胞、中性粒细胞或树突状细胞(DCs)没有影响(图1H和图S3)。流式细胞仪分析的门控策略如图S10A-G所示。因此,母体摄入丁酸盐可抑制RRV感染新生儿中效应淋巴细胞的组织浸润,促进IL-10+ TREG细胞的活化,并阻止疾病表型的表达。为了确定丁酸盐是否直接促进了对RRV的抗病性和炎症反应的抑制,我们在感染后1天开始向RRV感染的新生小鼠口服丁酸盐(0.3 mg/g体重)(图2A),遵循先前公布的方案。
丁酸盐降低了黄疸的发生率,提高了存活率,并在不改变胆管和肝脏中病毒滴度的情况下防止了导管阻塞(图2B-E)。基于这些发现和丁酸盐的免疫调节特性,我们通过在0.1-0.25 mM丁酸盐存在下培养RRV感染的新生小鼠的肝MNC 3天来验证丁酸盐抑制效应淋巴细胞活化的假设。丁酸盐对MNC中Foxp3 mRNA表达只有适度的影响,并意外地降低了Il10 mRNA表达(图2F,G)。这些发现提出了一种可能性,即母体喂养丁酸盐对肝胆损伤的保护作用包括其他微生物组依赖性因素。
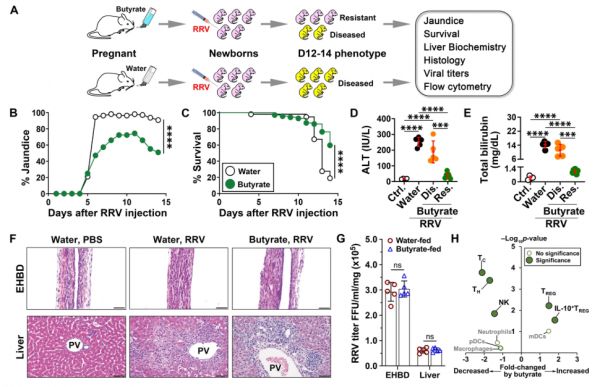
图1. 母体摄入丁酸盐可抑制子代肝脏和胆管损伤。
A示意图显示对轮状病毒(RRV)感染小鼠给药丁酸盐或水,然后评估胆道疾病。
B水或丁酸盐喂养母亲的RRV感染新生小鼠的黄疸(广义线性混合效应模型,双侧Wald检验,采用Bonferroni校正;****p < 0.0001)和C存活率(双侧对数秩检验;****p < 0.0001)(每组n = 67-74只小鼠)。来自水或丁酸盐喂养母亲的RRV或PBS(Ctrl,n = 4)后12–14天新生小鼠的血浆丙氨酸氨基转移酶(ALT,[D])和总胆红素(E)(n = 5)
F RRV或PBS后12-14天肝外胆管(EHBD)和肝脏切片( 水和丁酸盐=母体喂养;比例尺=100 μm;PV门静脉)。对每个组织样本进行H&E染色的15-30个EHBD和5-10个肝脏切片进行组织学分析。
G水和丁酸盐喂养母鼠的新生小鼠感染RRV后第7天EHBD和肝脏中的病毒滴度(平均值 ± SD,韦尔奇校正的双尾非配对Student’s t检验;每组n= 5个生物学上独立的EHBD或肝脏;ns = 不显著)。
H火山图显示RRV感染7天后,水和丁酸盐处理的母亲的新生小鼠之间的肝单个核细胞p值和倍数变化。使用生物学上不同的样本确定重复值,并使用双尾非配对Student’s t检验计算p值。流式细胞仪分析的门控策略如图S10A-K所示。
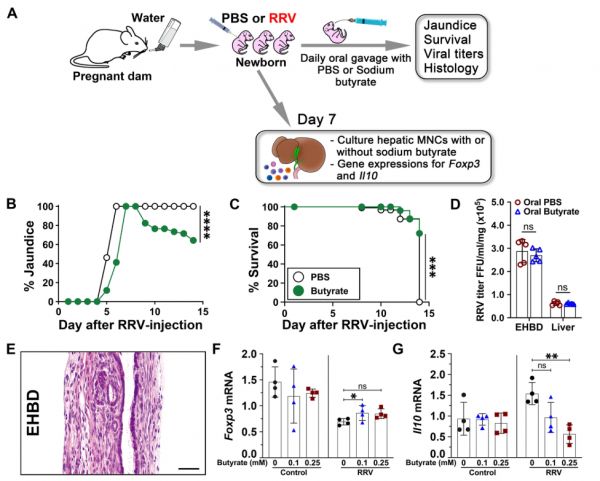
图2. 用丁酸盐治疗新生儿可减少肝胆损伤。
A丁酸钠灌胃RRV感染新生小鼠的示意图。
B每日用丁酸盐或PBS处理的RRV感染新生小鼠的黄疸(广义线性混合效应模型,双侧Wald检验,采用Bonferroni校正;****p < 0.0001)和C存活率(双侧对数秩检验;***p <0.001)。
D来自水喂养母亲的新生小鼠感染RRV后第7天EHBD和肝脏中的病毒滴度(平均值 ± SD,韦尔奇校正的双尾非配对t检验;每组n = 5;ns =不显著)以及E 在RRV感染14天后丁酸盐处理小鼠的EHBD切片中的病毒滴度。对每个组织样本15-30个经H&E染色的EHBD切片进行组织学分析。比例尺 = 50 μM。用或不用丁酸盐培养的RRV-naive或primed肝单个核细胞中的Foxp3(F)和Il10(G)mRNA,标准化为Gapdh(平均值 ± SD,Duncan多重比较的双尾方差分析,每组n = 3,* p < 0.05,**p < 0.01,ns = 不显著)。
2 抗病后代与丁酸盐喂养的母亲具有相似的微生物特征
为了研究丁酸盐是否能选择性富集与抑制组织损伤相关的肠道微生物群,我们分析了分娩时母亲以及病毒接种后12-14天感染RRV和未感染RRV的新生小鼠的粪便微生物群(图3A)。在水喂养对照组中,16s rRNA测序产生的操作分类单元(OTUs)的非度量多维标度(NMDS)分析表明,母亲的微生物组与RRV未感染后代的微生物组分离,并与患有胆道梗阻的感染新生小鼠不同(图3B,C)。
同样,在RRV感染后未出现胆道梗阻的丁酸盐组的微生物OTU(“抗性”亚组)与其丁酸盐喂养的母亲和RRV未感染的新生小鼠相似,但不同于发生疾病的小鼠亚组(“患病亚组”;图3D,E)。
与患病表型的小鼠相比,丁酸盐处理的怀孕小鼠与其抗病后代之间共享细菌特征的其他证据包括更多的共享OTUs(图3F和表S1)、厚壁菌门和拟杆菌门的优势富集,以及对RRV引起的胆道损伤具有抗性的小鼠中的变形菌门减少(图3G,H)。相应地,对在丁酸盐喂养的怀孕小鼠粪便样本中检测到的1315个OTUs进行分析,显示拟杆菌门和厚壁菌门占优势(表S2)。这些数据将丁酸盐喂养的母亲的微生物群与其对疾病表型具有独特抗性的后代联系起来。
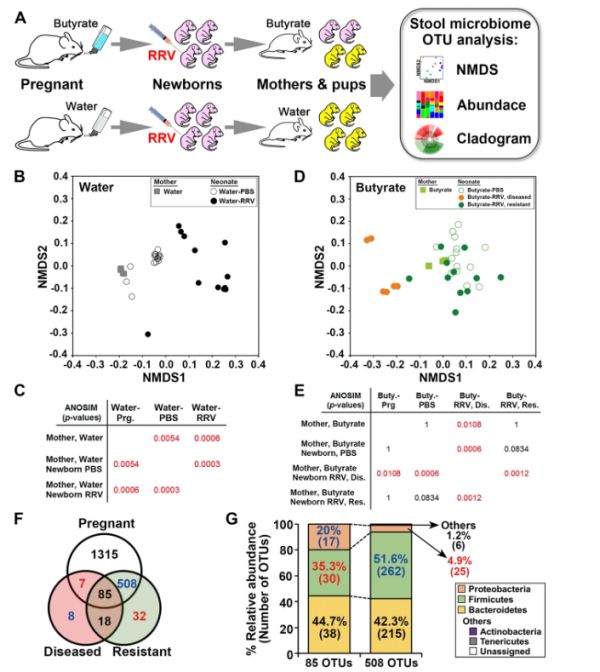
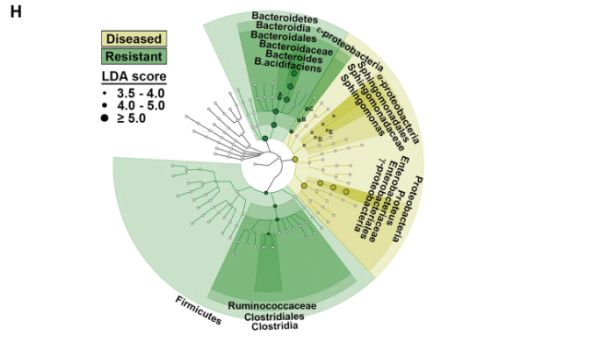
图3. 丁酸盐喂养的母亲和对疾病表型有抗性的后代之间共有的微生物特征。
A水和丁酸盐喂养的雌性RRV感染小鼠粪便微生物组分析的实验概述。注射RRV或PBS后12–14天,来自水(B,C)和丁酸盐喂养(D,E)的母亲和后代粪便样本的16s rRNA操作分类单元(OTU)的NMDS排序和相似性分析(ANOSIM)。
F Venn图描绘了丁酸盐处理的怀孕母鼠及其感染RRV且有(患病)或无(抗性)胆道梗阻的后代的OTU数量(Fisher精确检验和校正标准化残差的Z值,每组n = 6-11)。
G 85个OTU在丁酸盐喂养的母亲和患病及抗病后代之间共享,而508个OTU在丁酸盐喂养的母亲和抗病后代之间共享(卡方检验和校正标准化残差的Z值,每组n = 6-11)。
H Cladogram图显示,在来自丁酸盐喂养母亲的RRV感染新生小鼠中,患病和抗性表型之间的细菌类群丰度存在显著差异(LDA得分>3.5)(Kruskal-Wallis秩和检验,每组n = 6-11)。
3 小鼠粪便代谢物抑制免疫细胞活化
为了寻找微生物组抑制疾病表型的潜在机制,我们过滤水喂养或丁酸盐喂养母鼠的新生小鼠的粪便上清液,并将上清液与来自RRV感染新生小鼠的肝脏MNCs一起培养(图4A)。丁酸盐组的粪便上清液显著增加了MNC中Il10和Foxp3 mRNA的表达,并降低了Tnfa的表达(图4B-D),表明粪便衍生分子抑制了促炎回路。为了鉴定这些分子,我们通过基于质子核磁共振谱(1H-NMR)的代谢组学分析了来自水或丁酸盐喂养母亲的新生小鼠的粪便上清液,这些代谢组学可定量56种化合物。代谢产物的NMDS分析将丁酸盐组与非丁酸盐组区分开来(图4E),丁酸盐喂养母鼠的幼鼠粪便上清液中氨基酸、酮体、短链脂肪酸和柠檬酸循环的代谢中间产物显著增加(图4F和图S4A、B)。
在两组之间存在显著差异的37种代谢物中,丁酸盐组的粪便上清中次黄嘌呤和谷氨酸的丰度增加最大,其相关分子肌苷和谷氨酰胺的变化幅度较小(图4G),从而提高了它们在抑制新生小鼠免疫介导的胆管损伤中的潜在效应作用。为了研究代谢物与粪便微生物种群之间的关系,我们分析了来自“患病”和“抗性”亚组的粪便微生物组的16s rRNA测序数据,使用PICRUSt量化宿主基因家族、使用MetaCyc分析通路,并使用ALDEx2来测试差异丰度。我们在“抗性”小鼠亚组中发现了谷氨酸/谷氨酰胺、次黄嘌呤/肌苷和丁酸途径的富集(图S5)。丁酸途径由产丁酸的厚壁菌(厚壁菌门、梭菌门、梭菌目和瘤胃球菌科)和拟杆菌(拟杆菌门、拟杆菌纲、拟杆菌目、拟杆菌科、拟杆菌属)分类群代表(图S6)。这些途径共有的细菌基因与丁酸合成的乙酰辅酶A和赖氨酸途径的分子有关(表S3)。
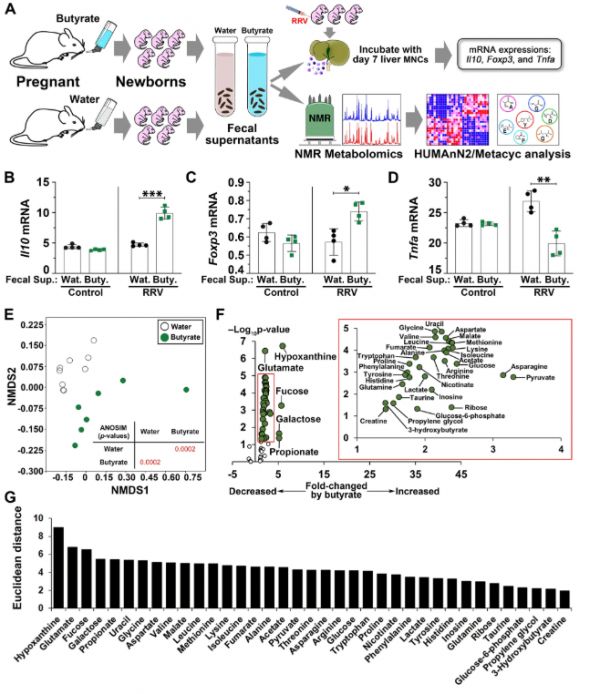
图4. A体外粪便上清液-免疫细胞培养和粪便代谢物分析示意图。
在水或丁酸盐喂养母亲的新生小鼠粪便上清液中培养的RRV诱导的肝MNC中,Il10(B)、Foxp3(C)和Tnfa(D)的mRNA表达与Gapdh的比率(平均值 ± SD,双尾非配对t检验,每组n = 4,*P < 0.05,**p < 0.01,***p < 0.001)。
E 14日龄水或丁酸盐喂养母亲的新生小鼠粪便上清液中代谢物的NMDS和ANOSIM分析。
F火山图显示了水和丁酸盐喂养母亲的新生小鼠之间具有p值和倍数变化的粪便代谢物。使用生物学上不同的样本确定重复值,并使用双尾非配对t检验计算p值。G根据火山图测得的欧几里德距离排序的粪便代谢物。
4 人类新生儿粪便宏基因组测序中的代谢途径富集
为了探索新生小鼠的微生物和代谢特征与人类婴儿肝胆损伤潜在机制的相关性,我们对102名确诊为BA的婴儿和28名正常对照(NC)的粪便样本进行了鸟枪宏基因组测序(图5A和图S7A)。
从总体微生物群落组成来看,BA组与对照组在观察到的物种数量或Shannon多样性或分离度上均无差异(图S7B-E)。Shannon指数和NMD之间差异不大可能与幼儿肠道微生物组固有的低多样性有关。通过回归分析检查细菌种群,发现BA中Proteobacteria、Bacilli (Lactobacillus spp.)、Fusobacteria和其他病原体(如链球菌、克雷伯氏菌和肠球菌)的丰度更高,而NCs中Bacteroidetes和Clostridia显著富集(图5B和图S7F,G),类似于在丁酸盐喂养母亲的抗病新生小鼠中观察到的富集。
为了确定这种微生物特征如何潜在地转化为功能差异,我们使用HUMAnN2汇总了UniRef90基因家族到MetaCyc通路的人类微生物图谱的序列reads,并使用ALDEx2测试差异丰度。根据校正后的p<0.05确定的14条途径中,有7条与谷氨酸/谷氨酰胺和丁酸盐分子相关,PWY-4984(尿素循环)和CITRULBIO-PWY(L-瓜氨酸生物合成)与NCs分离的效应大小最高(图5C和表S4)。
在NCs中富集的7个物种中(图S7G),当使用BioCyc数据库进行分析时,Flavonifractor plautii、Hungatella hathewayi、Clostridium neonatale、Bacteroides dorei和Bacteroides fragilis(图S7H)显示参与丁酸生产的酶和基因的过表达(表S5)。与来自丁酸盐喂养母亲的RRV-naive小鼠粪便中的高浓度次黄嘌呤相反,次黄嘌呤(在PWY0-1297嘌呤降解超途径中)在BA婴儿的粪便中富集,从而提高了谷氨酸/谷氨酰胺和次黄嘌呤在疾病表型确定中发挥不同作用的可能性。
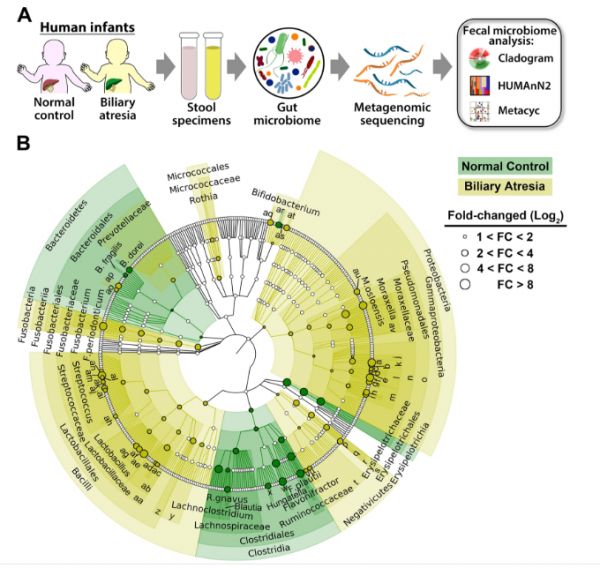
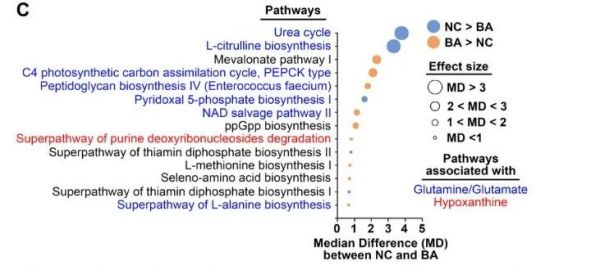
图5. A胆道闭锁婴儿和健康对照的粪便微生物组分析示意图概述。B Cladogram图显示胆道闭锁婴儿(n = 102)和年龄匹配的对照(n=28)之间的的细菌类群丰度存在显著差异(校正后的p值<0.05)。C胆道闭锁微生物群落和对照组显著调节的功能通路,由HUMAnN2根据Metayc通路计算(校正后的p值<0.05)。
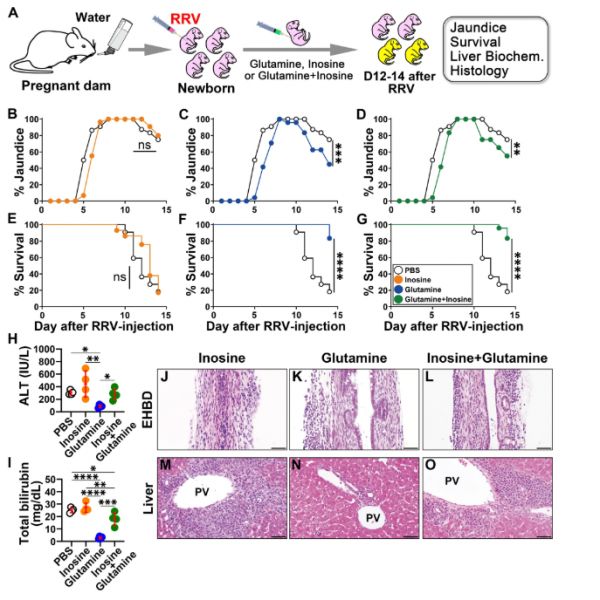
图6. 谷氨酰胺抑制实验性胆道闭锁的梗阻表型并提高存活率。
A用肌苷和/或谷氨酰胺治疗RRV感染的新生小鼠的实验设计。
B-D注射PBS或感染RRV的新生小鼠腹腔注射肌苷、谷氨酰胺和肌苷+ 谷氨酰胺后的黄疸发生率 (每组n = 22-29;广义线性混合效应模型,双侧Wald检验,Bonferroni校正**P < 0.01,***p < 0.001,ns = 不显著)。在出生后的前2周,与接受PBS(对照)的新生小鼠相比,接受肌苷(E)、谷氨酰胺(F)和肌苷+ 谷氨酰胺(G)治疗的新生小鼠的存活率 (每组n = 22-29;双侧对数秩检验,****p < 0.0001,ns = 不显著)。注射磷酸盐缓冲盐水(PBS;Ctrl,n)或RRV感染和肌苷(n=4)、谷氨酰胺(n=4)和肌苷+谷氨酰胺(n=4)每日治疗12-14天后的血浆丙氨酸氨基转移酶(ALT,[H])和总胆红素水平(I )(平均值± SD,Duncan多重比较双尾方差分析*P < 0.05,**p < 0.01,***p < 0.001,****p < 0.0001)。RRV后12-14天和注射RRV后肌苷、谷氨酰胺和肌苷+谷氨酰胺每日治疗后12-14天新生小鼠肝外胆管(EHBD)和肝脏切片(J-O)的苏木精-伊红染色切片。对每个组织样本经H&E染色的15-30个EHBD和5-10个肝脏切片进行组织学分析。
5 谷氨酰胺可预防胆道损伤并促进上皮细胞存活
为了直接研究谷氨酸/谷氨酰胺和次黄嘌呤/肌苷在疾病机制中的生物学作用,我们从接种RRV后一天开始,每隔一天对来自水喂养母亲的新生小鼠腹腔注射谷氨酰胺(0.25 mg/g体重)、肌苷(一种由核糖环和次黄嘌呤组成的核苷,0.2 mg/g体重)、谷氨酰胺+肌苷或PBS(图6A)。选择谷氨酰胺的理由是基于其在BA患儿中的水平较低,它是一种条件必需氨基酸,影响细胞内生物能量利用,它通过谷胱甘肽(GSH)支持细胞内氧化还原稳态;相反,谷氨酸(带负电荷)发挥肝外生物学效应,如神经传递。
由于次黄嘌呤的水溶性差和潜在毒性,我们使用肌苷(一种天然存在的嘌呤和次黄嘌呤的前体),具有更好的安全性和免疫调节特性。肌苷给药并没有改变感染RRV的新生小鼠的黄疸发展或存活率差的情况;相比之下,单独使用谷氨酰胺可显著降低黄疸,提高存活率至83.3%(图6B-G),并抑制组织损伤(图6H-O),T细胞、NK细胞、DCs、中性粒细胞和巨噬细胞数量较少,IL-10+TREG细胞数量增加(图7A、B和图S8)。从用谷氨酰胺处理的RRV感染小鼠中分离出的肝NK细胞的功能评估显示,其体外溶解胆管细胞的能力降低(胆管上皮细胞;图7C)。
为了研究谷氨酰胺如何调节NK细胞溶解胆管细胞的能力,我们首先使用NK细胞-胆管细胞共培养试验来评估白细胞介素(IL)-10是否对细胞溶解有保护作用。在RRV诱导的肝NK细胞和胆管细胞的培养基中添加IL-10(30 ng/ml)并不能阻止胆管细胞溶解(图7D)。为了研究谷氨酰胺抑制NK细胞裂解的机制,我们用谷氨酰胺进行了试验,发现8-16 mM谷氨酰胺阻断了胆管细胞溶解(图7E)。为了精确识别谷氨酰胺的细胞靶点,我们在细胞裂解试验之前分别用谷氨酰胺孵育RRV诱导的肝NK细胞或胆管细胞。虽然用谷氨酰胺预孵育NK细胞不会抑制细胞溶解(图7F),但用谷氨酰胺预孵育胆管细胞会使细胞对NK细胞诱导的溶解产生抗性(图7F)。 基于谷氨酸/谷氨酰胺调节细胞内氧化平衡的能力,我们测量了用谷氨酰胺培养的胆管细胞中的GSH,发现在所有浓度下GSH都显著增加(图7G)。
为了检测GSH的富集是否会独立地阻止胆管细胞溶解,我们将N-乙酰半胱氨酸(NAC)添加到共培养试验中,并观察到几乎完全阻止胆管细胞溶解(图7H)。为了测试GSH丰度与谷氨酰胺在体内的保护作用的相关性,我们将RRV接种到新的新生小鼠组中,并使用图6A所示的实验策略和方案将其分配给谷氨酰胺或生理盐水处理。虽然RRV感染显著降低了肝脏和EHBD中GSH的浓度,但谷氨酰胺的施用增加了两种组织中的GSH水平,并接近未感染对照组的水平(图7I,J)。总之,这些数据确定了谷氨酰胺通过GSH富集促进胆管细胞对抗病毒激活的NK细胞存活的独特保护作用。
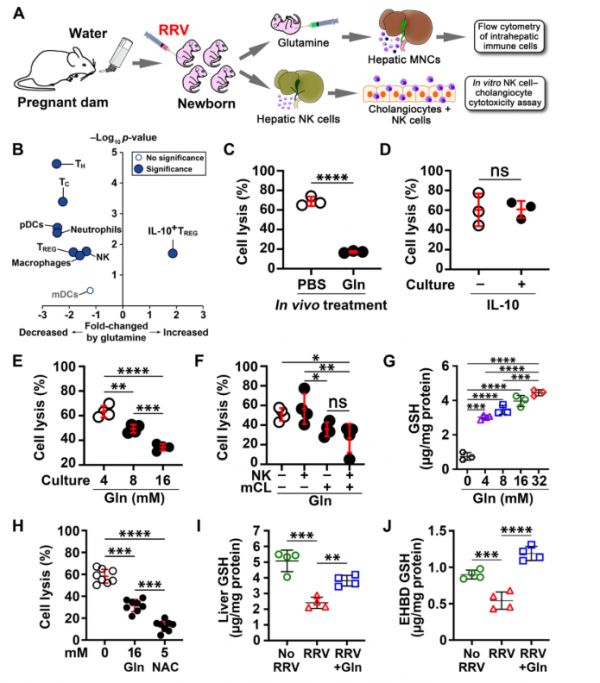
图7. A肝单个核细胞流式细胞术和体外NK细胞介导的胆管毒性试验的图示。
B火山图注射了磷酸盐缓冲盐水(PBS)和谷氨酰胺的新生小鼠之间在注射RRV 7天后的肝免疫细胞的p值和倍数变化。使用生物学上不同的样本确定重复值,并使用双尾非配对t检验计算p值。流式细胞术分析的门控策略如图S10A-K。
C在30 ng/ml IL-10存在(n=3)或不存在(n=3)的情况下,与来自PBS(n = 3)或谷氨酰胺(n = 3)注射的新生小鼠的RRV诱导的肝NK细胞和小鼠胆管细胞系或D共培养后胆管细胞溶解百分比(平均值 ± SD,双尾非配对t检验,****p < 0.0001,ns = 不显著)。
E 用RRV诱导的NK细胞与增加浓度的谷氨酰胺共培养(每组n = 4),或当单个细胞类型与谷氨酰胺预孵育时,测定胆管细胞溶解(每组n = 4;平均值 ± SD,Duncan多重比较双尾方差分析,*p < 0.05,**p < 0.01,***p < 0.001,****p < 0.0001,ns = 不显著)。
G 显示与不同浓度的谷氨酰胺培养后在胆管细胞中测量的总GSH水平(每组n = 3-4;平均值 ± SD,Duncan多重比较双尾方差分析***p < 0.001,****p < 0.0001)。
H 在谷氨酰胺(n=8;2个技术重复和4个生物学重复)和N-乙酰半胱氨酸(NAC)(n=8,2个技术重复和4个生物学重复;平均值 ± SD,Duncan多重比较双尾方差分析***p< 0.001,****p < 0.0001)存在下,NK细胞介导的胆管细胞溶解。I 对照组和RRV感染的新生小鼠经谷氨酰胺治疗或未经谷氨酰胺治疗后肝脏(每组4个生物重复)和 J 肝外胆管(每组4个生物重复)上清液中测量的GSH总水平(平均值 ± SD,Duncan多重比较双尾方差分析,**p < 0.01,***p < 0.001,****p < 0.0001)。
讨论
妊娠期丁酸喂养对抑制新生儿胆管损伤的有益影响强调了母亲因素与出生后早期疾病易感性的相关性。在实验性BA(产前发病和多因素发病的严重疾病原型)中,在怀孕小鼠的饮用水中简单添加短链脂肪酸(丁酸)可使新生小鼠抵抗组织损伤和胆管阻塞表型。通过寻找导致表型改善的生物过程,我们在丁酸盐喂养的母亲和对实验性BA有抗性的新生儿中发现了相似的粪便微生物群特征,以及来自丁酸盐喂养母亲的新生儿肠道内容物中谷氨酸/谷氨酰胺和次黄嘌呤/肌苷代谢物的富集。给RRV感染的幼鼠服用谷氨酰胺并将其添加到培养的胆管细胞中,可抑制炎症,提高组织中GSH水平,并保护上皮细胞免受活化的肝NK细胞的细胞溶解特性的影响。将丁酸盐直接施用于新生儿显示出其抑制淋巴细胞活化、增加IL-10+TREG细胞和防止胆道损伤的能力,而与微生物组变化无关。
然而,其在体外无法抑制活化的肝脏MNCs或诱导Il10 mRNA的表达,这表明存在其他阻止肝脏和胆管损伤的因 素。 与已证实的丁酸盐在厌氧环境中促进微生物种群差异生长的影响一致,对组织损伤有抵抗力的新生小鼠的粪便中存在大量厚壁菌和拟杆菌(类似于丁酸盐喂养的母亲的粪便微生物特征),这一特征也存在于健康人类婴儿的粪便中。
值得注意的是,结肠中约85%的总丁酸生产能力由厚壁菌门(包括毛螺菌科和瘤胃球菌科)代表,而在较小程度上由拟杆菌门谱系代表。这种微生物特征的保护作用的初步线索来自其在RRV感染的患有BA的新生小鼠和患有该疾病的人类婴儿的粪便中的代表性不足,其中Proteobacteria、Bacilli(乳杆菌属)、Fusobacteria和其他机会致病菌(如链球菌、克雷伯氏菌和肠球菌)的富集更为显著。微生物种群相关性的一个更强有力的线索是,丁酸盐喂养的母亲所生的新生小鼠粪便代谢物中谷氨酸和谷氨酰胺的增加,以及谷氨酰胺给药在很大程度上阻止了新生小鼠实验性BA的发展。
从机制上讲,谷氨酰胺对活化的肝NK淋巴细胞的细胞溶解特性显示出胆管上皮的主要细胞保护作用。这与先前报道的NK细胞在胆管上皮损伤中的作用一致,抗体介导的NK细胞丢失可防止新生小鼠在RRV感染后发生上皮损伤和胆管阻塞。然而,在本研究中,谷氨酰胺似乎主要有益于胆管上皮,正如预孵育实验所表明的那样,在预孵育实验中,用谷氨酰胺培养胆管细胞使这些细胞抵抗活化的肝NK细胞的细胞溶解特性。为了探索谷氨酰胺促进胆管细胞存活的潜在机制,我们发现谷氨酰胺丰富了RRV感染幼鼠肝脏和胆管中GSH的细胞内含量,以及在补充谷氨酰胺的培养基中培养的胆管细胞中GSH的含量,并促进NAC存在下培养的胆管细胞的细胞保护。
NAC的保护作用与先前的一项研究一致,该研究报告了BA患儿中GSH相关基因表达降低和不良预后,以及在纤维化胆管病变模型中用NAC治疗的新生小鼠的预后改善。这些数据表明谷氨酰胺和谷胱甘肽在促进上皮细胞存活方面具有重要的特性。 母体丁酸盐 → 新生儿肠道Clostridiales和Bacteroidetes以及谷氨酸/谷氨酰胺合成富集 → 防止组织损伤的定向链接对于理解生命早期表现出的疾病的致病机制具有重要意义。本研究没有控制胆汁淤积对新生儿微生物组成的影响及其对疾病结局的影响。在人类中,这可以通过纳入一组年龄匹配的患有其他类型胆汁淤积综合征的人类婴儿来实现。在实验上,这可以通过胆管结扎来实现,但由于无法在1-2天大的老鼠身上进行这类手术,因此该模型并不特别适合。
在人类BA中,已在患有该疾病的不同队列中检测到几种病毒(如轮状病毒、巨细胞病毒、呼肠孤病毒),但缺乏流行病学重现性或疾病发病机制中直接因果关系的实验证据表明,其他因素可能导致组织损伤和疾病的完整表型表达。丁酸盐或其他代谢物通过母乳的垂直传播可能有助于后代的疾病保护。虽然我们没有测量哺乳期小鼠的代谢物,但在母乳中发现了高达750 µM的丁酸浓度,可能调节耐受性细胞因子的表达、TREG细胞群和抗IL-1β活性。此外,谷氨酸和谷氨酰胺是母乳中丰富的游离氨基酸,在哺乳1-6个月期间,谷氨酰胺浓度增加约350%。
本研究发现,新生儿发育中的微生物群是母亲影响下的因素之一,可调节出生后生命早期的疾病易感性。微生物组作为代谢物的来源,可以抑制免疫细胞(丁酸和谷氨酰胺)并促进上皮细胞中的生存信号(谷氨酰胺),从而间接保护肝脏和胆管免受病毒诱导的组织损伤。这些数据提高了丁酸盐和/或谷氨酰胺在BA或其他儿童肝胆疾病中调节免疫反应和帮助组织修复的潜力。除了我们发现的疾病特异性影响外,母亲和新生小鼠之间微生物特征的相似性以及它们在怀孕期间饮食改变后的变化强调了母亲对可能调节新生儿临床表型表现的关键生物学过程的影响。
本文由“健康号”用户上传、授权发布,以上内容(含文字、图片、视频)不代表健康界立场。“健康号”系信息发布平台,仅提供信息存储服务,如有转载、侵权等任何问题,请联系健康界(jkh@hmkx.cn)处理。
相关知识
顶刊综述丨NAT REV MICROBIOL (IF:78): 胆汁酸和肠道微生物群: 代谢相互作用和对疾病的影响
Nature子刊:喝咖啡会改变你的肠道细菌,从而影响代谢
顶刊综述丨NAT MED(IF:82): 心脏代谢健康、饮食和肠道微生物组: 宏组学视角
爱幼妈妈:肠道微生物与婴幼儿健康研究进展
肠道微生物群对胆汁酸代谢和信号传导影响的最新研究成果
科研丨Microbiome(IF:16.8): 肠道微生物群在膳食纤维生理效应中的作用
肠道3M:微生物组、代谢和代谢组,从基础走向未来
肠道微生物群、营养与长期疾病风险:母婴视角
Protein & Cell:肠道菌群及其代谢物在代谢性疾病中的作用
微生物代谢调控肠道及中枢神经系统炎症
网址: 科研丨Nature子刊(IF: 17.69): 母体通过肠道微生物代谢物调节新生儿胆道疾病 https://m.trfsz.com/newsview635690.html