深度解析:欧盟MDR及IVDR法规过渡期延长正式落地!
2023年3月20日,欧盟在欧盟官方杂志OJEU上公布‘2023年3月15日第 (EU) 2023/607号条例修订第 (EU) 2017/745号和(EU) 2017/746号条例的过渡条款’,该法规自公布之日生效,标志着MDR和IVDR的延期正式落地!

该法规引入了关于医疗器械 (MDR) 法规 (EU) 2017/745 中规定的过渡期的交错延长,但须满足某些条件。其中该法规最重要的内容,是在符合特定条件下,延长了MDD CE证书的有效期:III类定制的可植入装置到2026年5月26日,III类器械和IIb类植入式到2027年12月31日,IIb类非植入式以及植入式的,例如缝线,吻合器,牙冠等器械,IIa器械,I类器械,到2028年12月31日。
关于体外诊断器械(IVDR)法规 (EU) 2017/746中取消了原来交错延长的时间节点,变化为可持续在市。
法规(EU) 2017/745变化核心内容提炼:
1.满足延迟需符合的特定条件为:
(a)器械继续符合指令90/385/EEC或指今93/42/EEC(如适用);
(b)器械设计和预期用途无重大变化;
(c)器械不会对患者、用户或其他人员的健康或安全、对保护公共健康的其他方面造成不可接受的风险;
(d)2024年5月26日之前,制造商已建立起质量管理体系;
(e)2024年5月26日之前,制造商或授权代表已根据附录VII第4.3节第一分段规定,向公告机构提交本条第3a或3b段所述器械或替代器械的合格评定正式申请,并且不迟于2024年9月26日,公告机构和制造商已根据附录VI第4.3节第二分段签署书面协议。
2.法规(EU) 2017/745修订如下:
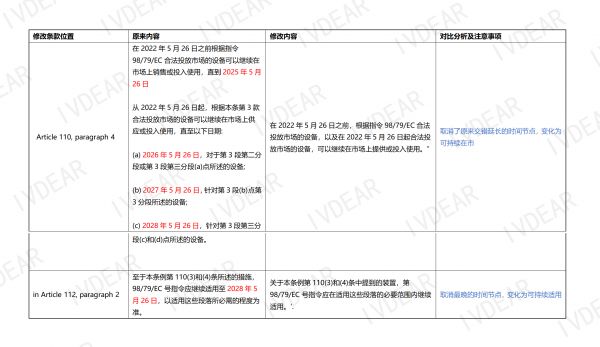
 法规(EU) 2017/746变化核心内容提炼如下:
法规(EU) 2017/746变化核心内容提炼如下:
本文由“健康号”用户上传、授权发布,以上内容(含文字、图片、视频)不代表健康界立场。“健康号”系信息发布平台,仅提供信息存储服务,如有转载、侵权等任何问题,请联系健康界(jkh@hmkx.cn)处理。
相关知识
超声波治疗仪的频率和功率如何影响治疗效果?
《欧盟注册那些事》第六集:MDR认证路径选择技巧
融资租赁监管新规重磅落地:7大指标5项禁止,过渡期延长至不超过3年
欧盟膳食营养补充剂市场及监管制度研究
反弹!疫情下欧盟各国防控措施又有新变化!近期出口欧洲风险分析
拟延期6个月,完整版安评设置过渡期
资管新规过渡期延长一年,极少数银行最终可能“个案处理”?
过渡期护理模式在冠心病病人出院过渡期中的应用效果
欧盟有机认证简介
「欧洲移民」欧盟健康保险详解
网址: 深度解析:欧盟MDR及IVDR法规过渡期延长正式落地! https://m.trfsz.com/newsview790641.html
