营养与健康所陈雁研究组发现饥饿诱导酮体生成的新型调控机制
营养与健康所陈雁研究组发现饥饿诱导酮体生成的新型调控机制
2021年8月30日,国际学术期刊Molecular Metabolism在线发表了中国科学院上海营养与健康研究所陈雁研究组的文章” PAQR9 regulates hepatic ketogenesis and fatty acid oxidation during fasting by modulating protein stability of PPARα”。 该研究首次发现内质网蛋白PAQR9能通过调节肝脏细胞的转录因子PPARα的稳定性,参与饥饿诱导肝脏酮体生成和脂肪酸氧化。
饥饿和进食的交替是生命最根本的生理过程,其中可发生大量的代谢状态变化。肝脏是体内重要的代谢器官,在饥饿的过程中会响应营养缺乏信号,进行脂肪酸氧化和酮体生成,为机体提供能量。这一过程会受到转录因子的调控,其中PPARα是一个核心的转录因子,PPARα基因缺失会导致饥饿过程中脂肪酸氧化降低。陈雁研究组前期的研究已发现PPARα会通过E3泛素连接酶HUWE1的泛素化修饰介导蛋白酶体途径降解(Hepatology 2018, 68(1):289-303)。
陈雁研究组博士研究生林毅君等人通过大数据分析和动物实验发现,在饥饿状态下的肝脏中,PAQR9是下调最显著的基因之一,并鉴定出饥饿-进食过程中PAQR9的表达受到PPARγ的直接调控。通过对PAQR9基因敲除小鼠进行一系列代谢表征研究,发现敲除PAQR9不影响小鼠正常进食情况下的代谢状态,但是会显著降低小鼠饥饿情况下肝脏的酮体生成和脂肪酸氧化能力。分子机制研究发现,敲除小鼠肝脏中的PPARα,转录水平不会受到影响,但是蛋白含量会显著下降。细胞实验证实PAQR9能够降低PPARα泛素化导致的降解。进一步研究PAQR9对PPARα泛素化水平的调控机制,发现PAQR9能够和介导PPARα降解的HUWE1竞争性结合以保护PPARα不被降解。体外HUWE1敲除和体内PPARα激动剂回补实验都充分验证了PAQR9竞争性结合HUWE1保护PPARα蛋白稳定性模型的可靠性。综上所述,该研究揭示了内质网蛋白PAQR9能够通过泛素化调控转录因子PPARα的活性,揭示了一个新的肝脏脂代谢调控机制。
中国科学院上海营养与健康研究所陈雁研究员为该论文的通讯作者,博士研究生林毅君为该论文的第一作者。该项工作得到了国家自然科学基金委和科技部的资助,也得到了中国科学院上海营养与健康研究所公共技术平台和动物平台的支持。
文章链接:https://doi.org/10.1016/j.molmet.2021.101331
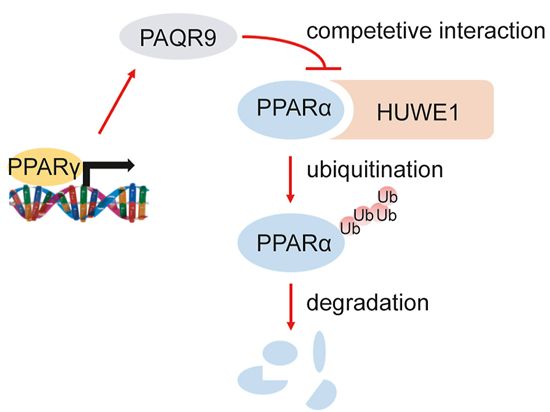
图:PAQR9竞争性结合HUWE1以保护PPARα蛋白稳定性
相关知识
营养与健康所陈雁研究组发现肠道MCT1在介导乳酸转运和调控代谢稳态中的性别差异
上海营养与健康研究所合作发现调控肝癌代谢重编程的新机制
营养与健康所合作发现调控肝癌代谢重编程新机制
营养与健康所王莹研究组发现脂肪酸代谢调控毛囊干细胞微环境形成的新机制
我学者揭示肝癌酮体代谢调控新机制
加州大学团队发现调控酮代谢新机制,并证明该机制能结合饮食疗法抗癌
Nature子刊:朱正江团队发现蛋白激酶RIPK1对饥饿应激的代谢调控机制
陈雁研究组揭秘间歇性节食和持续性节食对于控制糖尿病孰优孰劣
营养与健康所等发现衰老细胞代谢调控关键机制
植物逆境中心朱健康研究组发现ABA代谢调控的新机制
网址: 营养与健康所陈雁研究组发现饥饿诱导酮体生成的新型调控机制 https://m.trfsz.com/newsview803391.html