肿瘤代谢全景介绍
前言
一个世纪前,德国生物化学家Warburg首次描述了肿瘤发生与代谢失调之间的联系。为了在营养供应有限、代谢废物堆积的肿瘤微环境(TME)中竞争生长的空间,狡猾的肿瘤细胞会发生许多代谢适应性转变,倾向于产生更多的生物量,从而促进其增殖。其代谢产物不仅作为物质能量产生的基础,还能调节基因和蛋白质的表达,进而与周围环境中的细胞产生代谢串扰,影响非转化细胞的行为。随着肿瘤的生长和转移,甚至整个机体的营养分布和代谢受到影响。近期发表在《Cell Metabolism》上的综述为我们带来了肿瘤代谢方面的新发现。
葡萄糖和氨基酸的摄取失调 葡萄糖 是哺乳动物细胞消耗的主要碳源,在正常细胞中,葡萄糖摄取通过生长因子和位置信号调节[1],而肿瘤细胞通常表现出从细胞外环境吸收葡萄糖的能力增强。一方面,癌症病人RTK编码基因如EGF受体 (EGFR) 、erb-b2受体 (ERBB2) 和c-Met的基因组扩增;PI3K及其负调控因子PTEN和INPP4B的突变使得细胞能自主摄取足量的葡萄糖,从而保持生长和增殖[2]。另一方面,肿瘤细胞获得侵袭性表型,以维持细胞运动所需的肌动蛋白重塑[3]。反过来,细胞外基质 (ECM) 成分——透明质酸可增加葡萄糖摄取和糖酵解,从而促进ATP产生来促进癌细胞侵袭[4]。此外,降低的细胞密度本身可以提高GLUT1转运蛋白的表达,增加葡萄糖的吸收和利用[5]。
肿瘤细胞向合成代谢转变。第一,糖酵解中间体葡萄糖-6-磷酸可以转移到磷酸戊糖途径(PPP),用来合成核苷酸。第二,下游的糖酵解中间体也可作为合成代谢前体。比如果糖-6-磷酸,是葡萄糖氨基聚糖合成的基石。第三,3-磷酸甘油酸可通过磷酸甘油酸脱氢酶(PHGDH)催化反应合成丝氨酸 (图1)。
除了葡萄糖,肿瘤细胞也增加对谷氨酰胺的摄取。肿瘤增殖会刺激血浆谷氨酰胺转运体ASCT2/SLC1A5和SN2/SLC38A5的上调,谷氨酰胺也可以在线粒体中被谷氨酰胺酶1 (GLS1)分解,这些转运体和酶都被c-myc正调控[6]。谷氨酰胺除了参与蛋白质合成外,还在细胞中发挥多种合成代谢作用(图1)。
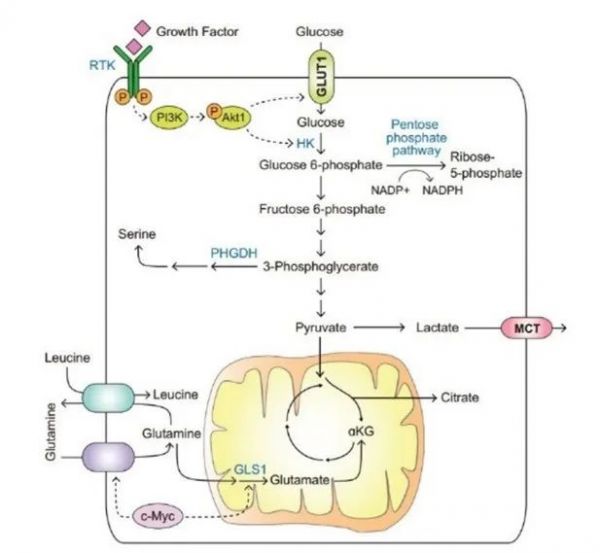
图1:葡萄糖和氨基酸的摄取失调
利用中心碳代谢和多种方式获得营养中心碳代谢 (CCM) 包括糖酵解途径 (EMP) 、磷酸戊糖途径 (PPP) 以及三羧酸循环 (TCA) 。传统上,TCA循环被认为是一个分解代谢过程,由于葡萄糖摄取和丙酮酸生产的增加,产生了部分碳盈余,允许TCA循环中间产物离开中心碳代谢,参与各种生物合成反应。
在参与合成代谢的细胞中,TCA循环中间产物柠檬酸从线粒体中输出到细胞质,合成脂肪酸和胆固醇。脂肪生成是一个高度消耗NADPH的过程。为了满足NADPH的供应,草酰乙酸可以转化为苹果酸重新进入线粒体,或被苹果酸酶1 (ME1)催化为丙酮酸,产生NADPH。另外,胞质中的柠檬酸转化为异柠檬酸,然后通过异柠檬酸脱氢酶(IDH1)转化为α-酮戊二酸,也可以产生NADPH。
另一种用来转移一部分TCA碳免于完全氧化的中间产物是α-酮戊二酸,它可以产生谷氨酸,作为其他几种非必需氨基酸的前体。另外,产生一个分子的脯氨酸还会消耗ATP、NADH和NADPH,进一步抑制线粒体电子负载[7](图2)。
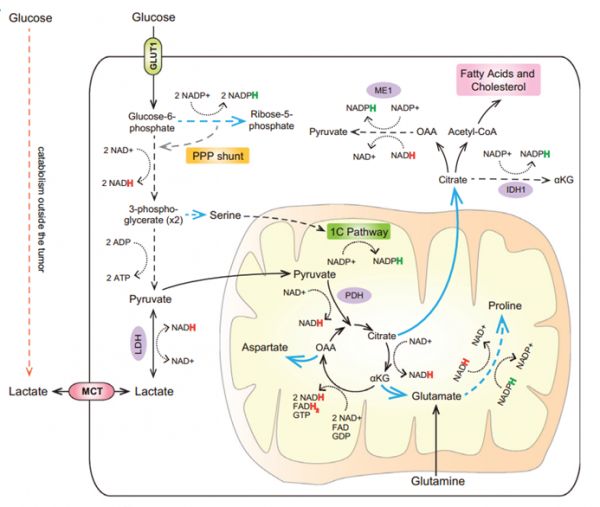
图2:利用中心碳代谢参与生物合成
除了主要的低分子量营养(即葡萄糖和氨基酸),肿瘤细胞还能够利用广泛的替代营养源。一是通过“巨胞饮”(macropinocytosis)作用捕获细胞外蛋白质以恢复氨基酸[8]。二是通过受体介导的内吞作用摄取不溶性营养素,如铁和胆固醇[9]。三是利用死亡、坏死细胞碎片获取营养[10](图3)。
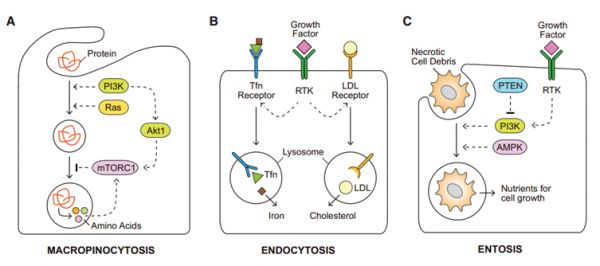
图3:多种方式获取营养
对电子受体、抗氧化和氮的高需求 增殖中的癌细胞对电子受体的再生有着持续的高需求,以产生蛋白质和核酸生物合成的前体。糖酵解和TCA循环都需要 NAD+作为电子受体 。肿瘤细胞具有独特的Warburg效应[11],糖酵解活性增强,依赖于乳酸脱氢酶 (LDH) 从NADH中不断再生NAD+。因此,乳酸分泌是肿瘤细胞的显著特征[12]。胞质电子也能以NADH的形式通过苹果酸-天冬氨酸穿梭和甘油-磷酸穿梭运送到线粒体,以促进ETC中NAD+的再生 (图4) 。最近,新鉴定出线粒体NAD+转运体MCART1 (由SLC25A51编码) ,也可以在胞质和线粒体间传递NAD+[13,14]。
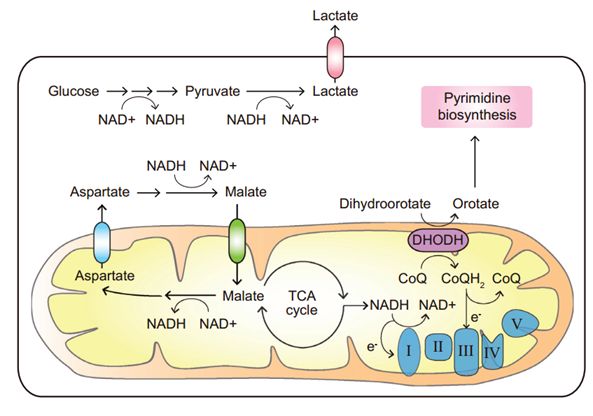
图4:肿瘤对电子受体的高需求
上调的合成代谢加上TME的限制,使肿瘤细胞面临 更高水平的氧化应激压力 。因此,肿瘤细胞依靠多种抗氧化防御机制,如谷胱甘肽 (GSH) 系统和硫氧还蛋白 (TRX) 系统,保护自身免受此类氧化损伤。所以促进这些保护机制的遗传和代谢改变经常在肿瘤中发现。另外,肿瘤细胞也通过改变其代谢来应对氧化应激,以维持活性氧 (ROS) 清除分子的抗氧化能力。在临床前研究中,干预保护细胞免于铁死亡的代谢机制已成为一种有前景的治疗手段。
还原氮可用于大分子合成或废物转化,氮需求的增加与肿瘤增殖有着紧密的联系。癌细胞优先消耗首选生长支持氮供体——如谷氨酰胺,并在耗尽首选氮源后发展出以下适应性的节氮策略。(A)从头谷氨酰胺合成;(B)优先谷氨酸转氨为a-酮戊二酸,作为增殖细胞中非必需氨基酸合成最大化的策略;(C)从头谷氨酸合成;(D)在LKB1缺乏肿瘤中偏好CPS1介导的氨甲酰磷酸产生途径;(E)天冬氨酸用于嘧啶合成增加,与ASS1缺陷肿瘤对精氨酸输入的依赖性增加相协同(图5)。
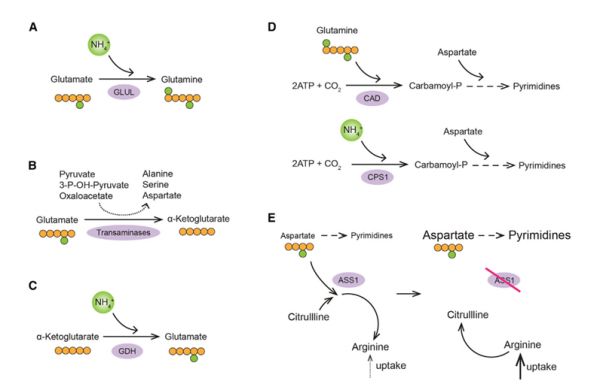
图5:肿瘤对氮的高需求
代谢异质性、与肿瘤微环境互作
肿瘤产生于不同的组织和细胞类型,在代谢方面会有明显的生理差异。当肿瘤细胞离开原组织并定植到其他器官时,它们可能会受到转移器官微环境的潜在限制。因此,肿瘤的代谢多样性是细胞固有的因素和遇到的代谢环境共同决定的。影响肿瘤代谢特征的因素主要有:细胞自身的致癌突变、肿瘤起源组织、定植器官的营养环境以及特定代谢物的驱动信号(图6)。
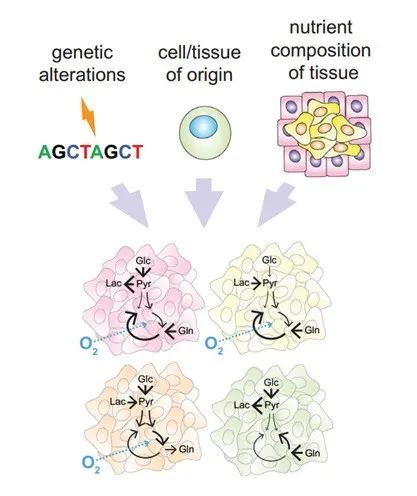
图6:肿瘤代谢的异质性
肿瘤与微环境中多种辅助或基质细胞,如成纤维细胞、免疫细胞和内皮细胞互相作用。肿瘤细胞可以利用信号和代谢影响周围基质细胞的行为,诱导基质细胞参与组织修复,从而促进癌细胞的存活和发展[15]。例如,许多实体瘤由大量的癌症相关成纤维细胞(CAF)组成,这些成纤维细胞从局部组织中招募并合成ECM。在某些情况下,组织特异性CAF还可以通过合成或释放氨基酸的酮酸为肿瘤提供营养支持(图7)。总之,TME是一个复杂的代谢系统,其中多种活性细胞有助于肿瘤特异性代谢环境的形成,从而调节其细胞行为并促进肿瘤扩展。
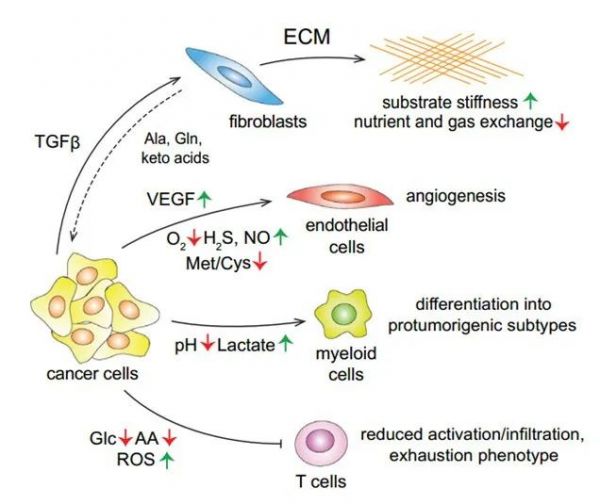
图7:与肿瘤微环境的代谢相互作用
肿瘤与机体代谢生态 越来越多的证据表明,致癌作用受机体代谢调节的影响。比如,与肥胖、糖尿病、衰老等相关的代谢变化在促进肿瘤发生、侵袭方面起着重要作用[16]。在人群水平上,降低细胞外葡萄糖和胰岛素水平的药物,如二甲双胍,已被证明可以降低糖尿病患者的癌症发病率[17]。
此外,一些肿瘤表现出影响整个机体代谢状态的能力。肿瘤主导的全身代谢最突出的表现是恶病质[18]。最近发现,肿瘤也可能扰乱肝脏和脂肪组织中代谢基因表达的昼夜节律,影响生物体的代谢状态[19,20] (图8)。
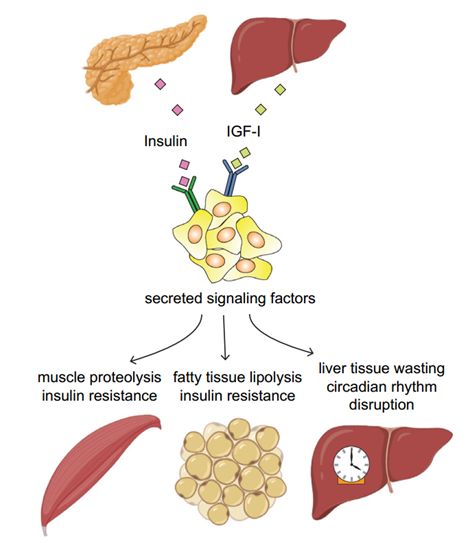
图8:肿瘤与机体代谢生态
总结
与肿瘤相关的代谢变化不仅维持肿瘤细胞本身的异常增殖,更迫使TME内的基质细胞、甚至整个机体的代谢平衡都发生重塑。共同促进了癌细胞的积聚和扩散,降低了免疫系统抵抗的抵抗能力,并直接升高癌症相关的致死率。通过解析肿瘤所依赖的代谢适应特征,有助于指导发现新的治疗甚至饮食干预方法,可能与现有的治疗措施(如化疗、靶向抑制剂和免疫检查点阻断)协同作用。
引用文献:
[1] Thompson, C.B. (2011). Rethinking the regulation of cellular metabolism. Cold Spring Harb. Symp. Quant. Biol. 76, 23–29. [2] Lawrence, M.S., Stojanov, P., Mermel, C.H., Robinson, J.T., Garraway, L.A., Golub, T.R., Meyerson, M., Gabriel, S.B., Lander, E.S., and Getz, G. (2014). Discovery and saturation analysis of cancer genes across 21 tumour types. Nature 505, 495–501. [3] Zanotelli, M.R., Rahman-Zaman, A., VanderBurgh, J.A., Taufalele, P.V., Jain, A., Erickson, D., Bordeleau, F., and Reinhart-King, C.A. (2019). Energetic costs regulated by cell mechanics and confinement are predictive of migration path during decision-making. Nat. Commun. 10, 4185. [4] Sullivan, W.J., Mullen, P.J., Schmid, E.W., Flores, A., Momcilovic, M., Sharpley, M.S., Jelinek, D., Whiteley, A.E., Maxwell, M.B., Wilde, B.R., et al. (2018). Extracellular matrix remodeling regulates glucose metabolism through TXNIP destabilization. Cell 175, 117–132.e21. [5] Kondo, H., Ratcliffe, C.D.H., Hooper, S., Ellis, J., MacRae, J.I., Hennequart, M., Dunsby, C.W., Anderson, K.I., and Sahai, E. (2021). Single-cell resolved imaging reveals intra-tumor heterogeneity in glycolysis, transitions between metabolic states, and their regulatory mechanisms. Cell Rep. 34, 108750. [6] Gao, P., Tchernyshyov, I., Chang, T.C., Lee, Y.S., Kita, K., Ochi, T., Zeller, K.I., De Marzo, A.M., Van Eyk, J.E., Mendell, J.T., and Dang, C.V. (2009). c-Myc suppression of miR-23a/b enhances mitochondrial glutaminase expression and glutamine metabolism. Nature 458, 762–765. [7] Schwo¨ rer, S., Berisa, M., Violante, S., Qin, W., Zhu, J., Hendrickson, R.C., Cross, J.R., and Thompson, C.B. (2020). Proline biosynthesis is a vent for TGFb-induced mitochondrial redox stress. EMBO J. 39, e103334. [8] Kamphorst, J.J., Nofal, M., Commisso, C., Hackett, S.R., Lu, W., Grabocka, E., Vander Heiden, M.G., Miller, G., Drebin, J.A., Bar-Sagi, D., et al. (2015). Human pancreatic cancer tumors are nutrient poor and tumor cells actively scavenge extracellular protein. Cancer Res. 75, 544–553. [9] Brown, M.S., and Goldstein, J.L. (1979). Receptor-mediated endocytosis: insights from the lipoprotein receptor system. Proc. Natl. Acad. Sci. USA 76, 3330–3337. [10] Kim, S.M., Nguyen, T.T., Ravi, A., Kubiniok, P., Finicle, B.T., Jayashankar, V., Malacrida, L., Hou, J., Robertson, J., Gao, D., et al. (2018). PTEN deficiency and AMPK activation promote nutrient scavenging and anabolism in prostate cancer cells. Cancer Discov. 8, 866–883. [11] Warburg, O., Wind, F., and Negelein, E. (1927). The metabolism of tumors in the body. J. Gen. Physiol. 8, 519–530. [12] Vander Heiden, M.G., Cantley, L.C., and Thompson, C.B. (2009). Understanding the Warburg effect: the metabolic requirements of cell proliferation. Science 324, 1029–1033. [13] Kory, N., Uit de Bos, J., van der Rijt, S., Jankovic, N., G€ura, M., Arp, N., Pena, I.A., Prakash, G., Chan, S.H., Kunchok, T., et al. (2020). MCART1/SLC25A51 is required for mitochondrial NAD transport. Sci. Adv. 6, eabe5310. [14] Luongo, T.S., Eller, J.M., Lu, M.J., Niere, M., Raith, F., Perry, C., Bornstein, M.R., Oliphint, P., Wang, L., McReynolds, M.R., et al. (2020). SLC25A51 is a mammalian mitochondrial NAD+ transporter. Nature 588, 174–179. [15] Dvorak, H.F. (1986). Tumors: wounds that do not heal. Similarities between tumor stroma generation and wound healing. N. Engl. J. Med. 315, 1650–1659. [16] Gomes, A.P., Ilter, D., Low, V., Endress, J.E., Ferna´ ndez-Garcıá, J., Rosenzweig, A., Schild, T., Broekaert, D., Ahmed, A., Planque, M., et al. (2020). Age-induced accumulation of methylmalonic acid promotes tumour progression. Nature 585, 283–287. [17] Noto, H., Goto, A., Tsujimoto, T., and Noda, M. (2012). Cancer risk in diabetic patients treated with metformin: a systematic review and meta-analysis. PLoS ONE 7, e33411. [18] Porporato, P.E. (2016). Understanding cachexia as a cancer metabolism syndrome. Oncogenesis 5, e200. [19] Hojo, H., Enya, S., Arai, M., Suzuki, Y., Nojiri, T., Kangawa, K., Koyama, S., and Kawaoka, S. (2017). Remote reprogramming of hepatic circadian transcriptome by breast cancer. Oncotarget 8, 34128–34140. [20] Tsoli, M., Schweiger, M., Vanniasinghe, A.S., Painter, A., Zechner, R., Clarke, S., and Robertson, G. (2014). Depletion of white adipose tissue in cancer cachexia syndrome is associated with inflammatory signaling and disrupted circadian regulation. PLoS ONE 9, e92966. [21] Pavlova NN, Zhu J, Thompson CB. The hallmarks of cancer metabolism: Still emerging. Cell Metab. 2022 Mar 1;34(3):355-377.
作者:杨黎星
编辑人:Transparent
推文用于传递知识,如因版权等有疑问,请于本文刊发30日内联系医药速览。原创内容未经授权,禁止转载至其他平台。©2021 医药速览 保留所有权利
来源:医药速览 2022-08-15
本文由“健康号”用户上传、授权发布,以上内容(含文字、图片、视频)不代表健康界立场。“健康号”系信息发布平台,仅提供信息存储服务,如有转载、侵权等任何问题,请联系健康界(jkh@hmkx.cn)处理。
相关知识
STAT调控肿瘤脂质代谢
【论肿道麻】靶向代谢改善肿瘤微环境的抗肿瘤免疫疗法
【论肿道麻】Nature Reviews Immunology:肿瘤免疫疗法的代谢屏障
体内稳态和肿瘤免疫中的T细胞代谢
【论肿道麻】饮食和运动在肿瘤代谢中的作用
【论肿道麻】Nature Cell Biology: 肿瘤免疫微环境中的代谢通讯
【论肿道麻】丙酸盐代谢失调促进肿瘤进展和侵袭性
肿瘤能量代谢调控的关键转录因子
小药综述:肿瘤代谢重编程与免疫应答
【论肿道麻】肿瘤脂肪酸代谢在治疗抵抗和肥胖中的作用
网址: 肿瘤代谢全景介绍 https://m.trfsz.com/newsview840522.html