以下文章来源于生物化学与生物物理进展 ,作者PIBB
生物化学与生物物理进展.
期刊宣传、为作者和审稿人提供移动终端的登录服务
肥胖是指体内脂肪堆积过多,以至于对健康造成负面影响的一种复杂慢性疾病。它通常通过身体质量指数(BMI)来定义,BMI是体重(kg)除以身高(m)的平方。根据世界卫生组织(WHO)的标准,成人的BMI分类如下:BMI 为18.5~24.9时,定义为正常体重;当BMI 为25~29.9时定义为超重,BMI大于等于30时定义为肥胖。
在21世纪,肥胖已经成为一个全球性的流行病。据WHO统计,全球有超过6.5亿成年人患有肥胖症。肥胖不仅影响个人的健康与生活质量,还与多种慢性疾病紧密相关,包括2型糖尿病(T2DM)、非酒精性脂肪性肝病(NAFLD)、心血管疾病、神经退行性疾病、睡眠呼吸暂停以及某些类型的癌症[1]。这些疾病不仅对患者的健康构成威胁,还对社会经济造成沉重负担。
因此,寻找有效的治疗方法,控制肥胖及其相关并发症,已成为全球医学研究的热点。
在肥胖及其相关并发症的治疗上,目前的药物选择相对有限。许多抗肥胖药物因严重的不良反应而退出市场[2],而现有的抗糖尿病药物大多只能控制症状,无法治愈疾病。因此,开发有效的长期治疗方法成为了一个迫切的需求。
在这一背景下,成纤维细胞生长因子1(fibroblast growth factor, FGF1)因其在能量代谢与胰岛素敏感性调节中的关键作用,成为了研究的热点。
FGF1是一种非糖基化多肽,由155个氨基酸组成,对全身能量稳态、糖脂代谢与胰岛素敏感性具有重要调节作用[3]。其通过与细胞表面的酪氨酸激酶受体(FGFR)结合,激活下游信号通路,从而影响细胞的增殖、分化与代谢。研究表明,FGF1对肥胖及其相关并发症具有一定的治疗益处[4],但长期使用可能导致肿瘤发生风险增加,这限制了其在临床应用中的潜力。
FGF1是一种多功能细胞因子,对多种生物过程具有重要影响,FGF1的作用机制涉及以下几个关键方面[3-5](表1):
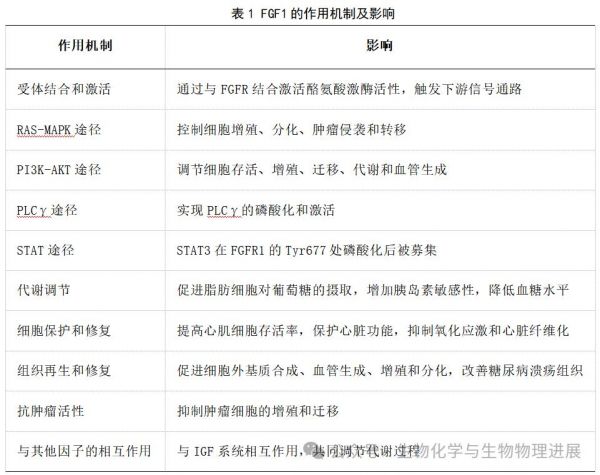
目前对FGF1的研究主要包括FGF1对脂肪调节、血糖和胰岛素抵抗的调节、代谢、癌症、心血管五个方面的影响。
FGF1与脂肪调节
FGF1在脂肪组织的发展、沉积和功能中扮演着关键角色(图1)。FGF1通过与细胞表面的FGFR结合,激活下游信号通路,影响脂肪细胞的增殖分化以及脂肪分解和糖代谢。高脂饮食能够通过营养感应和机械感应两种机制调节FGF1的可用性,进而影响脂肪细胞的功能[6-7]。FGF1还参与脂肪重塑,通过增加脂肪细胞对葡萄糖的摄取,调节脂肪细胞的功能,从而参与肥胖及其并发症的调节。此外,FGF1还参与包括血管生成、炎症反应、异常脂肪细胞大小分布和胰腺脂肪酶的异位表达。
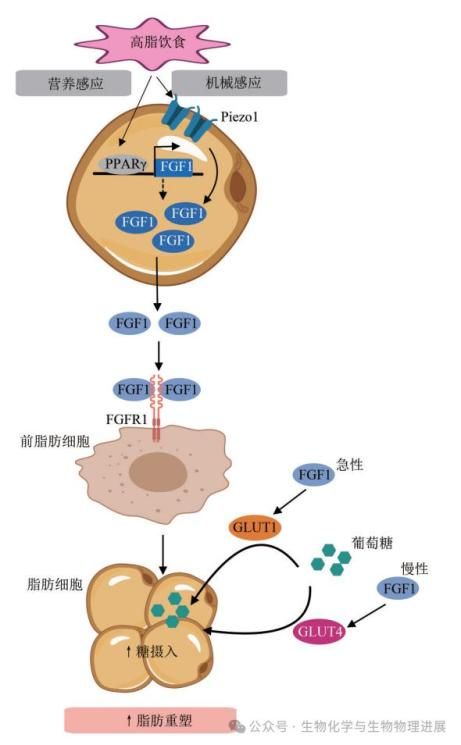
图1 FGF1对脂肪的调节方式
FGF1与血糖调节
FGF1对血糖的调节作用表现在多个层面(图2)。FGF1通过外周和中枢途径发挥作用,增强胰岛素敏感性并改善胰岛素抵抗。外周注射FGF1能够抑制脂解和减少肝葡萄糖生成(HGP)[8],从而降低血糖水平,并且促进骨骼肌中胰岛素依赖性葡萄糖摄取,进一步降低血糖。中枢注射FGF1则通过影响下丘脑-垂体-肾上腺(HPA)轴来减少HGP,实现血糖控制。FGF1的这些作用不依赖于胰岛素,而是通过抑制PDE3B来发挥血糖调节功能,显示出其在治疗T2DM中的潜力。
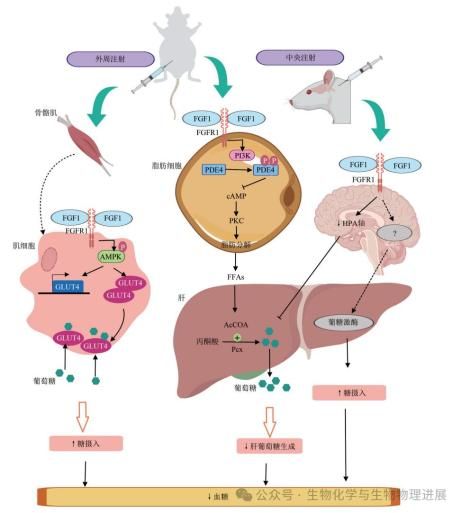
图2 FGF1 对血糖的调节作用
FGF1与NAFLD
FGF1通过以上两种代谢的调节的复合作用影响肝脏的脂肪沉积和代谢功能。研究表明,FGF1能够改善肥胖相关的肝脂肪变性,降低肝脏内的脂肪积累,从而减轻NAFLD的症状。FGF1通过调节胰岛素敏感性,促进脂肪细胞的分解和脂肪酸的氧化,帮助降低肝脏的脂肪负荷。此外,FGF1还可以通过影响肝脏的炎症反应和氧化应激,进一步改善肝脏的代谢状态。因FGF1的这种复合代谢调节特点能有效调节脂质和糖代谢,改善肝脏健康,而使其成为治疗NAFLD的潜在靶点。
FGF1与肿瘤
FGF1与癌症之间的关系复杂且多面。FGF1在多种癌症的发生和发展中扮演着关键角色。研究表明,FGF1能够刺激肿瘤细胞的增殖、迁移和侵袭,尤其是在乳腺癌中,FGF1的表达增加与肿瘤进展相关[9]。此外,FGF1还参与调节肿瘤微环境,影响肿瘤血管生成,而这两种因素在肿瘤生长和转移中至关重要。在癌症治疗中,FGF1及其信号通路的靶向治疗策略正在被探索,以期提高抗癌药物的疗效。总体而言,FGF1在癌症中的双重作用使其成为一个有潜力的治疗靶点,但同时也需要更深入的研究来完全理解其在不同类型癌症中的具体作用机制。
FGF1与心血管疾病
对于心血管来说,FGF1在其正常生理及功能中扮演着重要角色,并对心血管疾病具有潜在的治疗影响。FGF1因为对促进血管生成、细胞增殖和迁移影响,成为一种对心脏和血管健康至关重要的物质。在心脏发育过程中,FGF1及其受体的表达显著,这种情况下可以刺激心肌细胞重新进入细胞周期,这表明其对心脏再生的积极作用[10]。此外,FGF1在缺血/再灌注损伤、心肌梗死、病理性心脏重塑和心脏毒性等心血管疾病中还具有保护作用[11]。动物和细胞研究表明,FGF1能够提高心肌细胞的存活率,保护心脏功能,通过抑制氧化应激、心脏纤维化、细胞凋亡和下调炎症反应来改善心脏功能。因此,FGF1在心血管健康和疾病中的作用使其成为一个有前景的相关疾病治疗靶点,尤其是在心脏保护和修复方面。
小结与展望
总而言之,FGF1的发现为治疗肥胖及其相关并发症提供了更多的希望,但随着机制研究的深入,学者们也发现了FGF1的临床应用所需要面临的一些挑战。
首先,FGF1的有丝分裂活性可能导致肿瘤发生。因此,对于临床需要长期使用的背景下,不得不考虑FGF1诱导出肿瘤的可能性,这使得它的应用具有很大的限制性。再者,FGF1的有效剂量和安全性剂量范围需要精确确定,现在所能确定的剂量对于应用来说已接近临床所能应用的极限,且由于个体间存在的差异性,在实际操作上难以精准地确定临床上安全且有效的剂量。除此之外,FGF1作为蛋白质,在体内的稳定性和递送效率也同样存在问题。
对此,为了克服FGF1的安全性问题,相关学者开发了一系列工程化的FGF1变体。这些变体通过改变FGF1的氨基酸序列,降低了其促有丝分裂潜力,同时保留了FGF1的代谢调节活性。例如,FGF1ΔHBS通过三点突变抑制了FGF1-FGFR二聚体的稳定性,降低了对肝素的亲和力,从而在降低其促有丝分裂潜力的同时,充分保留了其代谢调节活性。
虽然FGF1的研究和应用还面临着许多挑战,但随着科学研究的不断深入,我们有理由相信,这些挑战终将被克服。
FGF1及其变体的研究不仅为肥胖及其相关疾病治疗提供了新的思路,也为其他代谢性疾病的治疗提供了新的可能。随着更多细胞分子领域的研究与开发,FGF1有望成为治疗肥胖及其相关疾病的有力武器,为全球相关患者带来新的希望。(详情请点击下方阅读原文)
参考文献
[1] Kyrou I, Randeva H S, Tsigos C, et al. Clinical problems caused by obesity//Feingold K R, Anawalt B, Blackman M R, et al. Endotext. South Dartmouth (MA): MDText.com, Inc., 2018
[2] Aaseth J, Ellefsen S, Alehagen U, et al. Diets and drugs for weight loss and health in obesity - An update. Biomedecine Pharmacother, 2021, 140: 111789
[3] Beenken A, Eliseenkova A V, Ibrahimi O A, et al. Plasticity in interactions of fibroblast growth factor 1 (FGF1) N terminus with FGF receptors underlies promiscuity of FGF1. J Biol Chem, 2012, 287(5): 3067-3078
[4] Beenken A, Mohammadi M. The FGF family: biology, pathophysiology and therapy. Nat Rev Drug Discov, 2009, 8(3): 235-253
[5] Gasser E, Sancar G, Downes M, et al. Metabolic Messengers: fibroblast growth factor 1. Nat Metab, 2022, 4(6): 663-671
[6] Wang S, Cao S, Arhatte M, et al. Adipocyte Piezo1 mediates obesogenic adipogenesis through the FGF1/FGFR1 signaling pathway in mice. Nat Commun, 2020, 11(1): 2303
[7] Cui S, Li X, Li R, et al. FGF1 promotes the differentiation of goat intramuscular and subcutaneous preadipocytes. Anim Biotechnol, 2023, 34(4): 1196-1208
[8] Sancar G, Liu S, Gasser E, et al. FGF1 and insulin control lipolysis by convergent pathways. Cell Metab, 2022, 34(1): 171-183.e6
[9] Iwase T, Wang X, Shrimanker T V, et al. Body composition and breast cancer risk and treatment: mechanisms and impact. Breast Cancer Res Treat, 2021, 186(2): 273-283
[10] Novoyatleva T, Sajjad A, Pogoryelov D, et al. FGF1-mediated cardiomyocyte cell cycle reentry depends on the interaction of FGFR-1 and Fn14. FASEB J, 2014, 28(6): 2492-2503
[11] Li G, Shao Y, Guo H C, et al. MicroRNA-27b-3p down-regulates FGF1 and aggravates pathological cardiac remodelling. Cardiovasc Res, 2022, 118(9): 2139-2151
江昕茹
天津体育学院运动健康学院运动人体科学专业硕士研究生,从事线粒体机制等相关研究。

本文转载自公众号:生物化学与生物物理进展
中国生物物理学会官方订阅号,为BSC会员及生物物理领域专业人士服务。
投稿及授权请联系:bscoffice@bsc.org.cn。
原标题:《【前沿科普】肥胖治疗的新曙光——成纤维细胞生长因子1》