细胞衰老与肿瘤治疗
0. 引言
细胞在其生命过程中会产生各种损伤,这些损伤对细胞正常生命活动会产生消极影响,甚至引发癌症。通常情况下,细胞可以通过细胞凋亡或细胞衰老2种基本细胞机制抵御细胞损伤的积累与传播,预防癌症发生[1]。细胞衰老是一种可由多种内源或外源性刺激诱导的防御机制[2],可以分为细胞分裂过程中端粒缩短引起的复制性衰老和其他应激刺激(如氧化应激等)引起的早熟性衰老。
真核细胞通过有丝分裂进行增殖,从一次分裂完成到下一次分裂结束所经历的过程称为细胞周期,分为间期和分裂期2个阶段,其中间期又分为G1期、S期和G2期。细胞衰老的主要特征是细胞周期稳定地停滞在G1-S期(gap phase 1-synthesis phase)[3]。除了这一基本特征外,衰老细胞还表现出一些普遍特征,如衰老细胞会分泌多种因子,这种现象被称为衰老相关分泌表型(senescence-associated secretory phenotype,SASP)[4]。细胞衰老可以作为抑制肿瘤发生的一种重要屏障,衰老肿瘤细胞增殖停滞,同时通过分泌SASP因子影响肿瘤微环境并促进抗肿瘤免疫。然而衰老并不是完全不可逆的,部分衰老肿瘤细胞会逃脱细胞周期阻滞,导致癌症复发,某些SASP因子还可以介导肿瘤免疫逃逸并诱导癌细胞干性化,促进肿瘤发生。
基于细胞衰老对肿瘤细胞的异质性影响,学者提出了多种癌症治疗策略。如:通过诱导肿瘤细胞衰老来抑制肿瘤发展的促衰老疗法;通过选择性诱导衰老细胞凋亡以清除衰老肿瘤细胞的抗衰老疗法称为senolytics疗法;通过抑制衰老细胞分泌的SASP因子的有害影响, 降低衰老细胞产生的不良反应的抗衰老疗法称为senomorphics疗法等。Senolytics疗法在清除衰老细胞、降低细胞衰老不良反应和改善癌症治疗效果方面具有巨大潜能[5]。因此,一些senolytics药物已经被用于临床试验。与senolytics药物相比,senomorphics药物不能直接清除衰老细胞,因此需要长期给药来维持药效,故senomorphics药物目前尚未进入临床试验阶段,并且此类药物的使用会干扰一些关键信号通路的进行,可能会带来更大的风险和不良反应[6]。本综述拟概述不同因素引发的细胞衰老的特征,阐述细胞衰老对于肿瘤发生发展的双重效应,同时探讨促衰老疗法与抗衰老疗法在癌症治疗中的潜力与挑战。
1. 细胞衰老的机制与特征
1.1 复制性衰老复制性衰老是最常见的一种细胞衰老方式。细胞出现复制性衰老:一方面是由于在细胞分裂过程中,端粒缩短到一定程度被细胞感知为脱氧核糖核酸(deoxyribonucleic acid,DNA)双链断裂[7],触发DNA损伤反应(DNA damage response,DDR)从而诱发细胞周期阻滞以维持细胞基因组稳定;另一方面是由于细胞周期依赖性蛋白激酶(cyclin-dependent kinase,CDK)抑制物(CDK inhibitors,CDKI)如p16和p21等的表达上调[8],从而导致持续的细胞周期阻滞。
1.2 早熟性衰老正常情况下随着细胞周期的进行,体细胞逐渐进入复制性衰老。然而,在一些刺激的作用下,细胞会提前进入衰老状态,即早熟性衰老。如由于过量活性氧(reactive oxygen species,ROS)产生和细胞抗氧化活性的不平衡而产生氧化应激[9],主要激活p53蛋白,进而诱导p21的表达,导致细胞周期阻滞,促进细胞衰老[10]。此外,在癌症治疗过程中通过治疗手段(化学疗法和放射疗法)可以使得肿瘤细胞被迫进入衰老状态,从而导致治疗诱导的衰老[11]。烷基化剂、微管抑制剂还有拓扑异构酶抑制剂等化疗药物都已在临床前试验中被确定为衰老诱导剂[12],其作用机制是产生DNA损伤,从而诱导细胞衰老。与化学疗法相同,放射疗法因为能够产生急性DNA损伤而被用于癌症治疗[12]。总之,一些应激因素的作用会引起正常未衰老细胞的早熟性衰老。
1.3 衰老细胞的特征不同刺激条件诱导的衰老细胞具有一些共同的特征如图 1所示。肿瘤细胞在经过诸如氧化应激等压力的刺激下,会进入细胞衰老这种稳定的细胞周期阻滞的状态,并表现出一些普遍特征包括细胞形态以及代谢方面的改变。其中:细胞形态方面的变化主要表现为细胞体积增大、形态扁平;代谢方面的改变主要表现为SASP因子的分泌以及衰老相关半乳糖苷酶(senescence-associated β-galactosidase,SA-β-gal)活性上调[12],这些状态的改变对衰老肿瘤细胞本身的生长状态会产生促进或抑制的异质性影响。
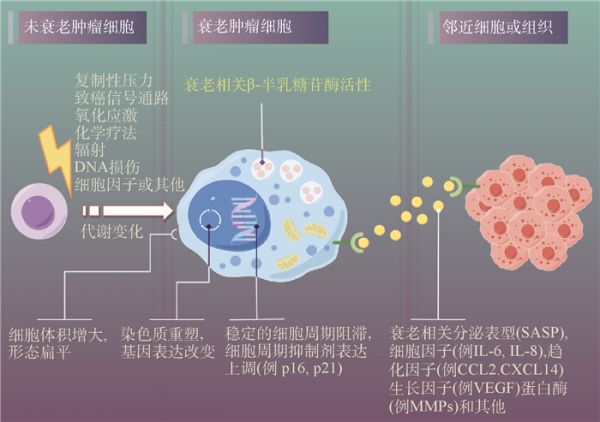
图 1 衰老细胞的特征
注:DNA为脱氧核糖核酸;IL为白细胞介素;CCL2为C-C基序趋化因子配体2;CXCL14为C-X-C基序趋化因子配体14;VEGF为血管内皮生长因子;MMPs为基质金属蛋白酶。
2. 细胞衰老对肿瘤的影响
2.1 细胞衰老的肿瘤抑制效应细胞衰老主要通过2种机制抑制肿瘤细胞的发生及发展,具体如图 2所示。一方面,肿瘤细胞进入细胞衰老后,INK4A和ARF以及p21和p53的表达上调,使得衰老肿瘤细胞的增殖受到抑制[13]。此外,一些衰老细胞通过分泌一种重要的SASP调节因子——炎性细胞因子白细胞介素1α(interleukin-1α,IL-1α),核因子激活B细胞κ-轻链增强子(nuclear factor kappa-light-chain-enhancer of activated B cells,NF-κB)促进白细胞介素6(interleukin-6,IL-6)和白细胞介素8(interleukin-8,IL-8)的转录,进而触发自分泌炎症反应。随后,这些炎性细胞因子通过增加ROS的产生和持续的DDR,进一步加强了对衰老肿瘤细胞的增殖抑制。IL-1α还通过旁分泌效应介导邻近细胞的衰老,从而扩大其增殖抑制范围[14]。另一方面,通过p53信号通路与NF-κB信号通路共同调节SASP因子的分泌,募集激活各种免疫细胞形成肿瘤抑制微环境,促进清除衰老肿瘤细胞[15]。因此,细胞衰老通过抑制增殖和促进免疫监视在体内发挥着肿瘤屏障的作用。
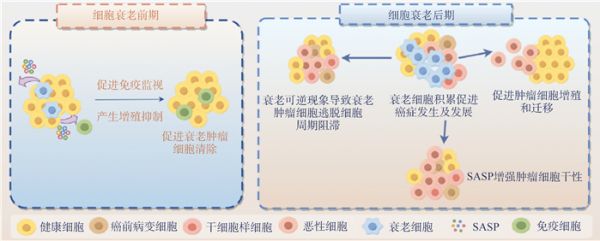
图 2 细胞衰老对肿瘤细胞的异质性影响
注:SASP为衰老相关分泌表型。
2.2 细胞衰老的促肿瘤效应 2.2.1 SASP介导的促肿瘤效应SASP因子的分泌是一个高度动态的异质化过程[16],衰老肿瘤细胞早期和晚期分泌的SASP因子的种类和功能也有所不同(图 2)。一方面,衰老肿瘤细胞晚期分泌的SASP因子通过促进肿瘤细胞增殖、迁移和侵袭,增强肿瘤细胞群的恶性潜能。IL-6和IL-8通过激活信号传导及转录激活因子3(signal transducer and activator of transcription 3,STAT3)促进基质金属蛋白酶(matrix metallo proteinases,MMPs)的表达[17],MMPs降解细胞外基质(extracellular matrix,ECM)释放上皮转化因子和生长因子等,加速肿瘤的进一步生长和上皮-组织间质转移(epithelial-mesenchymal transition,EMT)[17-18],从而促进肿瘤细胞增殖和侵袭。另一方面,衰老肿瘤细胞晚期分泌的SASP因子还可以介导免疫逃逸发挥促肿瘤效应。自然杀伤(natural killer,NK)细胞表面表达的活化性受体(natural-killer group 2 member D,NKG2D)通过识别靶细胞表面的配体NKG2DL激活免疫应答,从而促进免疫细胞清除靶细胞。衰老肿瘤细胞通过表达MMPs水解其表面的NKG2DL,从而避免被CD8+T细胞和NK表面的NKG2D识别和结合,逃脱免疫监视[19]。
2.2.2 癌细胞中衰老的可逆性细胞衰老是一种稳定的细胞周期停滞的状态,然而很多研究表明这种细胞衰老现象并不是完全不可逆的,特别是在治疗诱导的衰老细胞中,部分衰老癌细胞可以逃脱细胞周期阻滞的状态。这种衰老可逆现象可能是导致癌症复发、癌症预后差甚至是癌症起源的关键原因[20]。
3. 细胞衰老与癌症治疗
3.1 促衰老疗法通过诱导肿瘤细胞衰老抑制其发生及发展是一种有效的癌症治疗策略。传统癌症治疗策略,如化学疗法和放射疗法都是通过引起细胞DNA损伤,诱导细胞衰老或者细胞凋亡。然而这种效应不仅作用于癌细胞,还会对旁边的健康组织细胞造成影响。因此,现在的治疗开始着眼于特异性靶向癌细胞的衰老疗法。
目前开发的一些促衰老药物根据靶点不同可以分为:(1)恢复或上调p53活性的药物,如鼠双小蛋白2(mouse double minutes 2, MDM2)抑制剂nutlin 3和RG7112可以干扰p53-MDM2的相互作用,从而抑制MDM2对p53的负调控作用,此类药物在人类癌细胞系模型中表现出良好的应用前景[21-22];(2)靶向CDK和CDKI的药物,一些靶向CDK2的CDKI已经在临床试验中使用;(3)靶向端粒酶复合物的药物,端粒酶是一种逆转录酶,以自身携带的单链核糖核酸(ribonucleic acid, RNA)为模板合成端粒。在健康细胞中,端粒酶的活性是被抑制的,因而端粒会随着细胞周期的进行逐渐缩短,引起细胞复制性衰老。癌细胞通过重新激活端粒酶活性来规避这一过程,获得无限增殖能力[23],可以通过端粒酶抑制剂抑制端粒酶活性,诱导癌细胞衰老。端粒酶抑制剂BIBR15和GRN163L可以有效诱导癌细胞衰老,抑制癌细胞增殖[24]。此外,研究认为GRN163L在诱导细胞衰老的同时,也会诱导人胰腺癌细胞凋亡,该药物在促衰老疗法中的应用还有待进一步研究[24]。然而由于端粒酶抑制剂对一些高度增殖细胞的潜在不良反应,目前该领域的研究已经不仅仅局限于抑制端粒酶活性。如针对端粒延长替代通路(alternative lengthening of telomeres,ALT)的治疗策略,ALT是一种依赖同源定向修复(homology directed repair,HDR)延长端粒的非端粒酶依赖性端粒维持机制[25]。临床前研究表明,在ALT阳性的癌细胞中,多聚二磷酸腺苷(adenosine diphosphate,ADP)核糖聚合酶(poly(ADP-ribose)polymerase,PARP)抑制剂诱导端粒重复序列结合因子2(telomeric-repeat binding factor 2,TRF2)与端粒分离,从而促进非同源末端连接修复,导致端粒融合,并介导了ALT阳性颅内星形细胞瘤的消退,几种PARP抑制剂目前已被美国食品药品管理局(Food and Drug Administration,FDA)批准用于治疗同源重组缺陷型乳腺癌、胰腺癌、卵巢癌和转移性前列腺癌等[25]。
在临床治疗中,这些靶向疗法常与化学疗法、放射疗法等传统疗法结合使用,不仅减少了癌症治疗对健康组织细胞的不良反应,还提高了治疗效率。但是,细胞进入衰老后对细胞凋亡产生抗性,同时细胞衰老后期产生各种促肿瘤效应,使得衰老肿瘤细胞在体内积累,从而导致各种老年疾病的发生。因此,促衰老疗法还常常与靶向衰老细胞促进其凋亡的senolytics和senomorphics等抗衰老疗法联合使用治疗癌症。
3.2 抗衰老疗法 3.2.1 Senolytics疗法Senolytics疗法是指通过使用一些senolytics药物选择性清除衰老细胞的癌症疗法。衰老细胞与健康组织细胞的一个重要区别在于基因表达的变化,其中编码抗凋亡家族蛋白的基因表达明显上调[26],从而拮抗细胞凋亡,以这些基因为靶点设计senolytics疗法来特异性清除衰老细胞。研究者已经开发了多种senolytics药物,如Navitoclax(ABT-263),是一种抗凋亡蛋白B淋巴细胞瘤-2(B-cell lymphoma-2,BCL-2)家族抑制剂,通过重新激活凋亡途径,可以有效清除包括衰老肿瘤细胞在内的多种类型的衰老细胞[27-31]。研究证实,ABT-263具有清除PARP抑制剂奥拉帕尼(Olaparib)处理过的衰老样乳腺癌细胞(MDA-MB-231)和卵巢癌细胞(OV1946、OV4453)的能力[32]。然而,ABT-263的使用同时会带来血小板减少症和中性粒细胞减少症等不良反应[33]。为了减少不良反应,研究人员设计了一种结合了半乳糖的ABT-263前药Nav-Gal,在衰老细胞分泌的SA-β-gal作用下,Nav-Gal转变为有活性的ABT-263,进而靶向衰老细胞中的抗凋亡蛋白BCL-2、BCL-W和BCL-XL,促进衰老细胞凋亡[34]。同时继续寻找不良反应更小的senolytics药物,研究表明,强心苷家族化合物毒毛旋花苷G(Ouabain)通过促进几种促凋亡BCL-2家族蛋白表达上调而选择性地诱导了衰老肿瘤细胞凋亡且不会带来血小板减少症等不良反应[35]。槲皮素(Quercetin)是一种植物类黄酮天然化合物,其治疗效果均已在体内和体外得到了证实[36]。为了研究槲皮素对白血病细胞凋亡的影响及作用机制,用不同剂量的槲皮素处理人原髓细胞白血病细胞(human myeloid leukemia cell,HL-60),结果表明槲皮素通过降低磷酸化蛋白激酶B(phosphorylated protein kinase B,pAkt)和BCL-2蛋白、升高BCL-2相关X(BCL-2-associated-X,BAX)蛋白,激活caspase家族介导人早幼粒急性HL-60凋亡[37]。然而,槲皮素的一些理化性质,如化学不稳定性、水溶性差和生物利用率低等,限制了其在癌症治疗中的应用[38]。达沙替尼(Dasatinib)是一类广谱的激酶类抑制剂,靶向类固醇受体辅助激活因子(steroid receptor coactivator, SRC)激酶和PI3K-AKT信号通路,进而作用于下游哺乳动物雷帕霉素靶蛋白(mammalian target of Rapamycin,mTOR)信号通路,促进衰老细胞凋亡[29]。达沙替尼和槲皮素联合使用比单独使用的治疗效果更好[36, 39-40],在老年小鼠中联合使用达沙替尼和槲皮素可消除衰老细胞,改善心血管功能和生存率[41]。
作为衰老细胞中信号通路的一个重要组分,p53也可以作为senolytics疗法的靶点。如UBX0101是一种MDM2与p53相互作用的抑制剂,通过破坏p53-MDM2复合物解除MDM2对p53的负调节作用,使得p53能够正常发挥诱导细胞凋亡功能[42]。UBX0101最初在小鼠模型中被证明可以缓解骨关节炎,是第一种已经进入临床试验的新型抗衰老药物[3]。然而,由于缺乏疗效,UBX0101在I期临床试验数据评估后被停药[43]。靶向p53-MDM2相互作用的药物可能对健康细胞产生不良反应,这与其不是针对癌细胞或衰老细胞的特异性药物有关[44]。FOXO4-DRI是一种肽拮抗剂,与衰老细胞生存依赖的转录因子叉头蛋白O4抗体(FOXO4)竞争结合p53,抑制p53-FOXO4复合物的活性,促进衰老细胞凋亡[45]。FOXO4在衰老细胞中的表达明显高于健康细胞,因而在一定浓度范围内,FOXO4-DRI可以高效地消除衰老细胞,而不影响健康细胞[45]。FOXO4-DRI可以特异性诱导衰老的癌症相关成纤维细胞(cancer-associated fibroblasts,CAFs)凋亡,抑制了CAFs在体内和体外对非小细胞肺癌(non-small cell lung cancer,NSCLC)细胞放射治疗抗性的促进作用,从而增强了NSCLC细胞对放射治疗的敏感性,促进了NSCLC细胞的凋亡[46]。然而,FOXO4-DRI是否对衰老肿瘤细胞具有直接杀伤作用, 仍需要进一步研究[46]。
此外,研究人员也在致力于寻找新的药物靶标,McHugh等[47]通过Dharmacon RNAi基因文库筛选,表明包被蛋白复合物I(COPI)信号通路的成分(COPB2、COPG1和ARF1)可以作为senolytic靶标,并进一步证实N-肉豆蔻酰转移酶抑制剂(NMTi)可以通过间接抑制COPI通路杀死衰老细胞,有望用于癌症及纤维化等年龄相关疾病的治疗。
虽然senolytics疗法已经显示出其短期内选择性清除衰老细胞的有效性,但是对于senolytics药物在体内的长期性影响仍需要进一步的研究,并且对于一些需要定期给药的senolytics药物,也需要探索其最佳给药时间及剂量[12]。
3.2.2 Senomorphics疗法Senomorphics疗法是一种靶向衰老肿瘤细胞产生的SASP因子的抗衰老疗法。由于衰老细胞的大多数促肿瘤效应是通过分泌SASP因子介导的,因此可以通过使用SASP抑制剂,即senomorphics药物抑制肿瘤的发生及发展。
一些senomorphics药物通过靶向与SASP表达相关的信号通路来抑制SASP的产生,如mTOR通路以及转录因子如NF-κB等[7]。雷帕霉素(Rapamycin)是mTOR激酶的特异性抑制剂,可以有效抑制人类衰老成纤维细胞内SASP因子的产生并导致SA-β-gal活性降低,从而抑制衰老细胞的促肿瘤效应[48]。同时,雷帕霉素也可能通过影响线粒体的功能,发挥其抗衰老作用,抑制线粒体ROS的产生,进而抑制细胞衰老,从而导致SASP生成减少[49]。白藜芦醇(Resveratrol)是一种膳食来源的类黄酮,可以有效阻滞对SASP生成起主要调节作用的NF-κB信号通路[50-51]。白藜芦醇通过激活对NF-κB信号通路起负调节作用的转录因子nuclear factor erythroid 2-related factor(NRF2),抑制SASP的合成。当对早衰小鼠P8(senescence accelerated mouse/prone,SAMP8)品系给予白藜芦醇药物治疗时,胰腺中与年龄相关的促炎和促氧化状态得到明显缓解[52]。
还有一些senomorphics药物通过使用靶向SASP因子的特异性抗体来清除SASP因子[53]。Siltuximab是一种中和性抗IL-6的单克隆抗体,已被用于多中心型巨大淋巴结增生症的治疗,目前正测试于各种肿瘤治疗[54]。Canakinumab是一种人源化抗白细胞介素1β(interleukin-1β,IL-1β)单克隆抗体,用于治疗多种以发热为特征的炎症综合征,在NSCLC患者的临床试验中治疗效果良好[55]。这些senomorphics药物仍需要在各种肿瘤模型和临床试验中进一步地深入研究,以确定其是通过特异性抗原-抗体相互作用,抑制衰老肿瘤细胞分泌的SASP因子发挥抗肿瘤效应,而不是非特异性的抗炎效应[12]。
3.2.3 免疫疗法衰老细胞可以通过分泌SASP因子等机制逃脱免疫监视,因此学者开发了促进免疫细胞靶向衰老细胞的免疫疗法,通过对T细胞进行基因编辑产生嵌合抗原受体T(chimeric antigen receptor T,CAR-T)细胞,使其可以定向识别并结合衰老细胞表面表达上调的蛋白,从而促进衰老细胞清除。如一种仅在B淋巴细胞系中表达的CD19跨膜糖蛋白,在大多数恶性B细胞肿瘤中表达上调。阿基仑赛(Axicabtagene ciloleucel)、利基迈仑赛(Lisocabtagene maraleucel)和司利弗明(Tisagenlecleucel)是FDA批准的靶向CD19的治疗复发或难治性弥漫性大B细胞淋巴瘤的药物,治疗效果良好[56]。
4. 讨论
利用细胞衰老治疗癌症已经成为目前癌症治疗中一种常用策略。通过使用促衰老药物靶向诱导肿瘤细胞衰老,使其进入增殖抑制的稳定状态,并促进固有免疫细胞清除衰老肿瘤细胞,从而抑制癌症发展。虽然这种靶向肿瘤细胞的促衰老疗法已经减少了对健康细胞的不良反应,但是当肿瘤细胞进入衰老后期,衰老肿瘤细胞倾向于通过分泌多种SASP因子,致使衰老肿瘤细胞在体内不断积累,产生促进肿瘤发展的负面效应。早在1958年,联合治疗癌症的概念已被用于临床治疗[57]。一方面,通过联合疗法,依次使用不同组合的药物,可以避免耐药性的出现;另一方面,由于衰老是一种稳定的细胞状态,在促衰老药物停止使用后仍会持续存在,因此,促衰老疗法非常适合在联合疗法中使用,促衰老治疗后再进行抗衰老治疗的联合疗法在原则上是可行的[58]。首先使用促衰老药物靶向诱导肿瘤细胞衰老,然后使用抗衰老药物,如senolytics药物选择性诱导衰老肿瘤细胞凋亡,或senomorphics药物抑制衰老肿瘤细胞SASP因子的产生或功能,在有效治疗癌症的同时,降低治疗对人体产生的不良反应。值得一提的是,现有一些药物在不同的处理条件下呈现不同效应,如原花青素C1(PCC1)是一种从葡萄籽提取物中分离出的多酚类黄酮,在低浓度时抑制SASP表达,表现为senomorphics药物的活性;而在较高浓度下,其通过促进ROS的产生和线粒体功能障碍选择性地杀死衰老细胞,表现为senolytics药物的活性[59]。
目前联合疗法也面临诸多挑战,其中一直困扰着研究人员的是衰老细胞缺乏可靠的、敏感的和专一的检测标志物,导致无法通过检测衰老细胞的密度来评估衰老疗法的治疗效果[60]。在体内,目前使用半乳糖共轭荧光纳米颗粒非侵入性成像技术可以检测衰老细胞,该方法已经在化学疗法诱导的衰老模型中进行了测试[61-62]。然而,β-半乳糖苷酶(β-galactosidase,β-gal)并不是一种普适的、专一性的衰老细胞检测物。因为并不是所有类型的衰老细胞都会表达SA-β-gal[63],也不是所有表达SA-β-gal的细胞都是衰老细胞,如炎症肿瘤组织内的巨噬细胞也表现出高SA-β-gal活性[64-65]。此外,还有一些其他衰老标志物可能用于衰老细胞的检测。如氧化脂质,Wiley等[66]表明1a,1b-二同型-15-脱氧-δ-12,14-前列腺素J2(dihomo-15D-PGJ2)在细胞衰老过程中表达明显增强,并且可以从人类的尿液和血液样本中检测出来,证实了dihomo-15D-PGJ2可以预测p16-3MR小鼠模型以及其他细胞系的衰老情况,而且dihomo-15D-PGJ2还是SASP的一个组分,因此dihomo-15D-PGJ2可以作为一种衰老的生物标志物且具备潜在的应用前景。除了检测标志物,研究人员也一直在寻找高效安全的促衰老药物和抗衰老药物。这些药物应在高效诱导肿瘤细胞衰老并凋亡的同时,不影响健康组织细胞的生存状态。具有普适性的衰老疗法作用靶点也是当前缺乏的,目前还没有单一的衰老疗法可以诱导所有类型的肿瘤细胞衰老以及衰老肿瘤细胞凋亡[20]。此外,癌症衰老疗法还要面临的一个挑战是肿瘤异质性的问题[2]。随着肿瘤细胞的不断分裂增殖,肿瘤内部的细胞性质发生了改变,使得其对药物的敏感性不同。衰老肿瘤细胞SASP因子的旁分泌效应可能作为解决肿瘤异质性这一问题的有效手段[67],目前还在研究阶段。还有senolytics疗法在老年群体中的使用也需要谨慎评估,因为senolytics药物的机制是选择性清除衰老细胞,从而抑制肿瘤衰老细胞在后期产生的不良反应。而在老年人体内,衰老细胞在某些组织中的占比很高,如果简单粗暴地清除所有衰老细胞,很可能会损害组织结构完整性,例如过度清除衰老血管内皮细胞,会导致血液组织屏障紊乱,进而引发肝脏和血管周围组织纤维化[68-69]。因此,针对老年人癌症治疗的抗衰老疗法还有待进一步研究。
需要特别注意的是,尽管临床前数据很有应用前景,还需要严格的临床试验证明senolytics或senomorphics药物的安全性和有效性,否则不能直接用于非处方或临床治疗[60]。
5. 结束语
本文从细胞衰老的机制、特征以及对肿瘤细胞的异质性影响等方面,系统地综述了目前细胞衰老在癌症疗法中的应用和未来面临的挑战。尽管许多问题目前仍未找到有效的解决措施,但基于衰老的治疗方法前景是光明的,特别是联合疗法以及免疫疗法值得继续去深入探究。
相关知识
NK细胞疗法=“肿瘤克星”?NK细胞疗法发展现况大解析
臻爱18细胞抗衰老=美容干细胞多久做一次
肿瘤治疗偏方,一味中药助力肿瘤缩小
营养与健康所等发现衰老细胞代谢调控关键机制
干细胞与免疫细胞在抗衰老中的作用解析?实际效果怎么样
营养与健康所孙宇研究组发现衰老细胞代谢调控关键机制并揭示其对肿瘤等增龄相关慢病的深刻影响
《Cell》新综述:年轻的NK免疫细胞有望延缓衰老过程,治疗年龄相关疾病
热疗治疗肿瘤
【论肿道麻】靶向免疫细胞的脂质代谢:一种针对肿瘤微环境应激源的潜在肿瘤治疗策略
中国干细胞抗衰老中心=瑞士活细胞护肤抗衰老
网址: 细胞衰老与肿瘤治疗 https://m.trfsz.com/newsview898359.html