肿瘤微环境(Tumor Microenvironment, TME)中T细胞效应功能的丧失是肿瘤进展和免疫治疗失败的主要原因之一【1-2】。近期研究发现,CD8+TILs中存在线粒体-内质网耦连增强的现象【3】,这一结果提示细胞器互作和代谢适应在重编程T细胞功能和命运中的重要性【4】。然而,目前这种细胞器相互作用是如何调控肿瘤浸润性CD8+ T细胞功能的生物学机制尚不清楚。
2023年9月22日,中山大学韩辉,高嵩和北京大学白凡共同通讯在Science Immunology(IF=25)在线发表题为“Mitochondria-ER contact mediated by MFN2-SERCA2 interaction supports CD8+ T cell metabolic fitness and function in tumors”的研究论文,该研究展示了线粒体融合素-2(MFN2)的表达与多种癌症的预后呈正相关。在CD8+ T细胞中遗传消融Mfn2抑制了线粒体代谢和功能,促进了肿瘤的发展。

研究者首先利用SYSUCC肾透明细胞癌(ccRCC)队列,发现CD8+TILs中MFN2高表达的患者预后更好,该结论在其它癌种中也得到证实。通过分选ccRCC中CD8+TILs进行单细胞测序和实验验证,发现MFN2在CD8+T细胞激活后表达上调,并与更强的效应功能和线粒体氧化磷酸化能力相关,这一现象在非小细胞肺癌和结直肠癌中也得到证实,进一步发现AP-1 通路参与介导CD8+T细胞激活后MFN2表达的上调。
为了深入验证MFN2对T细胞抗肿瘤功能的影响,研究者构建了T细胞中特异性敲除MFN2的条件性敲除小鼠(Mfn2flox/floxCD4Cre, CKO小鼠),利用皮下成瘤模型进行功能实验并分选CD8+TILs进行单细胞测序,分析MFN2对CD8+T细胞抗肿瘤免疫功能的影响。结果发现,MFN2敲除后,T细胞在肿瘤微环境中的效应功能、增殖和存活明显受损,对anti-PD-1治疗无应答,证明MFN2在维持体内CD8+T细胞抗肿瘤功能中的重要作用(图1)。
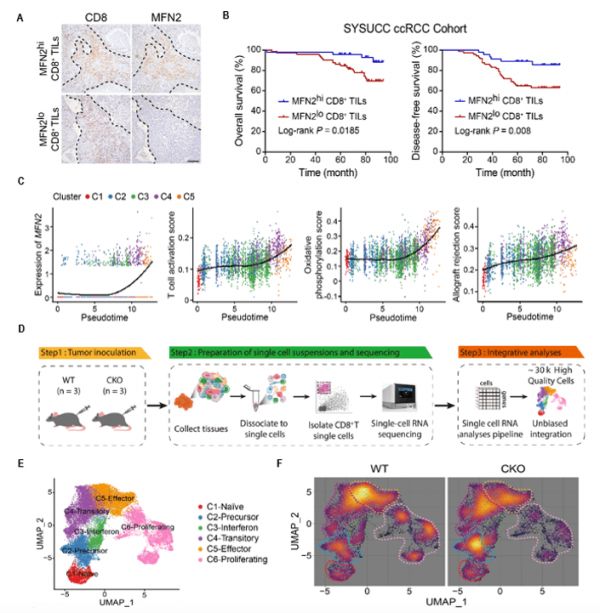 图1.临床特征与单细胞测序揭示MFN2与患者预后和CD8+ TILs功能关联
图1.临床特征与单细胞测序揭示MFN2与患者预后和CD8+ TILs功能关联
接着研究者通过转录组测序发现,MFN2敲除后线粒体氧化磷酸化和脂肪酸氧化代谢通路显著受到抑制。进一步代谢实验证明,MFN2敲除后主要损害线粒体利用脂肪酸作为底物氧化产生能量的能力。MFN2敲除后CD8+T细胞长期下调的线粒体代谢功能导致其抗肿瘤功能受到损害(图2)。
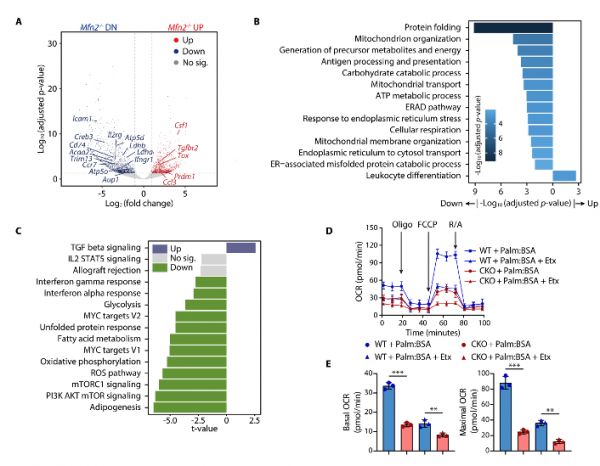 图2.MFN2敲除影响线粒体代谢功能损害CD8+T细胞抗肿瘤功能
图2.MFN2敲除影响线粒体代谢功能损害CD8+T细胞抗肿瘤功能
紧接着研究者研究了MFN2敲除(Mfn2-/-)TILs线粒体代谢功能受损的机制。既往研究发现MFN2通过介导线粒体融合或线粒体-内质网耦连来调节线粒体代谢。利用三维超高分辨率共聚焦显微镜(3D-SIM)和透射电镜,研究者发现在Mfn2-/- CD8+TILs中,线粒体融合未受明显影响,而线粒体-内质网耦连显著下降。已知线粒体-内质网耦连能够促进Ca2+离子向线粒体转运,激活线粒体有氧代谢功能。
作者发现Mfn2-/- CD8+TILs中线粒体 Ca2+水平明显降低;利用Ru360降低线粒体Ca2+水平可显著抑制CD8+TILs的线粒体代谢和效应功能。这些结果初步表明,MFN2介导的线粒体-内质网耦连以及由此导致的线粒体Ca2+内流对于CD8+ TILs的线粒体代谢和效应功能起着重要作用。
研究者进一步探究了MFN2经典的促线粒体融合功能在CD8+ TILs中不占主导作用的原因。T细胞被肿瘤抗原激活后发生克隆增殖,而分裂的线粒体是T细胞增殖所需。作者发现T细胞活化后DRP1介导的线粒体分裂机器也随之激活,抵消了MFN2的线粒体融合效果,从而使T细胞依赖MFN2介导的线粒体-内质网耦连来维持线粒体良好的有氧代谢功能(图3)。
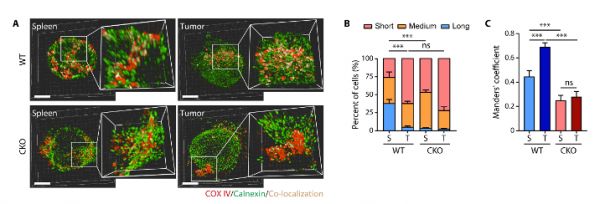 图3.MFN2介导线粒体-内质网耦连调节线粒体代谢
图3.MFN2介导线粒体-内质网耦连调节线粒体代谢
MFN2介导线粒体-内质网耦连的机制仍不清楚。既往研究指出,MFN2可能存在内质网定位,内质网上的MFN2负责介导该过程。为了探究其背后的分子机制,作者首先进行细胞组分分析实验,发现T细胞内质网上并无MFN2。
为了深入研究其背后分子机制,作者在昆虫细胞中过表达全长MFN2蛋白并与T细胞裂解物孵育,利用Pulldown实验联用LC-MS/MS蛋白组技术鉴定了MFN2在内质网上潜在的互作蛋白—SERCA2;随后应用免疫共沉淀、邻近连接(PLA)试验、活细胞3D成像、体外蛋白Pulldown实验等技术手段,证实了MFN2和SERCA2的相互作用。研究者发现MFN2-SERCA2互作受MFN2 GTP酶活性和构象变化的影响:MFN2点突变R94Q失去与SERCA2互作能力,而点突变R259A却仍保留了该作用(图4)。
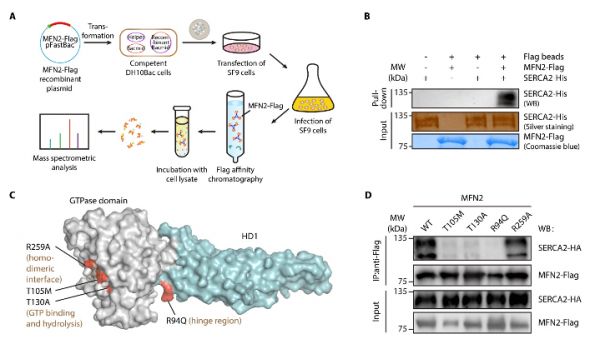 图4.MFN2通过与SERCA2互作介导线粒体-内质网耦连
图4.MFN2通过与SERCA2互作介导线粒体-内质网耦连
作者进一步深入研究MFN2-SEACA2互作的生物学意义。通过体内外酶活实验和脂质体GUV实验,研究者发现,MFN2与SERCA2的互作可刺激SERCA2的Ca2+-ATP酶活性,从而将线粒体-内质网连接处的Ca2+回收到内质网,避免线粒体内Ca2+过载,维持细胞线粒体钙稳态,避免T细胞凋亡。应用线粒体-内质网连接肽(mito-ER linker)模拟SERCA2-MFN2在线粒体-内质网耦连中的物理连接作用,作者发现相比野生型T细胞,Mfn2-/- T细胞予mito-ER linker回补线粒体-内质网耦连后线粒体Ca2+显著过载,细胞凋亡增加,抗肿瘤功能下降。
最后,利用OT-I背景的Mfn2-/- T细胞进行慢病毒过表达回补和尾静脉回输,并结合MFN2具有不同SERCA2蛋白互作能力的点突变(特别是R94Q和R259A),作者深入论证了MFN2-SERCA2互作介导的线粒体-内质网耦连和线粒体Ca2+内流对T细胞抗肿瘤功能的重要意义(图5)。
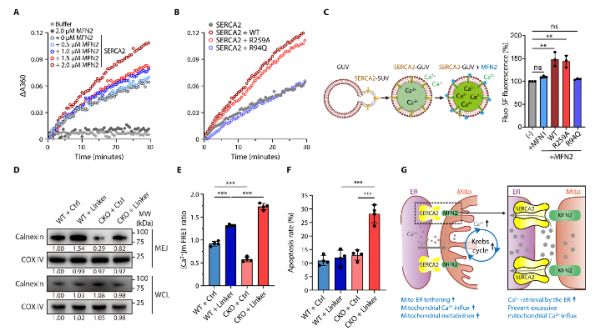 图5.MFN2-SERCA2互作介导线粒体-内质网耦连和线粒体Ca2+内流影响T细胞抗肿瘤功能
图5.MFN2-SERCA2互作介导线粒体-内质网耦连和线粒体Ca2+内流影响T细胞抗肿瘤功能
鉴于MFN2对肿瘤微环境中CD8+T细胞的重要作用,作者探索靶向T细胞中MFN2的治疗价值。利用原代肿瘤细胞制备的条件培养基(CM)模拟肿瘤微环境的营养条件,研究者发现CM可损害CD8+T细胞的MFN2表达、线粒体-内质网耦连、生存、线粒体代谢和效应功能;过表达MFN2则可增强CD8+T细胞对CM的适应能力。利用抗原特异性CD8+T细胞回输重建免疫的肾透明细胞癌PDX(Patient-derived xenografts)小鼠、OT-I小鼠和C57BL/6小鼠模型,研究者发现靶向T细胞中MFN2可显著增强T细胞的抗肿瘤功能,改善anti-PD-1治疗的疗效。

综上所述,本文通过临床标本验证、单细胞测序、转基因小鼠模型、细胞生物学和生化实验等多种技术手段,深入论证了MFN2-SERCA2互作介导的线粒体-内质网细胞器互作对CD8+T细胞在肿瘤微环境中代谢适应和发挥抗肿瘤功能的重要作用,初步揭示了线粒体-内质网耦连潜在的分子机制。这些发现共同揭示了MFN2在调控CD8+ T细胞的代谢、功能和存活方面的关键作用,并表明增强MFN2的表达是改善免疫疗法的一种有意义的途径。这些研究成果可能有助于我们更好地理解肿瘤免疫学,并为癌症患者的治疗提供新的策略。
中山大学肿瘤防治中心、华南肿瘤学国家重点实验室高嵩教授和韩辉教授,北京大学生物医学前沿创新中心(BIOPIC)、生命科学学院白凡教授为论文的共同通讯作者。中山大学肿瘤防治中心杨杰锋博士、罗丽博士,北京大学生物医学前沿创新中心博士后邢旭东博士,中山大学附属第一医院研究生周昕炜为本文并列第一作者。
论文链接:
https://www.science.org/doi/10.1126/sciimmunol.abq2424
参考文献:
【1】Wolchok, J. et al. (2021) Checkpoint blockade: The end of the beginning. Nat. Rev. Immunol. 21, 621
【2】Hegde, P. et al. (2020) Top 10 challenges in cancer immunotherapy. Immunity 52, 17ty
【3】Yu, Y. et al. (2020) Disturbed mitochondrial dynamics in CD8+ TILs reinforce T cell exhaustion. Nature Immunology 21(12), 1540-1551
【4】 DePeaux, K. et al. (2021) Metabolic barriers to cancer immunotherapy. Nat. Rev. Immunol. 21, 785. Im返回搜狐,查看更多