一种全天然碳源覆盆子酮的制备方法与流程
本发明涉及精细化工领域,特别涉及一种全天然碳源覆盆子酮的制备方法。
背景技术:
覆盆子酮(式1),又名悬钩子酮、树莓酮(raspberryketone),化学名为4-对羟基苯基-2-丁酮,由日本nomura等人于1918年发现,1957年被确认为覆盆子中的主要香味物质,其在覆盆子汁中含量极低,仅约0.1×10-6~0.2×10-6(化工技术与开发,2006,35(9):21-23;biotechnol.j.2007,2,1270–1279)。
覆盆子酮是一种经过美国食用香料制造者协会(fema)和欧洲理事会(coe)共同认可使用的安全食用香料,其fema编号为2588(香料香精化妆品,2015,(1):63-65)。gb2760-1996中规定覆盆子酮作为食用香料用量为40~320mg/kg,可用于覆盆子、葡萄、菠萝、桃子、李子、草莓、红莓子、茉莉、栀子、晚香玉等香型香精的配制,亦可作为修饰剂或定香剂,大量用于日用香料、食品香料、日化香精和烟用香精中,已成为仅次于香兰素的一种具有极高经济价值的香料。同时,覆盆子酮也是重要的精细化学品中间体。在化妆品行业中,覆盆子酮具有美白作用,可添加到美白化妆品中。在农业中,覆盆子酮及其乙酰化合物是果蝇的性引诱剂,亦称性信息素,作为农药的需求量越来越大,远远超过食品和化妆品中用量(化工技术与开发,2006,35(9):21-23)。在医药行业中,因覆盆子酮具有消炎的功效,可将其添加到药物中。覆盆子酮与没食子酸表儿茶素的组合物可用于预防、治疗肥胖或如非胰岛素依赖型糖尿病型和综合症等与肥胖相关的症状。覆盆子酮和伯胺生成的希夫碱是用于治疗心肌收缩力衰弱的β-肾上腺素受体激动药多巴酚丁胺的中间体(乙醛醋酸化工,2014,(9):12-19)。
覆盆子酮的化学合成方法主要有以下四种:1)苯酚-丁醇酮法;2)苯酚-甲基乙烯酮法;3)对羟基苯甲醛-丙酮缩合-加氢还原法;4)对甲氧基苄氯-乙酰乙酸乙酯法。但这些合成方法需要使用大量酸碱和强毒性物质,存在腐蚀设备、污染环境、后处理困难、收率低等问题(乙醛醋酸化工,2014,(9):12-19)。
由于覆盆子植物资源有限且其天然含量极低,依靠天然提取无法实现覆盆子酮的规模化供应。而目前化学合成方法大都是基于石油化工原料。鉴于国际市场日益青睐天然香料产品,天然覆盆子酮(或覆盆子酮天然等同物)价格比以石化原料合成的产品高出10倍以上(香料香精化妆品,2013,(s1):39-41)。因此,基于天然可再生资源制备全天然碳源覆盆子酮(即覆盆子酮天然等同物)并实现产业化具有重要意义,一方面有望实现良好的经济效益,同时有望减少对化石资源的依赖和消耗,降低碳排放,取得积极的社会和环境效益。
技术实现要素:
本发明的目的在于克服现有技术中存在的缺点,提供一种环境友好、收率高、工艺简单的全天然碳源覆盆子酮的制备方法。
本发明的目的通过下述技术方案实现:
一种全天然碳源覆盆子酮的制备方法,是采用天然来源的对甲氧基苯甲醛为原料,经脱甲基反应制备得到对羟基苯甲醛(式2);然后与生物质来源的乙酰乙酸乙酯经knoevenagel缩合反应得(e/z)-2-乙酰基-3-(4-羟基苯基)丙烯酸乙酯(式3);再经氢化得2-乙酰基-3-(4-羟基苯基)丙酸乙酯(式4);最后经水解反应、脱羧反应,制备得到覆盆子酮(式1)。具体包括下述步骤:
(1)对羟基苯甲醛的制备:对甲氧基苯甲醛(式5)、溶剂a和脱甲基试剂,在惰性气体氛围下进行搅拌反应,然后加入水,析出固体,过滤,干燥,得到对羟基苯甲醛(式2);
(2)(e/z)-2-乙酰基-3-(4-羟基苯基)丙烯酸乙酯的制备:将乙酰乙酸乙酯、对羟基苯甲醛、酸b、碱b及溶剂b依次加入到反应瓶中,装上分水装置,搅拌反应,然后冷却,加入溶剂c稀释反应液,用碱c的水溶液提取反应液,取水相,所得水相用酸c酸化至ph≤4,有固体析出,过滤,干燥,得到(e/z)-2-乙酰基-3-(4-羟基苯基)丙烯酸乙酯(式3);
(3)2-乙酰基-3-(4-羟基苯基)丙酸乙酯的制备:将(e/z)-2-乙酰基-3-(4-羟基苯基)丙烯酸乙酯溶于溶剂d中,加入催化剂,在氢气氛围下进行反应,然后过滤回收催化剂,滤液浓缩,得到2-乙酰基-3-(4-羟基苯基)丙酸乙酯(式4)。
(4)覆盆子酮的制备:将2-乙酰基-3-(4-羟基苯基)丙酸乙酯溶于溶剂e中,加入碱d的水溶液,加热搅拌进行水解反应;然后加入酸d,搅拌进行脱羧反应,再用溶剂f萃取,干燥,浓缩,得到覆盆子酮粗品,经重结晶得到覆盆子酮(式1)精品。
步骤(1)中,所述溶剂a是二氯甲烷、氯仿、四氢呋喃、乙腈、1,2-二氯乙烷、冰乙酸或无溶剂;所述脱甲基试剂是氢碘酸、氢溴酸、盐酸、三溴化硼、三氯化铝、三溴化铝、三碘化铝、乙硫醇钠、氨基钠、吡啶盐酸盐或三甲基碘硅烷;反应温度为0~160℃;反应时间为1~16h;所述对甲氧基苯甲醛和脱甲基试剂的摩尔比为1∶(1.1~8)。所述惰性气体为氮气。
更加优选地,步骤(1)所述溶剂a是二氯甲烷或无溶剂;所述脱甲基试剂是吡啶盐酸盐;所述反应温度为140℃,反应时间是12h,所述对甲氧基苯甲醛和脱甲基试剂的摩尔比为1∶4。
步骤(2)中,所述酸b是冰乙酸、甲酸、苯甲酸、苯乙酸、丙酸、丁酸或不加酸;所述碱b是哌啶、四氢吡咯、吡啶、1,6-二甲基吡啶或吡咯;所述溶剂b是环己烷、甲苯、苯、乙醇或甲醇;所述溶剂c是乙酸乙酯、二氯甲烷、氯仿或乙醚;所述碱c是氢氧化钠、氢氧化钾、碳酸钾或碳酸钠;所述酸c是盐酸或硫酸;反应温度为70~120℃,反应时间为4~24h;乙酰乙酸乙酯、对羟基苯甲醛、酸b和碱b的摩尔比为1∶(0.8~1.2)∶(0.5~1.5)∶1。
更加优选地,步骤(2)所述酸b是冰乙酸;所述碱b是哌啶;所述溶剂b是甲苯;所述溶剂c是乙酸乙酯;所述碱c是氢氧化钠;所述酸c是盐酸;所述的反应温度为110℃;反应时间为12h;所述乙酰乙酸乙酯和对羟基苯甲醛的摩尔比为1∶1。
步骤(3)中,所述溶剂d是甲醇或乙醇;所述催化剂是钯碳、雷氏镍、甲酸镍或铂;反应温度为0~60℃,反应时间为2~24h;所述(e/z)-2-乙酰基-3-(4-羟基苯基)丙烯酸乙酯和催化剂的重量比为1∶(0.02~0.4)。
更加优选地,步骤(3)所述溶剂d是甲醇;所述催化剂是钯碳。所述的反应温度为25℃,反应时间为12h;所述(e/z)-2-乙酰基-3-(4-羟基苯基)丙烯酸乙酯和催化剂的重量比为1∶0.1。
步骤(4)中,所述溶剂e是甲醇、乙醇、异丙醇中的一种或其中一种与水的混合溶液;所述碱d是氢氧化钠、氢氧化钾或氢氧化锂溶液,质量浓度为5%~20%;所述酸d是盐酸、硫酸或磷酸;所述溶剂f是乙酸乙酯或二氯甲烷;水解反应的时间是1~12h,反应温度为0~100℃;脱羧反应的时间是1~12h,反应温度为0~100℃;所述2-乙酰基-3-(4-羟基苯基)丙酸乙酯、碱d和酸d的摩尔比为1∶(1.1~6)∶(1.1~10)。
更加优选地,步骤(4)所述溶剂e是乙醇、甲醇、40%-98%的乙醇水溶液或40%-98%的甲醇水溶液;所述碱d是氢氧化钾;所述酸d是盐酸;所述溶剂f是乙酸乙酯;水解反应的时间是3h,反应温度为80℃;脱羧反应的时间是2h,反应温度为80℃;所述2-乙酰基-3-(4-羟基苯基)丙酸乙酯、碱d和酸d的摩尔比为1∶(1.1~6)∶(1.1~7)。
本发明涉及的化学反应式如下:
本发明采用的对甲氧基苯甲醛是天然来源,是以八角脂溶性组份茴香脑为原料,经氧化反应得到的对甲氧基苯甲醛,具体反应过程参见:中国发明专利zl200810028683.6;zl200810198265.1。
本发明采用的乙酰乙酸乙酯是生物质来源,即指以生物质来源的乙酸乙酯经缩合反应得到的乙酰乙酸乙酯,具体反应过程参见:有机化学实验第2版高等教育出版社。
与现有技术相比,本发明具有如下有益效果:
(1)本发明步骤简捷,操作简便,收率较高,易于规模化实施。
(2)本发明所有原料均来自于天然资源,环境友好,可得到具有高天然度的覆盆子酮。
附图说明
图1为覆盆子酮的核磁共振氢谱(400mhz,dmso-d6);
图2为覆盆子酮的核磁共振碳谱(400mhz,dmso-d6)。
具体实施方式
下面结合实施例对本发明做进一步详细的描述,但本发明的实施方式不限于此。
实施例1:对羟基苯甲醛(式2)的制备
往50ml烧瓶中,分别加入对甲氧基苯甲醛(1g,7.35mmol),二氯甲烷(10ml),新制吡啶盐酸盐(3.38g,29.4mmol),于氮气氛围及140℃下搅拌反应12h,反应毕冷却,加入水(30ml),冷却,析出固体,过滤,干燥得对羟基苯甲醛(式2,0.73g,收率:82%)。
结构表征:1hnmr(400mhz,dmso-d6):δ=6.93(d,j=8.8hz,2h),7.76(d,j=8.8hz,2h),9.79(s,cho,1h),10.59(s,oh,1h)。13cnmr(100mhz,dmso-d6):δ=191.4,163.8,132.6,128.9,116.3。
实施例2:对羟基苯甲醛(式2)的制备
往50ml烧瓶中,分别加入对甲氧基苯甲醛(1g,7.35mmol),1,2-二氯乙烷(15ml),三氯化铝(3.91g,29.4mmol),于60℃下搅拌反应4h,冷却,加入水(30ml),搅拌,冷却,析出固体,过滤,干燥得对羟基苯甲醛(式2,0.7g,收率:78%)。
实施例3:对羟基苯甲醛(式2)的制备
往50ml烧瓶中,分别加入对甲氧基苯甲醛(2.29g,16.85mmol),冰乙酸(2.7g),48%氢溴酸(9g,53.39mmol),于130℃下搅拌反应4h,浓缩反应液,加入水(30ml),搅拌,冷却,析出固体,过滤,干燥得对羟基苯甲醛(式2,1.5g,收率:73%)。
实施例4:对羟基苯甲醛(式2)的制备
往50ml烧瓶中,分别加入对甲氧基苯甲醛(1g,7.35mmol),新制吡啶盐酸盐(4.0g,34.6mmol),于氮气氛围及140℃下搅拌反应12h,反应毕冷却,加入水(30ml),冷却,析出固体,过滤,干燥得对羟基苯甲醛(式2,0.76g,收率:85%)。
实施例5:(e/z)-2-乙酰基-3-(4-羟基苯基)丙烯酸乙酯(式3)的制备
将乙酰乙酸乙酯(2.86g,22mmol)、对羟基苯甲醛(2.68g,22mmol)、冰乙酸(0.132g,2.2mmol)、哌啶(0.187g,2.2mmol)分别加入到装有甲苯(50ml)的反应瓶中,装上分水装置,于110℃下反应12h,冷却,加入乙酸乙酯(100ml)稀释反应液,加入20%的氢氧化钠水溶液至ph=11,分出水相,继续用水萃洗有机相2次(2×20ml),所得水相合并,用盐酸酸化至ph=3,析出固体,抽滤,干燥得(e/z)-2-乙酰基-3-(4-羟基苯基)丙烯酸乙酯(式3,4.37g,收率:85%)。
结构表征:1hnmr(400mhz,dmso-d6):δ=10.3(s,oh,1h),7.6(s,1h),7.3-7.5(m,2h),6.8-6.9(m,2h),4.2-4.3(q,j=7.1hz,2h),2.3-2.4(d,j=10.1hz,3h),1.2-1.3(dd,j=8.1,6.2hz,3h)。(z/e=1:4)
实施例6:(e/z)-2-乙酰基-3-(4-羟基苯基)丙烯酸乙酯(式3)的制备
将乙酰乙酸乙酯(2.86g,22mmol)、对羟基苯甲醛(2.68g,22mmol)、冰乙酸(0.132g,2.2mmol)、哌啶(0.187g,2.2mmol)分别加入到装有苯(50ml)的反应瓶中,装上分水装置,于80℃下反应10h,冷却,加入乙酸乙酯(100ml)稀释反应液,加入20%的氢氧化钠水溶液至ph=11,分出水相,继续用水萃洗有机相2次(2×20ml),所得水相合并,用盐酸酸化至ph=3,析出固体,抽滤,干燥得(e/z)-2-乙酰基-3-(4-羟基苯基)丙烯酸乙酯(式3,4.5g,收率:87%)。
实施例7:(e/z)-2-乙酰基-3-(4-羟基苯基)丙烯酸乙酯(式3)的制备
将乙酰乙酸乙酯(2.86g,22mmol)、对羟基苯甲醛(2.68g,22mmol)、吡啶(1.738g,22mmol)分别加入到装有甲苯(50ml)的反应瓶中,装上分水装置,于120℃下反应12h,冷却,加入乙酸乙酯(100ml)稀释反应液,加入20%的氢氧化钠水溶液至ph=11,分出水相,继续用水萃洗有机相2次(2×20ml),所得水相合并,用盐酸酸化至ph=3,析出固体,抽滤,干燥得(e/z)-2-乙酰基-3-(4-羟基苯基)丙烯酸乙酯(式3,4.1g,收率:79%)。
实施例8:2-乙酰基-3-(4-羟基苯基)丙酸乙酯(式4)的制备
将(e/z)-2-乙酰基-3-(4-羟基苯基)丙烯酸乙酯(4.68g,0.02mol),溶于meoh(50ml)中,加10%pd/c(0.47g),用氢气置换瓶内空气三次,于氢气氛围及25℃下反应12h,过滤回收钯碳,滤液浓缩,得2-乙酰基-3-(4-羟基苯基)丙酸乙酯(式4,4.7g,收率:99%)。
结构表征:1hnmr(400mhz,dmso-d6):δ=9.19(s,oh,1h),6.99(d,j=8.5hz,2h),6.65(d,j=8.5hz,2h),4.05(qd,j=7.1,2.7hz,2h),3.90(dd,j=8.7,6.7hz,1h),2.92(qd,j=14.1,7.7hz,2h),2.15(s,3h),1.11(t,j=7.1hz,3h)。13cnmr(100mhz,dmso-d6):δ=203.3,169.4,156.3,130.1,128.6,115.5,61.2,32.9,29.7,14.3。
实施例9:2-乙酰基-3-(4-羟基苯基)丙酸乙酯(式4)的制备
将(e/z)-2-乙酰基-3-(4-羟基苯基)丙烯酸乙酯(4.68g,0.02mol),溶于乙醇(50ml)中,加10%pd/c(0.25g),用氢气置换瓶内空气三次,于氢气氛围及25℃下反应24h,过滤回收钯碳,滤液浓缩,得2-乙酰基-3-(4-羟基苯基)丙酸乙酯(式4,4.7g,收率:99%)。
实施例10:2-乙酰基-3-(4-羟基苯基)丙酸乙酯(式4)的制备
将(e/z)-2-乙酰基-3-(4-羟基苯基)丙烯酸乙酯(4.68g,0.02mol),溶于甲醇(50ml)中,加10%pd/c(0.94g),用氢气置换瓶内空气三次,于氢气氛围及25℃下反应8h,过滤回收钯碳,滤液浓缩,得2-乙酰基-3-(4-羟基苯基)丙酸乙酯(式4,4.7g,收率:99%)。
实施例11:覆盆子酮(式1)的制备
将2-乙酰基-3-(4-羟基苯基)丙酸乙酯(2.36g,0.01mol)溶于乙醇(20ml)中,添加10%的氢氧化钾溶液(20ml,35mmol),80℃反应3h,冷却;然后滴加浓盐酸(5.8ml,70mmol),80℃下搅拌反应2h,冷却,乙酸乙酯萃取(30ml×3),干燥,过滤,浓缩,得覆盆子酮粗品,经重结晶得覆盆子酮(式1,1.48g,收率:90%)。
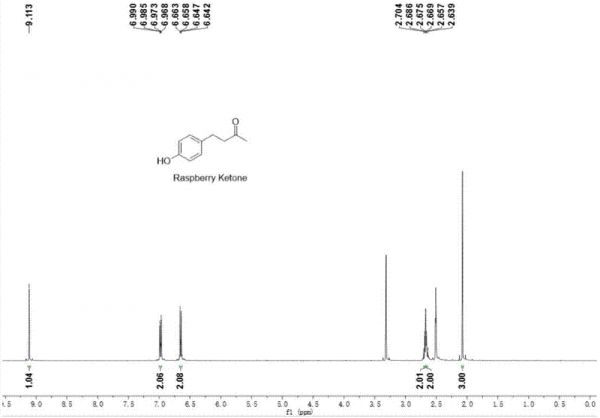
熔点:82-83℃,结构表征:1hnmr(400mhz,dmso-d6):δ=9.11(s,oh,1h),7.00–6.96(m,2h),6.68–6.63(m,2h),2.68(d,j=4.4hz,2h),2.66(d,j=4.5hz,2h),2.08(s,3h)。13cnmr(100mhz,dmso-d6):δ=208.34,155.87,131.60,129.47,115.52,45.08,30.22,28.81。
实施例12:覆盆子酮(式1)的制备
将2-乙酰基-3-(4-羟基苯基)丙酸乙酯(2.36g,0.01mol)溶于乙醇(15ml)中,添加20%氢氧化钾水溶液(10ml,35mmol),80℃反应2h,冷却,滴加浓盐酸(5.8ml,70mmol),80℃下搅拌反应2h,冷却,乙酸乙酯萃取(30ml×3),干燥,浓缩,得覆盆子酮粗品,经重结晶得覆盆子酮(式1,1.4g,收率:85%)。
实施例13:覆盆子酮(式1)的制备
将2-乙酰基-3-(4-羟基苯基)丙酸乙酯(2.36g,0.01mol)溶于50%甲醇的水溶液(10ml)中,添加20%氢氧化钠水溶液(10ml,50mmol),80℃反应3h,冷却,滴加浓盐酸(5.8ml,70mmol),80℃下搅拌反应2h,冷却,乙酸乙酯萃取(30ml×3),干燥,浓缩,得覆盆子酮粗品,经重结晶得覆盆子酮(式1,1.38g,收率:84%)。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所做的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
相关知识
一种全天然碳源覆盆子酮的制备方法与流程
一种高纯度覆盆子酮的合成方法与流程
一种香料覆盆子酮的制备方法
覆盆子酮的制备
覆盆子酮,又称为覆盆子苷或树莓酮,是一种天然化合物
覆盆子酮(树莓酮)
覆盆子酮 森弗源头工厂热销覆盆子酵素粉 现货包邮 覆盆子提取物
天然活性成分覆盆子酮的低成本制备方法及其功效评价
覆盆子提取物 覆盆子酮5% 覆盆子黄酮 树莓酮 森元
✨每天一个美白成分✨覆盆子酮✨
网址: 一种全天然碳源覆盆子酮的制备方法与流程 https://m.trfsz.com/newsview1309324.html