微创肾部分切除术和小肾肿瘤消融术
Minimally Invasive Partial Nephrectomy and Ablative Procedures for Small Renal Masses
Cite this chapter
Shepherd, S.T., Parkhomenko, E., Wang, D.S. (2020). Minimally Invasive Partial Nephrectomy and Ablative Procedures for Small Renal Masses. In: Libertino, J., Gee, J. (eds) Renal Cancer. Springer, Cham. https://doi.org/10.1007/978-3-030-24378-4_14
微创肾部分切除术和小肾肿瘤消融术
横断面影像学检查利用率的增加导致小肾肿瘤 (SRM) 的发生率增加。反过来,已经采用腹腔镜检查和消融等肾单位保留技术来降低传统开放性肾切除术的发病率。最突出的是,腹腔镜肾部分切除术现在被认为是SRM<4 cm的金标准治疗。腹腔镜手术本身也用于机器人手术。患者体位、通路选择、肺门钳夹和肿瘤切除的技术因外科医生而异。假性动脉瘤和尿漏等并发症尽管技术有所改进,但术后仍有风险。其他治疗方式,如消融治疗,开始取得进展,但尚未成为主流治疗。此外,使用肾肿块活检可能会影响未来个性化 SRM 管理的指南。最后,成像技术的未来发展可能有助于识别和分离SRM最安全的手术方法。
介绍
计算机断层扫描(CT)和磁共振成像(MRI)在21世纪问世,导致对小肾肿瘤 (SRM)等偶然发现的识别增加[1]。传统上,横断面影像学检查中的造影剂增强肾肿块采用根治性肾切除术治疗。为了适应 SRM 发病率的增加,并降低根治性肾切除术的发病率,肾单位保留技术(如肾部分切除术 (PN) 和消融治疗)有所增加。PN为T1-T2肾肿瘤提供了可比较的肿瘤学结局,同时保留了肾实质并降低了心血管事件的发生率。美国泌尿外科协会(AUA)目前建议对肾肿块进行PN<4 cm [5]。微创肾部分切除术(MIPN)的初始适应证仅限于SRM,但改进的技术和技能组合已经发展到包括更复杂的病变[6]。其他肾单位节用手术也可在不影响肿瘤学结局的情况下进行[7,8]。技术和组织学评估的改进通过肾活检影响了手术方法。此外,增强现实和虚拟现实形式的技术进步开始进入手术室并改善术前。在本章中,我们提供了腹腔镜检查和机器人辅助腹腔镜检查,消融技术以及相关并发症的微创手术技术的最新信息。
腹腔镜肾部分切除术
患者选择(腹腔镜肾部分切除术 (LPN)
有几个因素影响腹腔镜肾部分切除术 (LPN)的选择,在选择患者进行微创肾部分切除术 (MIPN) 时应考虑这些因素。当进行腹腔镜肾部分切除术(LPN)以及机器人辅助腹腔镜肾部分切除术(RALPN)时,这些因素是相似的。心脏和肺部疾病等躯体合并症会影响患者对气腹的耐受能力。重症慢性阻塞性肺疾病患者有发生重度高碳酸血症和酸中毒的风险。腹膜充气诱导的腹腔内压升高会传递到胸腔,降低心脏功能。在确定合适的手术方法时,应仔细回顾手术史,因为它可能会影响端口部位的位置。有些病例可能需要广泛的粘连裂解,并可能转化为开放程序。肥胖患者还面临额外的挑战,因为解剖标志点可能会转移[11]Eaton等人明肥胖与术中失血之间存在相关性;然而,术中时间和输血率存在总体差异。LPN可以安全地用于肥胖患者,且发病率不会增加。历来所有患者均给予术前柠檬酸镁肠道制剂以降低潜在感染风险,但有证据表明感染风险或肠功能恢复无差异。根据我们的经验,肠道准备也是首选,因为它提供肠道减压,改善术中可视化。应仔细检查横断面影像学检查,以确定肿瘤位置和与采集系统的接近程度、血管数量和淋巴结肿大。肾脏肾病评分可用于进一步分类肾脏病变复杂性。
患者定位
在对患者进行置位之前,确认患者身份,团队成员,药物问题和手术的侧向性。一旦诱导了全气管内麻醉,作者倾向于进行软性膀胱镜检查,将开放式导管插入同侧输尿管。然后,可以逆行方式注射稀释的亚甲基蓝,以有序识别进入集合系统,并确保充分闭合和防止尿液泄漏。然而,Bove等人发现,使用输尿管导管与不使用导管在尿漏方面没有差异。在经腹膜入路中,将患者置于 45° 修正的侧腹位置,而不是腹膜后入路的全侧腹位置,同侧朝上。桌子的弯曲度最大。然后将手臂放在带衬垫的臂板上并固定到位,以避免臂丛神经损伤。通常使用腋窝卷。对侧下肢弯曲90°,同侧腿伸直,枕头放在两腿之间。所有骨质突出物也都经过精心填充。下肢序贯加压装置适用于所有患者。侧面和肩膀也得到支撑,肩膀,臀部和下肢用毛巾和胶带固定,以防止桌子旋转时移动。头部置于中性位置。在支撑和悬垂患者之前,再次确认侧向性。患者的腹部和胁腹被广泛准备,包括输尿管支架和导尿管,它们用替加麦固定,以便注射亚甲蓝。广泛的准备也允许潜在的转换为开放手术。患者的体位对于预防横纹肌溶解症和神经病变至关重要,尽管仔细注意体位,但已有横纹肌溶解的报道。
访问
经腹膜
如上所述,将患者置于45°修饰的胁腹位置。在脐带和髂前上脊柱之间的中点的直肌同侧边界处做一个 12 mm 的切口。我们更喜欢通过Veress技术获得腹膜内通路;但是,也可以使用哈桑(开放)。气腹达到15mmHg。其余的穿刺器被置于直接视觉下。根据肿瘤的侧向性,在对侧放置一个12mm的肋下端口,供外科医生的手使用。相机端口也使用12毫米穿刺器放置,内侧和尾部到肋下穿刺器。沿腋窝前线为助手放置一个 12 mm 的穿刺器。在右侧肿瘤的情况下,插入5mm的亚氧基穿刺器用于肝脏回缩(图14.1)。
图 14.1
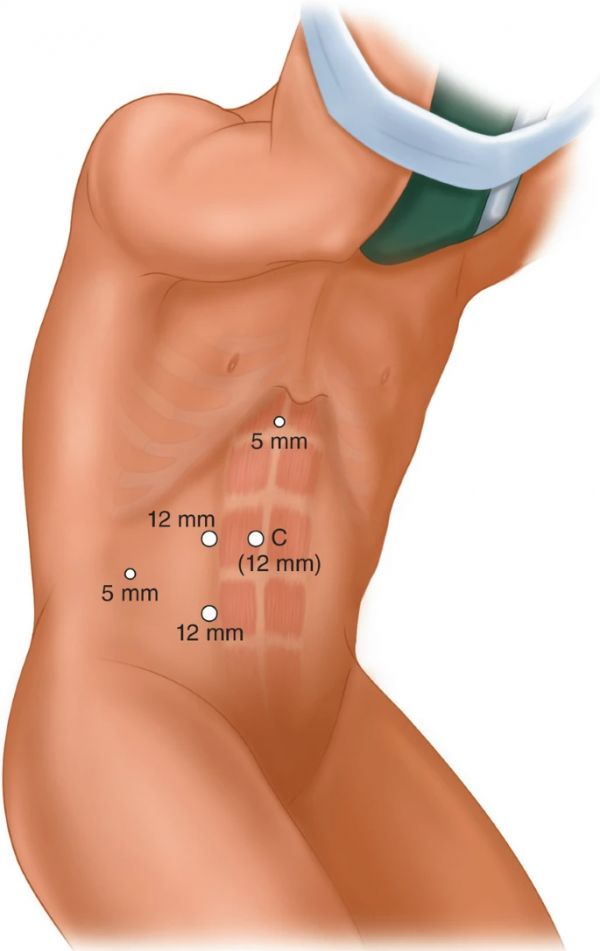
经腹膜腹腔镜肾部分切除术。(原文由作者提交)键:C – 相机端口
腹膜后
在全侧位置,在髂嵴和第12肋骨尖端之间的后腋窝线上做一个12mm的切口,并使用钝解剖创建工作空间;然后通过切口插入钝尖穿刺器。在第 12 肋骨的尖端放置一个 5 mm 端口,在脐带水平沿腋窝线放置一个 12 mm 端口,在中腋窝线上放置一个 12 mm 端口 [ 22 ](图 14.2 )。虽然由于工作空间减少,腹膜后通路在技术上更具挑战性,但它是后部肿瘤的理想选择,并避免了肠损伤的风险,特别是在既往腹部手术的患者中。经腹膜和腹膜后入路已被证明具有相似的结局,包括失血、并发症和术后肌酐 。
图 14.2
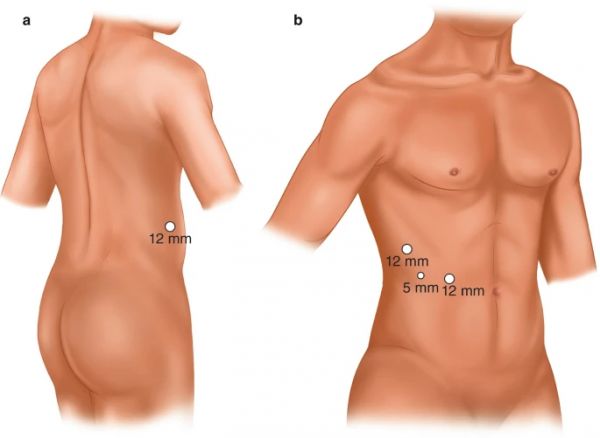
(a-b)腹膜后腹腔镜肾部分切除术。
手动辅助
手部辅助 LPN 允许手部辅助解剖、缝合和止血,同时保持微创手术的美容效果。当外科医生的优势手与肿瘤侧对侧时,为非优势手制造一个脐周工作端口[ 24 ]。然而,在同侧病例中,例如,当右撇子外科医生对右侧肿瘤进行手术时,手切口是在惯用手的同侧下腹进行。为了保存气腹,切口是基于外科医生手的大小。我们的机构使用GelPort腹腔镜系统(应用医学,兰乔圣玛格丽塔,加利福尼亚州)来进一步防止气腹丢失。两个或三个额外的端口可以根据肿瘤位置和外科医生的偏好放置。我们机构为右侧病例放置穿刺器的一个例子如下:将12毫米相机穿刺器放置在脐上方的直肠的侧侧。使用 30 度晶状体确保成功放置初始端口后,在脐带水平上方的尾部下区域、右腋窝中线和右前腋窝线处再放置一个 12 mm 穿刺器。如上所述,手部端口位于右下象限(图 14.3 )。
图 14.3
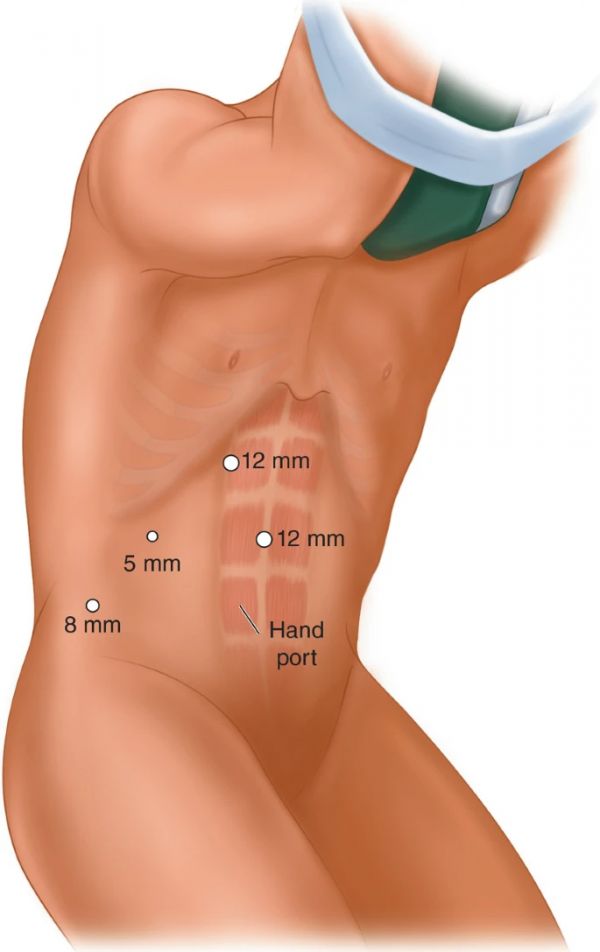
手部辅助腹腔镜肾部分切除术(右)。
程序
获得通路后,经腹膜入路的第一步是结肠的内侧活动(升行或降行)。对于右侧肿瘤,肝脏弯曲被动员,十二指肠被Kocherized。识别性腺血管和输尿管,并横向缩回输尿管,同时保持性腺静脉内侧靠近下腔静脉。在左侧,脾肾、脾结肠和脾韧带被释放,脾脏和胰尾被内侧活动。识别性腺血管和输尿管并横向缩回。谨慎地清扫输尿管对于预防血运去血管形成至关重要。切除肾门时要小心识别附属血管。Hyams等人[ 25 ]描述了使用多普勒超声来帮助识别这些以前在横截面成像上从未见过的血管,而Wang等人[ 26 ]发现3-D磁共振血管造影与术中发现之间存在96%的相关性。一旦肺门血管充分暴露,Gerota的筋膜被解剖并识别肿瘤,保留肿瘤上的一部分用于T3分期。Gerota筋膜的这一部分也可以作为肿瘤切除过程中的手柄。2017年美国泌尿外科协会关于肾肿块和局限性肾癌的最新情况表明,如果术前影像学检查提示转移或直接侵入肾上腺,则建议进行肾上腺切除术[ 27 ]。否则,肾上腺与上极分离。临床区域淋巴结肿大患者应进行淋巴结清扫术以进行分期[ 27 ],因为1期肾细胞癌患者淋巴结清扫术没有生存获益,临床上也没有涉及淋巴结的益处[ 28 ]。尽管如此,尽管存在争议,但仍有一些人主张对大T1b肿瘤患者进行淋巴结清扫术,以检测和治愈微转移 。
肾门夹紧
有各种设备用于 肾门 夹紧:用于整体夹紧的Satinsky夹具,或用于选择性夹紧的斗牛犬夹具。钳夹技术因外科医生的偏好而异。已有报道称仅钳夹动脉,据报道有类似失血的发现[31 ]。Gong等人 发现,与仅钳夹动脉相比,钳夹动脉和静脉导致术后肌酐升高,尽管术前肾功能正常的患者肾功能不全的发展没有显着差异。 为了尽量减少肾缺血期间的细胞氧化损伤,已采用肾脏体温过低和静脉注射利尿剂。诱导肾体温过低的方法有多种,包括用冷晶体灌注肾动脉、输注逆行经尿道生理盐水和腹膜内冰淤泥 。甘露醇和/或 Lasix 可在钳夹前给药,但近期研究表明,术中使用利尿剂可能无益处。在一项双盲、随机临床试验中,Spaliveiro等人 发现,在肾功能正常的患者中,接受甘露醇的患者术后eGFR存在差异。 在放置初始中央连接线后立即取下夹具,在放置床垫或支撑缝线之前,通过提前松开夹子,可以减少温缺血时间 。V-Loc(美国马萨诸塞州曼斯菲尔德的Covidien)是一种用于这种运行吻合术的带刺单向缝合线。然后放置Vicryl(Ethicon,萨默维尔,新泽西州,美国)缝合线进行止血。Nguyen等人报告了类似的术中失血量 ,在一项由100例患者组成的系列中,将早期开胸与标准技术进行了比较。与开放性肾部分切除术在20分钟时的平均钳夹时间相比 ,早期松开组的平均钳夹时间缩短了6分钟。 还描述了不使用夹具的LPN的性能。在对26例患者钳夹和钳夹技术的回顾性比较中,Guillonneau等人 描述了一种使用超声剪切和双相电烙术进行肿瘤床止血的脱模技术。报告了类似的并发症发生率,所有患者的切缘均为阴性。相反,Rais-Bahrami等人 在他们的126例患者系列中发现,钳夹外组的失血量明显更多,但与钳夹组相比,输血率相似。在6个月的随访中,钳位组术后肌酐变化明显减少。 选择性钳夹涉及对肿瘤特异性动脉分支的显微剥离,从而消除整体缺血。Gill等人 描述了这种技术与术前三维(3D)CT成像和彩色多普勒超声检查。在Cacciamani等人进行的一项meta分析中[41 ],发现箝位外钳夹、选择性钳夹和早期平箝技术在获得具有相似围手术期和肿瘤学结局的肺门控制方面是安全可行的。
肿瘤切除术
一旦肾脏完全动员,肿瘤就会被识别出来。术中超声可用于确定内生或更中心位置的肿瘤的深度和位置。肿瘤使用电烙术进行周向划分。然后使用冷切除来切除肿瘤,同时保持正常实质组织的边缘。充分控制需要最小的周围围膜组织 ,据报道,MIPN后手术切缘阳性率为0.7%-5.7%[ 43 ]。手术切缘阳性似乎具有最小的转移或复发风险 ,但长期数据仍然缺乏。然而,从肿瘤床进行冷冻切片和随机组织取样仍有争议 ,但在疑似剩余肿瘤的病例中可能起作用,因为数据表明,粗体检查可提供准确的切缘评估 。 肿瘤切除后,可以注射亚甲蓝以确定收集系统的进入。 切除的肿块被放置在标本取回袋中,并在筋膜闭合前留待清除。
重建集合系统
毗邻或侵入采集系统的肿瘤通常需要进入采集系统。亚甲蓝可以通过开放式输尿管导管以逆行方式注射。如果肾脏灌注,也可以使用静脉注射靛蓝胭脂红。收集系统可以用2-0 Vicryl或3-0单向倒钩缝合线封闭,最后带有Lapra-Ty(Ethicon Endo-Surgery,辛辛那提,俄亥俄州,美国)。再次注入亚甲基蓝以确认水密闭合。Bylund等人 描述了一种替代的闭合技术,使用纤维蛋白胶可吸收明胶海绵缝合到位而无需正式的收集系统重建,并报告了2/104患者的尿液泄漏率。
肿瘤床止血
需要二次干预的最常见的术后并发症是迟发性出血 。因此,止血是一个关键步骤。在我们的机构,可以放置一个中央运行的Vicryl来缝合任何出血的血管。还执行收集系统的水密闭合。然后用2-0 Vicryl缝合线进行Renorrhaphy,一端使用Weck Hem-o-lok夹(Teleflex Medical,Kenosha,WI),使用四到六根缝合线以床垫方式放置。然后用Weck Hem-o-lok夹子和Lapra-Ty固定缝合线。也可以使用止血剂或增强剂 ,特别是对于无法插入肾床侧面的情况,增强剂可辅助。
关闭
在确认止血后,重新近似Gerota的筋膜,并取出标本。恢复气腹可以再次确认止血。然后,Blake或Jackson-Pratt排水管通过最侧面的港口站点输送。在直接可视化下,所有剩余的穿刺器被移除,局部麻醉被注射到端口位。然后用0 Vicryl闭合筋膜。然后可以使用Carter-Thomason装置来关闭剩余的12-mm穿刺器站点。单晶(Ethicon,萨默维尔,新泽西州,美国)用于密封皮肤,并且可以应用粘合剂。
机器人辅助腹腔镜肾部分切除术 (RALPN)
RALPN通过使用3D可视化以及通过铰接仪器进行全方位的运动来改善深度感知,从而提高精度和灵巧性。Aboumarzouk等人 进行了一项系统评价,比较了LPN和RALPN,发现了类似的结局,包括转化率、手术时间、术中失血量、住院时间、阳性切缘和并发症。机器人组表现出较短的温缺血时间。最近的研究也证实了类似的发现 。
患者定位
患者的体位反映了经腹膜腹腔镜方法在改变的45°侧腹位置 。然而,患者的后部放置在靠近机器人的边缘附近,而不是以桌子为中心,以提高机器人手臂的伸展范围。对于腹膜后通路,患者处于全侧卧位,脐带位于台面断裂处,并且手术台最大弯曲 。下肢定位和固定患者与上一节中描述的腹腔镜方法相似。
通路
通常,使用四个机器人端口,在左侧机器人穿刺器和相机穿刺器之间布置一个辅助端口,尽管已经描述了三臂方法。与LPN一样,可以在右侧肿瘤的尾尖下放置一个额外的肝脏牵开器。穿刺器之间必须有足够的距离,穿刺器和相机之间必须保持至少8厘米的距离,以确保有足够的仪器工作空间。首先,做一个12mm的脐上切口,通过该切口放置30°以下的腹腔镜。然后将三个8mm端口布置在直肌的同侧边缘,脐带下方约3 cm的中线(右侧用于肾肿瘤的机器人左臂),以及头颅骨到相机端口(右侧用于肾肿瘤的机器人右臂)。机器人几乎垂直于桌子。 在肠道切除和肺门解剖期间,第四臂可以使用前驱器进行反向缩回。 第四组可能有助于肾脏和肿瘤解剖。 腹膜后通路,在第12肋骨尖端通过外部斜筋膜切开一个切口。通过内部斜肌纤维仔细解剖后,通过内部斜筋膜切开一个切口并创建一个空间。Porrecca等人描述了此后使用手指和手套连接到鼻胃管进行充气的盲人创建空间[53 ]。虽然腹膜后通路在技术上可能更具挑战性,并且由于不熟悉的地标和有限的工作空间而可能出现定向障碍,但它确实具有直接进入肾门的优势,血管识别的顺序随着肾静脉之前遇到肾动脉而改变[53 ,54 ,55] ].缺乏肠道操作可以更早地恢复肠道功能并降低肠梗阻的风险,从而最大限度地缩短住院时间,并显著降低潜在肠道损伤的风险 。 图 14.4 显示了腹膜后机器人访问的示例。
图 14.4
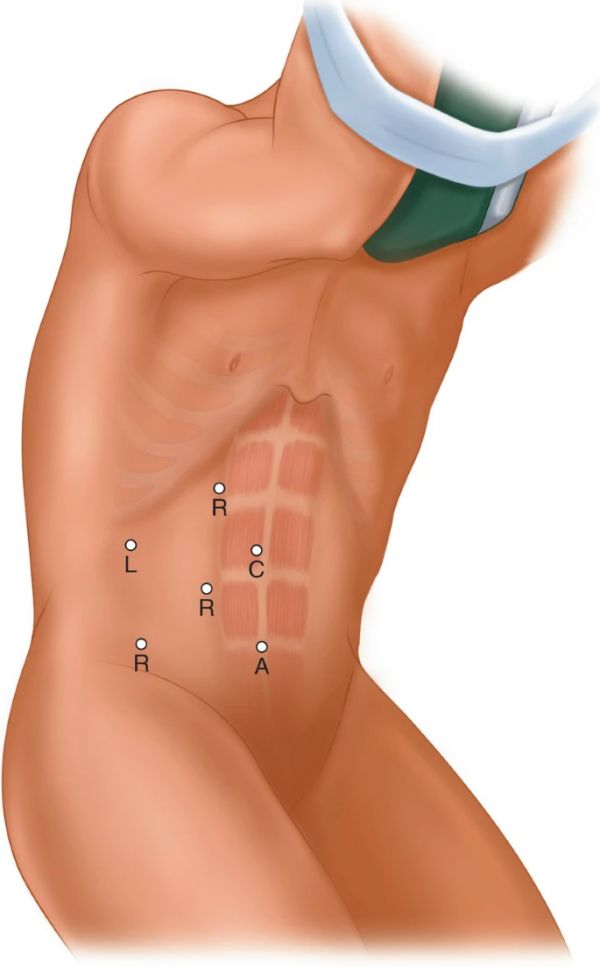
经腹膜机器人辅助腹腔镜肾部分切除术。(原文由作者提交)键:L – 肝脏,R – 机器人端口,A – 辅助端口,C – 相机端口
程序
用于经腹膜和腹膜后腹腔镜部分肾切除术的技术可以以类似的方式用于达芬奇(直观手术,桑尼维尔,加利福尼亚州,美国)机器人手术系统。由于使用了关节臂,技术上具有挑战性的步骤,例如收集系统的关闭,可以更容易地使用机器人执行。床边助理负责抽吸、缝合线的输送、夹子的放置以及肺门夹的可能放置(图 14.5 )。
图 14.5
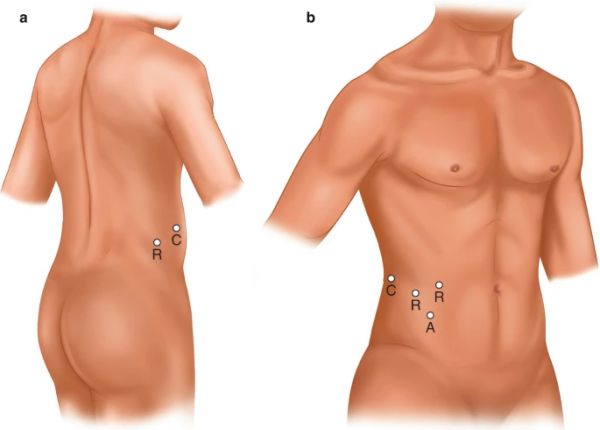
(a-b)腹膜后机器人辅助腹腔镜肾部分切除术。(原文由作者提交)键:R – 机器人端口,A – 辅助端口,C – 摄像头端口
消融技术
肾肿瘤的微创热消融 (TA) 治疗通常在介入放射学套件中经皮进行,并接受实时成像指导。从技术上讲,这些技术比肾部分切除术更具挑战性,因为不需要肺门夹紧,收集系统重建,再神经病变或邻近器官清扫。消融治疗通常仅限于临床cT1a(<3cm)肿瘤和手术风险增加的患者 。美国泌尿外科协会建议在治疗前进行组织诊断,因为消融过程会破坏组织并阻止明确诊断[ 5 ]。两种最常研究和使用的方法分别是冷冻消融(CA)和射频消融(RFA)。冷冻消融导致高压氩气快速膨胀引起的冰球形成引起的冷冻温度和随后的解冻过程中的再灌注损伤,从而造成细胞损伤。RFA利用通过电极传输到电池的交流电。能量引起搅拌,导致组织加热到温度超过60°C。在此温度下,发生不可逆的细胞损伤和坏死。进路的选择,开放性,腹腔镜或经皮,取决于肿瘤位置及其与肠道,邻近器官和大血管的接近程度。经皮和腹腔镜治疗之间的并发症发生率和肿瘤结局似乎相当[ 56 , 57 , 58 ]。在复发性疾病患者中,消融治疗并不排除根治性肾切除术 。 许多研究和系统评价比较了MIPN(LPN或RALPN)与TA 。这些研究显示,肾部分切除术 (PN) 和 TA 之间的肿瘤学结局相似(局部无复发和无转移生存期),但与 RFA 相比,PN 的无转移生存期更高。值得注意的是,总体生存有利于PN,但这些研究具有很高的选择偏倚 - PN患者往往更年轻,更健康。Thompson等人介绍了1424例接受PN(n = 1057)、RFA(n = 180)和CA(n = 187)的cT1a患者,中位随访分别为5.2年、3.6年和1.9年[ 68 ]。PN无复发生存期和无转移生存期与CA相当(分别为98%对98%和99%与100%),但与RFA相比,PN的无转移生存期更好(分别为99%和93%)。同样,用PN(n = 326)和CA(n = 53)治疗的cT1b(n = 379)患者具有相当的肿瘤学结局。Pierorazio等人最近的一项综述发现,与PN相比,接受TA的患者的1年无复发生存率较低;然而,辅助性TA手术消除了这种差异 。与PN相比,围手术期副作用似乎更有利于TA,但两种手术的肾功能结局相似 。此外,RFA和CA似乎具有相似的肿瘤学,围手术期和功能性结局,但需要进一步的数据来描述两种技术之间的差异。在比较MIPN和消融疗法时,有必要深思熟虑,因为每种疗法的适应症各不相同,并且患者群体通常显着不同,MIPN人群更年轻、更健康 。目前,微创消融手术在广泛使用之前需要进一步验证。 新的治疗方式,如高强度聚焦超声(HIFU)和微波治疗仍然是研究性的。后者开始取得进展,因为一些研究显示,后者与PN一样安全有效,但需要进一步的数据 。一个国际研究小组报告了他们在体外和腹腔镜HIFU方面的经验,证明了其可行性和安全性 。需要进一步试验优化器械设置和长期随访,以证明这些新技术的肿瘤学安全性和有效性。
术后管理
在术后立即,患者继续静脉输液并开始清澈的流质饮食。术后第1天,患者过渡到常规饮食,一旦患者有足够的口服摄入量,就停止静脉输液。使用间歇性静脉和口服镇痛药控制疼痛,抗生素持续24小时。术后和术后第1天检查实验室数据。对于深静脉血栓形成 (DVT) 预防,应始终佩戴序贯加压装置,给予皮下注射肝素,并鼓励早期行走。我们的机构利用卡普里尼评分来确定术后DVT风险。DVT风险升高的患者根据肾功能和出血风险过渡到依诺肝素,这由术中失血量决定。 放置引流管以监测出血或尿漏,如果引流量升高,则检查液体中的肌酐。Foley导管通常在术后第1天移除,并且在出院前取出引流管,平均术后第2天在我们机构。鉴于术中排便操作最少,饮食进展或分泌物不需要完全恢复肠道功能。在Shah和Abaza提出的一项90例患者系列研究中,提出了一种临床途径,其中94%的患者在术后第1天出院,5%的再入院率为5%[71 ]。关于围手术期使用抗血小板的数据很少。一项纳入430例连续病例的回顾性综述中,Leavitt等人发现,在进行腹腔镜肾部分切除术时继续使用阿司匹林的患者,术后主要并发症或术中失血量无显著差异[72 ]。通常,抗血小板药物可在 7-10 天内安全恢复。
微创肾部分切除术的并发症
先前报告的LPN和RALPN并发症发生率分别为11%至36%和8.5%至35.3%。Cacciamani等人 进行了一项meta分析,回顾了2000年至2016年间20,282例开放性,LPN和RALPN,发现LPN的总体术后并发症发生率为23.4%,RALPN为19.2%。
术中并发症
血管损伤
如果不及时治疗,肾门损伤可导致显著的发病率和死亡率。止血剂如 Surgiflo(Ethicon, Somerville, NJ, USA)或 Floseal (Baxter, Deerfield, IL, USA),或用 Surgicel 直接加压(Ethicon, Somerville, NJ, USA)可能足以治疗小静脉出血。充分止血可通过减少气腹来证实。较大的静脉损伤可能用不可吸收的缝合线过度缝合,例如4-0 Prolene(Ethicon,Somerville,NJ,USA);然而,严重损伤可能需要完成肾切除术。
腹腔内器官损伤
肠损伤可能以创伤性方式发生,例如在进入期间,或使用电烙术进行热损伤。轻度热损伤可通过简单浸润进行治疗,而重度热损伤可能需要肠切除和再吻合术。在极少数情况下,需要转移。术后发现肠损伤通常需要手术探查。肠损伤的临床表现包括腹膜炎、恶心、呕吐、脓毒症的体征和症状。过度的肠道操作也可能增加术后肠梗阻的风险。早期粘连形成也可能导致小肠梗阻。 胰腺和脾损伤通常发生在左侧手术过程中 。胰尾损伤最常见。最常见的是,胰腺损伤在术后期间被发现,伴有增加的,通常呈乳白色的引流输出量。通过获取引流液和血清淀粉酶和脂肪酶进行确认。治疗包括元素饮食或全胃肠外营养、鼻胃管放置、生长抑素抑制胰腺外分泌功能以及经皮引流。轻度脾损伤通常使用止血剂和/或填塞进行保守治疗。极少数情况下,脾切除术是在严重脾撕裂伤的情况下进行的。 腹腔镜肾手术中膈肌损伤罕见,见于0.4%的病例[74 ]。术中,胸膜进入的临床体征可能包括呼吸需求的变化或只是膈肌的滚滚。术中可使用腹腔镜检查进行修复。如果临床上存在膈肌损伤的疑虑,且未发现任何缺损,术后可在恢复区进行直立胸部 X 线检查。然而,不需要常规术后胸部X线检查 。
术后并发症
出血
假性动脉瘤 (PA) 和动静脉瘘 (AVF) 是罕见的,但可能是术后出血的致命原因。然而,延迟性出血是LPN后需要二次手术的最常见并发症 。Jain等人的一项系统评价显示,平均表现发生在手术后14.9 d,87.3%表现为肉眼血尿[ 76 ]。患者可能出现的其他症状包括胁腹痛和潜在的瘀斑,特别是在腹膜后血肿形成显著的病例中。可通过 CT 血管造影对患者进行诊断。然而,在某些情况下,根据严重程度,患者可直接通过介入放射学进行血管造影和血管栓塞 。选择性血管栓塞是治疗 PA 和 AVF 的首选方法,但在某些情况下,进行完全肾栓塞,甚至重新探查和可能完成肾切除术。
尿漏
更大或更多的内生肿瘤可能需要有意进入收集系统。因此,要非常小心地确保在维修过程中,集合系统充分关闭。如上所述,亚甲蓝的使用有助于闭合。然而,尽管谨慎努力,仍可能发生尿漏。Zorn等人证明,单独进入采集系统与尿液漏漏风险增加无关 。术中放置引流管有助于诊断出血和尿漏。临床症状包括腹部或胁腹痛、肠梗阻、出现浆液的引流量增加和血清肌酐升高。尿漏可以通过检查引流液肌酐来确认,与血清相比,肌酐值会升高。治疗包括使用输尿管支架、引流管和导尿管进行膀胱减压的保守治疗。偶尔需要经皮肾造瘘管,很少需要第二次手术进行闭合。如果担心感染发热或白细胞增多,可能需要使用抗生素。
未来方向
本着“不手术是最好的手术”的原则,肾肿块活检(RMB)开始取得进展。据记载,近四分之一的肾肿块是良性的[ 8 ]。在考虑针对其他器官系统制定的严格癌症指南时,在手术治疗之前缺乏明确的组织诊断仍然是肾脏肿块所独有的。技术和组织学的进步提供了较高的诊断准确性和可接受的RMB发病率,并且该手术本身并不排除手术治疗[ 79 ]。我们怀疑肾癌的未来将受到肾肿块活检的指导。 另一个值得注意的发展是以增强(AR)和虚拟现实(VR)的形式使用先进的成像技术。AR是虚拟图像叠加到现实世界中,而VR是对现实世界的模拟。AR已经进入临床领域,术中用于改善手术结局,特别是PN的阴性切缘和通过引导选择性动脉钳夹来维持正常缺血[2 ,3 ]。此外,VR有可能通过在手术前创建准确而详细的手术解剖结构心理图来进一步改善手术结果。Wake等人指出,有经验的外科医生在回顾CT扫描后,未能在3D重建的肾脏上确定肾肿瘤的正确位置[4 ]。有趣的是,加州大学欧文分校(University of California, Irvine)对VR的研究调查了VR头戴式显示器以及手部运动跟踪在PN术前计划中的使用。他们使用VR技术允许外科医生在内部窥视并与患者特定的3D-VR模型进行交互。经验丰富的外科医生指出,与单独的CT相比,VR模型的审查提供了更好的解剖学理解。此外,VR体验提高了计划PN的手术信心,并多次改变了手术方法[80 ]。虽然AR和VR技术很有前途,但还需要进一步的研究来评估其临床影响,并解决创建这些高级图像所需的时间限制。
结论
微创肾单位保留技术已被证明具有相似的肿瘤学结局,同时可降低发病率并改善结局。虽然LPN仍然是SRM的黄金标准肾单位保留方法,但RALPN已成为许多外科医生中安全,有效且广泛使用的技术,否则他们可能无法进行腹腔镜检查。目前的文献表明,与LPN和OPN相比,RALP具有相同且可能更好的结局。
本文由“健康号”用户上传、授权发布,以上内容(含文字、图片、视频)不代表健康界立场。“健康号”系信息发布平台,仅提供信息存储服务,如有转载、侵权等任何问题,请联系健康界(jkh@hmkx.cn)处理。
相关知识
科普|揭秘肾肿瘤部分切除术:谁适合做?术后如何做好康复?
女子肾巨大错构瘤腰痛不适,腹腔镜微创切除成功保肾
肾部分切除术:论如何减少肾实质损失量
肾上腺髓性脂肪瘤切除术
肾上腺囊肿切除术后3个月血CEA升高,怎么办?
肾肿瘤切除去开始消瘦且浑身无力怎么办
从前年做过肾部肿瘤微创手术后病发,症状是心率加快,...
详解肾切除手术得住院几天 肾切除手术要几个小时时间
肾肿瘤切除后体重一直下降吗
微波消融和冷冻消融有什么区别?长沙肿瘤消融技术哪家好?
网址: 微创肾部分切除术和小肾肿瘤消融术 https://m.trfsz.com/newsview1418140.html
