全球首例!徐沪济教授团队成功应用 iPSC-CAR-NK 细胞治疗重症难治性 dcSSc
系统性硬皮病(Systemic sclerosis, SSc)是一种以血管异常、免疫活化和进行性组织纤维化为特征的慢性自身免疫性疾病,临床治疗长期面临药效局限、纤维化不可逆、疾病异质性高等挑战。特别是在弥漫型皮肤硬化性 SSc(dcSSc)中,常规药物疗效有限,预后差。
当前尽管自体造血干细胞移植(HSCT)或 CAR-T 细胞疗法在部分难治性病例中取得初步进展,但也面临高毒性反应(如 CRS、ICANS)、制备个体化限制和生产标准化等问题,严重阻碍了其在更广泛自身免疫人群中的推广。
2025 年 6 月 24 日,海军军医大学长征医院徐沪济教授团队在 Cell 上发表了文章 An iPSC-derived CD19/BCMA CAR-NK therapy in a patient with systemic sclerosis,采用一种以诱导多能干细胞(induced pluripotent stem cell, iPSC)为基础的工程化 CD19/BCMA 双靶点嵌合抗原受体自然杀伤细胞(CAR-NK)产品(QN-139b),并在重症难治性的 dcSSc 患者中实现了首例成功临床转化。
该研究不仅填补了 CAR-NK 疗法在硬皮病中的应用空白,更为「现货型、低毒性、广谱靶向」的自身免疫疾病精准治疗建立了新范式。

图 1.发表文章截图
QN-139b 是一种源自基因工程 iPSC 库的双 CAR-NK 细胞,通过多重基因编辑优化免疫兼容性、增强功能活性并引入安全机制,实现对 B 细胞和浆细胞的广谱靶向,有效覆盖自身免疫疾病中多样化的致病效应细胞群体。
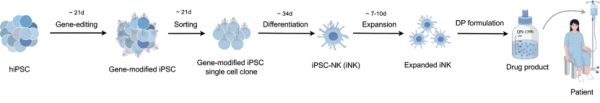
图 2. 细胞制备流程
基于体外细胞实验和动物模型中的研究基础,我们在采用 QN-139b 治疗 dcSSc 患者,并从中观察到良好的治疗耐受性,且在治疗后 6 个月内,患者的临床症状和免疫指标均实现全面改善。
首先,患者达到了血清免疫学重建。
具体表现在外周 B 细胞迅速清除,自身抗体(Scl-70、SSA)大幅下降、血清 IgM/IgA/IgE 持续下降和记忆 B 细胞群消失,提示免疫系统实现深度重构。
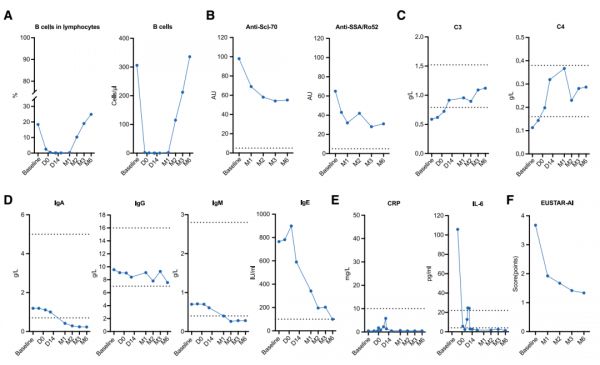
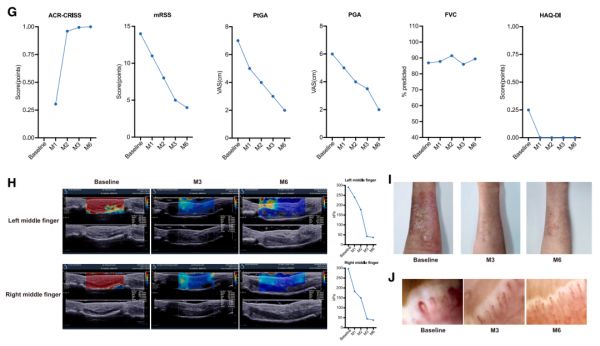
图 3. QN-139b 输注前后不同时间点 dcSSc 患者临床、免疫学和结构测量的变化
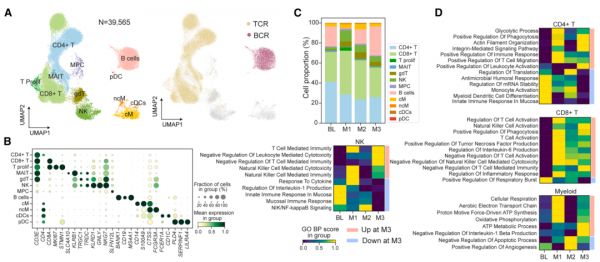
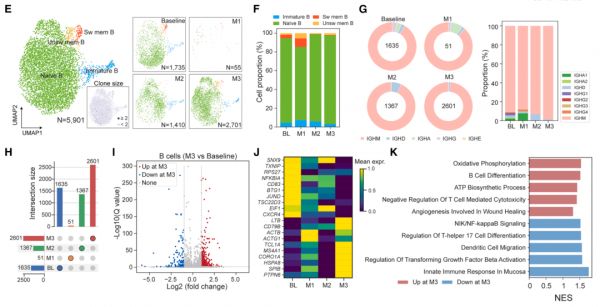
图 4. QN-139b 输注前后 dcSSc 患者免疫细胞和 B 细胞亚群组成和功能的变化
其次,患者实现了皮肤组织学与脏器结构的改善。
患者的 mRSS 评分持续下降,超声显示皮肤弹性增强、红肿硬化缓解;肺 HRCT 提示弥漫性玻璃样病变减少,心脏 MRI 显示心肌纤维化明显逆转;指甲毛细血管镜显示血管密度增加、新生血管形成;皮肤组织病理提示包括 B 细胞和 CD8+T 细胞在内的炎症细胞浸润改善,真皮层胶原积聚减少和皮肤分泌腺的再生。
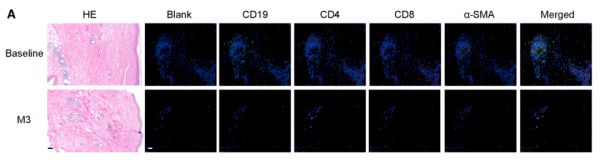
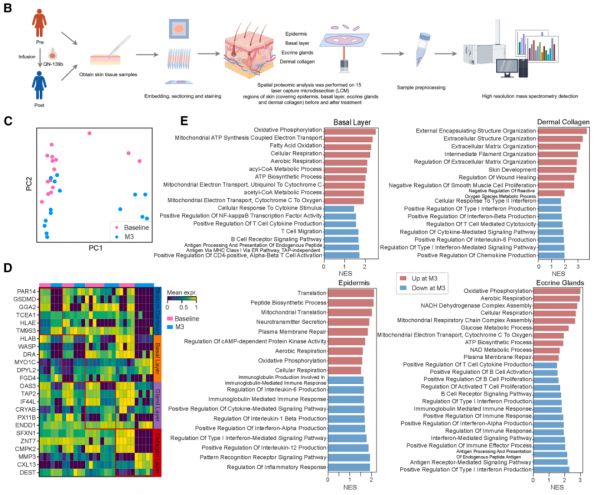
图 5. QN-139b 治疗的 dcSSc 患者皮肤和血浆样本的时空蛋白质组图谱
研究通过多组学机制深入解析了疗效机制:系统性免疫抑制与组织再生修复。
本研究通过纵向、多层次组学技术系统解构了 QN-139b 治疗 dcSSc 的作用机制,揭示其不仅实现了病理性免疫应答的高效终止,还重塑了皮肤等终末器官的结构与功能,形成「免疫重置 + 组织再生」协同转归。
这一机制的全面性和一致性,在多种维度的组学数据中均得到了验证,标志着 iPSC-CAR-NK 疗法具备强烈的双重调节潜力。
(一)
单细胞免疫组学:重构免疫细胞谱系与克隆动态
通过在治疗前及 M1、M2、M3 等关键时点进行 5'单细胞 RNA 测序联合 BCR/TCR 测序,对患者外周免疫细胞进行纵向追踪,揭示了 CAR-NK 治疗诱导的深度免疫重塑。
治疗后 B 细胞在 M1 阶段被完全清除,后续重建以幼稚 B 细胞和未成熟 B 细胞为主,病理性记忆 B 细胞与切换型浆细胞持续缺失,提示治疗实现了「去病态谱系」与免疫系统重启。
BCR 克隆分析显示 M3 时 BCR 库与基线无克隆重叠,表明新生 B 细胞源自初始克隆激活而非残余记忆克隆扩张。
T 细胞谱系亦呈显著变化:CD8⁺ T 细胞在 M1 短暂扩张后恢复至稳态,CD4⁺ T 细胞逐渐减少,显示免疫清除与稳态维持在时间上具有分工,体现 CAR-NK 介导免疫重建的阶段性与协调性。
(二)
转录组信号通路分析:炎症下调与再生上调双轨重塑
通过对不同时间点免疫细胞的转录组 GSEA 分析,QN-139b 治疗诱导了系统性免疫重塑。
一方面,Th17 分化、NIK/NF-κB 轴、树突状细胞迁移和 IL-17 生成等关键炎症通路显著下调,提示自身免疫相关炎症负荷实质性缓解;另一方面,B 细胞分化、ATP 合成和氧化磷酸化等稳态与代谢通路显著上调,表明免疫系统正向能量代谢支持下的稳态恢复转变。
此外,PTPN6、SPIB 等免疫负调节因子持续升高,构建内源性负反馈回路,有助于防止免疫反应过度激活与复发,整体反映出由「病理激活」向「稳态自限」的免疫重编程过程。
(三)
空间蛋白质组学:器官层级的结构修复与功能恢复
在治疗前后获取的皮肤活检中,利用 LCM-MS 技术对表皮、基底层、真皮胶原及汗腺进行高分辨率空间蛋白质组学分析,结果显示 CAR-NK 治疗诱导了皮肤蛋白表达的区域性重构。
治疗第 3 个月(M3)时,各组织区在 PCA 中显著偏离基线,表明全局蛋白表达发生系统迁移。
表皮与基底层中蛋白合成与修复通路(如翻译起始、肽链延伸、角质形成细胞分化)显著激活,反映出结构更新与修复的进行;真皮层中胶原降解与基质重塑通路上调,提示纤维化逆转伴随再生响应启动。
汗腺区域仍维持抗原呈递与干扰素相关信号,说明在炎症缓解背景下局部免疫监视功能得以保留,体现出 CAR-NK 介导的「靶向清除、选择性保留」式免疫重塑。这些空间蛋白组学特征为器官功能恢复提供了分子证据。
(四)
血浆蛋白组学:系统性炎症解除与组织修复的分子证据
通过治疗前后血浆蛋白质谱的动态分析,QN-139b 诱导的免疫环境重塑和组织微环境改善得以验证。
治疗后,抗炎与负调节因子(如 TNFAIP3、IL22RA2、MERTK)显著上调,提示免疫应答由病理激活转向自限稳态;同时,促炎及抗原呈递相关分子(如CIITA、CD83、CXCR4、HLA-B)显著下降,反映出炎症被有效抑制,免疫系统处于「低响应」状态。
此外,与血管生成和组织修复相关的蛋白(如CD93、MMP2、AMOTL1)持续上调,促进氧供与代谢功能恢复。整体描绘出CAR-NK治疗引导的「免疫清除 + 组织再生」双重治疗路径。
本研究首次系统展示了 iPSC 来源 CAR-NK 细胞在难治性自身免疫病治疗中的完整路径—从多基因工程设计、体外功能强化、体内安全性验证,到临床中的免疫重建与组织修复。其「现货型、广谱清除、低毒副作用」的特点突破了传统 CAR-T 的技术瓶颈,提供了具有规模化转化潜力的创新治疗平台。
未来,CAR-NK 及其衍生版本有望应用于系统性红斑狼疮、炎性肌病、干燥综合征等 B 细胞主导型疾病,iPSC-CAR 平台也将成为下一代精准免疫治疗的重要支柱。
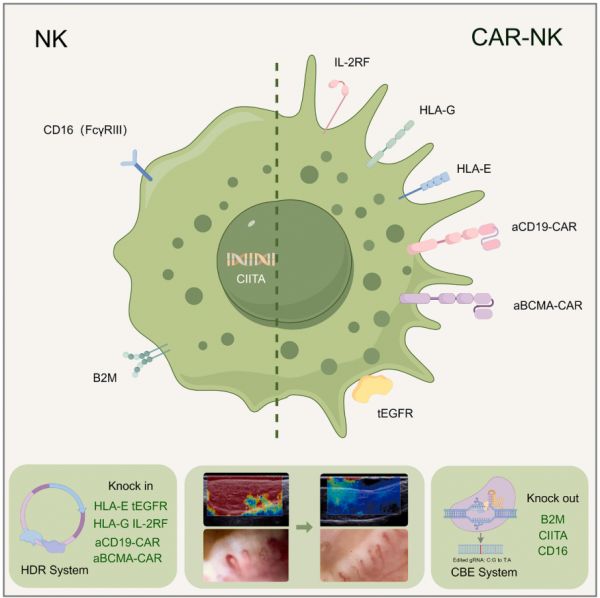
图 6.发表文章截图
海军军医大学长征医院徐沪济教授为本文的独立通讯作者
题图|站酷海洛
相关知识
NK细胞疗法=“肿瘤克星”?NK细胞疗法发展现况大解析
用CAR
经典案例:64岁患者接受NK细胞治疗后,晚期癌症停止复发转移
梁爱斌教授:CAR
功能重塑型细胞治疗技术
博雅干细胞一周资讯:科学家揭示衰老抑制T细胞抗肿瘤免疫机制
专业的nk疗法作用和功效
肿瘤治疗真实案例:TIL细胞治疗肝癌,安全可行,无严重毒副作用
无痛延长14个月生命,刘中民团队细胞+物理治疗尝试为晚期胰腺癌患者搏生机
中国基因与细胞治疗研究突飞猛进!国内多家基因、生物技术企业展露锋芒
网址: 全球首例!徐沪济教授团队成功应用 iPSC-CAR-NK 细胞治疗重症难治性 dcSSc https://m.trfsz.com/newsview1464921.html