李红良团队揭示脂肪生成新机制
撰文 | 咸姐
肥胖是目前全球公共卫生的一大挑战,与心血管代谢疾病如2型糖尿病、血脂异常和非酒精性脂肪肝等密切相关,其最大的特点是白色脂肪组织(WAT)的过度膨胀。WAT是全身能量稳态的关键调节因子,它合成和储存甘油三酯(TG)以满足长期的能量需求,同时在能量需要时可从TG中释放游离脂肪酸(FFA);它还是一个内分泌器官,可分泌调节全身新陈代谢的脂肪因子,如瘦素和脂联素【1】。当营养过剩时,WAT会通过增加预先存在的脂肪细胞的大小(即肥大),或通过脂肪生成过程中脂肪细胞前体(AP)的分化产生新的脂肪细胞(即增生)而扩张。普遍研究认为,脂肪细胞的增生是适应性的,有利于代谢健康,而脂肪细胞的肥大是适应不良的,并与病理WAT重构相关【2,3】。
脂肪生成是一个高度协调的过程,通过这个过程,AP会形成一个成脂谱系(即前脂肪细胞),积累营养,并分化成成熟的脂肪细胞。研究表明,通过脂肪生成招募新脂肪细胞的能力对于健康的脂肪组织扩张和热量过剩情况下的全身代谢健康都至关重要【2,3】。若WAT不能通过脂肪生成而扩张,则会导致WAT功能下降,血糖和血脂水平持续升高,以及其他代谢敏感器官(如肌肉、肝脏和心脏)的脂毒性,从而促进胰岛素抵抗。在肥胖中,脂肪生成和维持代谢健康之间的强烈相关性表明,将脂肪组织的扩张从肥大转变为增生可以防止因热量过剩而导致的病理性重塑和脂肪功能障碍。进一步识别调节脂肪形成的新因素可能会提高我们对这一过程的理解,并可能导致肥胖相关代谢紊乱的新治疗方法的开发。
2021年6月8日,武汉大学李红良教授团队在Cell Metabolism上在线发表题为TMBIM1 is an inhibitor of adipogenesis and its depletion promotes adipocyte hyperplasia and improves obesity-related metabolic disease 的文章,利用转录组学方法,发现脂肪细胞前体中一种新的脂肪生成抑制剂——TMBIM1(一种溶酶体跨膜蛋白),其可以降低PPARγ的稳定性。在热量过剩时,脂肪细胞前体中Tmbim1的缺失可导致内脏WAT的增生性扩张并改善肥胖相关的代谢功能障碍,为肥胖相关代谢疾病提供了一个潜在治疗靶点。

为了确定与脂肪生成相关的潜在关键调控因子,本文的研究人员在3T3-L1脂肪细胞分化过程中进行了RNA测序(RNA-seq)分析,发现TMBIM1(transmembrane BAX inhibitor motif-containing 1)是脂肪生成的重要调节因子。通过在3T3-L1脂肪细胞中敲低或过表达TMBIM1,以及对来自全身Tmbim1敲除小鼠的胚胎成纤维细胞(MEF)进行实验分析,研究人员进一步证实了TMBIM1可以抑制脂肪生成,降低TG水平和PPARγ及CEBPα的表达。
随后,为了研究TMBIM1在体内脂肪生成中的特异性作用,研究人员利用PdgfRα Cre-lox系统(该系统在谱系追踪研究中已被证明在AP中具有活性)产生了AP特异性Tmbim1 KO小鼠(Tmbim1-APKO),与对照小鼠(Tmbim1-Flox)相比,Tmbim1-APKO小鼠的附睾WAT(EpiWAT)和腹股沟WAT(lngWAT)中TMBIM1的表达明显减少,而其他组织中没有变化。在正常饮食喂养时,Tmbim1-APKO小鼠与对照组小鼠的脂肪细胞大小没有明显的组织学差异,但是,高脂饮食(HFD)喂养后,小鼠的EpiWAT脂肪细胞数量增多,而Tmbim1-APKO小鼠的脂肪细胞体积比对照组小鼠小,表明发生了增生性肥胖。然而,lngWAT的脂肪细胞大小没有变化。相应的,与对照组小鼠相比,HFD喂养的Tmbim1-APKO小鼠的EpiWAT中脂肪生成增强,胰岛素敏感性提高,浸润巨噬细胞减少,RNA-Seq显示脂肪细胞分化和脂质代谢相关基因表达上调,炎症相关基因表达下调。由此表明,肥胖的Tmbim1-APKO小鼠表现出类似胰岛素敏感型肥胖的局部脂肪和全身表型。
进一步地,研究人员构建了AP特异性Tmbim1过表达转基因(Tmbim1-APTg)小鼠,HFD喂养后,与对照组小鼠相比,Tmbim1-APTg小鼠的EpiWAT脂肪细胞体积显著变大,显示脂肪细胞肥大增加,提示了对EpiWAT中被抑制的脂肪生成的补偿。同时,与Tmbim1-APKO小鼠的表型正好相反,Tmbim1-APTg小鼠更容易出现葡萄糖不耐受和胰岛素抵抗,EpiWAT中浸润巨噬细胞增多,脂肪细胞选择性基因水平降低、炎症相关基因表达增强。由此证明,AP Tmbim1过表达诱导的脂肪生成能力受损导致了病理WAT的扩张并加剧了代谢功能障碍。值得一提的是,研究人员发现,成熟脂肪细胞中TMBIM1的表达不影响HFD诱导的脂肪细胞分化和全身胰岛素抵抗。
那么,TMBIM1在脂肪生成过程中的作用机制到底是什么呢?实验结果显示,TMBIM1可以与NEDD4相互作用并促进其自泛素化和降解,从而间接降低了PPARγ的稳定性。PPARγ的敲低可以部分逆转Tmbim1敲低造成的细胞脂质积累,以及脂肪细胞分化和脂质代谢过程相关基因表达的增强。体内实验也显示,PPARγ表达的降低会逆转Tmbim1-APKO小鼠的脂肪生成过程,破坏Tmbim1缺失所引起的糖代谢异常和胰岛素抵抗的改善,由此证明TMBIM1对脂肪生成的抑制作用在很大程度上依赖于PPARγ。
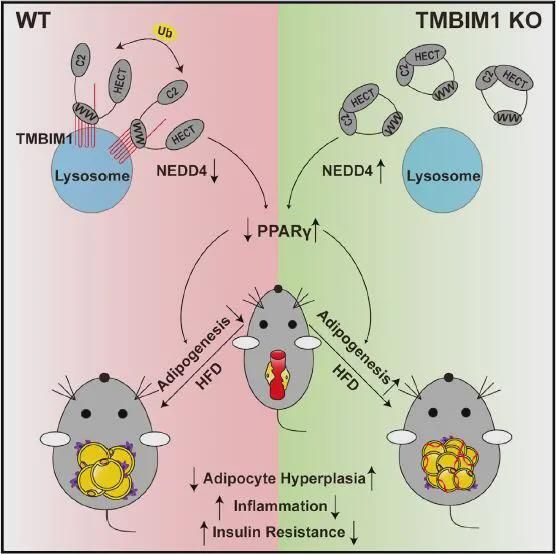
综上所述,本研究通过体外和体内实验,证明了TMBIM1可以通过结合并促进NEDD4的自泛素化和降解,以降低PPARγ的稳定性,从而作为AP中脂肪生成的抑制因子而发挥作用,以此加深了目前对脂肪生成的理解,并为肥胖相关代谢紊乱的治疗确定了新的可能性。
原文链接:
https://doi.org/10.1016/j.cmet.2021.05.014
参考文献
1. Rosen, E.D., and Spiegelman, B.M. (2014). What we talk about when we talk about fat. Cell 156, 20–44.
2. Ghaben, A.L., and Scherer, P.E. (2019). Adipogenesis and metabolic health. Nat. Rev. Mol. Cell Biol. 20, 242–258.
3. Vishvanath, L., and Gupta, R.K. (2019). Contribution of adipogenesis to healthy adipose tissue expansion in obesity. J. Clin. Invest. 129, 4022–4031.
特别声明:以上内容(如有图片或视频亦包括在内)为自媒体平台“网易号”用户上传并发布,本平台仅提供信息存储服务。
Notice: The content above (including the pictures and videos if any) is uploaded and posted by a user of NetEase Hao, which is a social media platform and only provides information storage services.
相关知识
Science Advances:研究团队揭示健康脂肪细胞抗癌机制
Nature子刊:薛宇、贾大团队揭示生酮饮食发挥抗癌作用的新机制
蒋卫团队揭示脂肪酸代谢调控内胚层分化的分子机制
复旦大学、中科院团队最新成果揭示东亚面部独特性遗传进化机制
肥胖人的福音?中山六院研究团队连续发文揭示肥胖机制
武汉大学揭示脂肪酸代谢调控内胚层分化的分子机制
Nature子刊:上海体育大学郭亮团队揭示母亲孕期运动有益孩子代谢健康的机制
Nature:上海交通大学王卫庆/王计秋团队揭示脑肠轴抑制脂肪吸收、降低体重的机制
营养与健康所乐颖影研究组揭示非酒精性脂肪肝中脂质合成增加的新机制
刘健康团队揭示疾病条件下肝脏脂肪代谢机制并提出新型预防方案
网址: 李红良团队揭示脂肪生成新机制 https://m.trfsz.com/newsview1484862.html
