李贵登团队揭示甘露糖代谢增强T细胞干性分化的新机制并提出建立长效抗肿瘤能力的新策略
T细胞的持久性是肿瘤免疫治疗成功的关键因素。在T细胞亚群中,低分化状态的TCF1⁺“干性样”T细胞因其较高的增殖和分化潜力,能够展现出更强的体内抗肿瘤效果。然而,在过继性T细胞疗法(ACT)中,尤其是对起始数量有限的肿瘤浸润T细胞(TILs),如何有效扩增足够数量的低分化T细胞以实现理想的治疗效果,仍然是面临的主要挑战之一。目前,传统的体外扩增方法往往导致T细胞效应分化和功能耗竭,从而丧失其干性样特性,严重制约了疗效的提高。研究表明,不同分化阶段的T细胞具有独特的代谢特征,而代谢重编程在决定T细胞命运中发挥了核心作用。因此,深入理解代谢调控T细胞命运决定机制,并通过靶向T细胞的代谢通路优化体外T细胞扩增培养体系,已经成为提高是过继性T细胞疗法效果的重要研究方向。
2024年12月5日,中国医学科学院系统医学研究院/苏州系统医学研究所(以下简称“系统所”)李贵登团队与Fred Hutchinson癌症研究中心的Philip D. Greenberg团队合作在《Cancer Cell》杂志在线发表题为“Mannose metabolism reshapes T cell differentiation to enhance anti-tumor immunity”的研究论文。该研究首次揭示了甘露糖代谢在T细胞分化中的调控作用,并建立了一种体外高效诱导“干性样”T细胞的新方法。机制上,研究团队发现补充甘露糖能够重塑T细胞代谢重编程,增强O-GlcNAc转移酶(OGT)介导的β-catenin糖基化,提高β-catenin稳定性,从而促进T细胞向干性表型分化。
在该项研究中,研究团队对来自300多例不同类型肿瘤患者的TILs,小鼠慢性LCMV感染模型以及小鼠肿瘤模型T细胞的单细胞数据进行分析,发现与终末耗竭T细胞(Tex)相比,前体耗竭T细胞(Tpex)表现出更高的甘露糖代谢活性。更为重要的是,通过对接受免疫检查点抑制剂治疗(ICI)的癌症患者的T细胞进行RNA-seq分析发现,响应者T细胞中甘露糖代谢通路显著富集,进一步证实了甘露糖代谢对T细胞功能调控的积极作用,且其更适合用于治疗干预。此外,研究团队在B16-OVA肿瘤小鼠模型中验证了口服甘露糖以增强甘露糖代谢对过继性T细胞的抗肿瘤效果。同时,CITE-seq单细胞多组学分析证实,补充甘露糖有助于维持过继性TILs的干性表型并延缓其耗竭进程。
接下来,研究团队探讨了甘露糖是否可以在体外培养中诱导T细胞向干性表型分化。研究表明,甘露糖能够显著促进小鼠及人类T细胞中干性亚群的形成。进一步的,研究团队将经体外甘露糖处理所获得的OT-I T细胞,CD19 CAR T细胞,1G4 TCR T细胞,分别应用于小鼠黑色素瘤(B16-OVA),人白血病(K562-CD19)和人肝癌(HepG2-NY-ESO-1)模型中。结果发现,这些经甘露糖处理得到的T细胞显著抑制了肿瘤的生长,延长了荷瘤小鼠的生存期。更有意义的是,基于甘露糖对T细胞干性分化的作用,研究团队建立了体外长期扩增T细胞的培养体系。他们发现甘露糖补充不仅能够实现T细胞的长期大规模扩增(超过100倍),同时还能保持其干性特征和抗肿瘤功能。
进一步探究甘露糖对T细胞干性分化的分子调控机制时,研究团队借助转录组学、代谢组学、表观遗传学以及同位素示踪等多种分析方法,发现甘露糖能够通过抑制糖酵解,增强TCA循环的代谢产物,调节干性相关基因的表观遗传学修饰,并维持线粒体功能。更重要的是,甘露糖通过影响其下游糖基化修饰中间代谢产物并上调O-GlcNAc转移酶(OGT)表达,促进由其介导的β-连环蛋白(β-catenin)O-GlcNAc修饰,从而稳定β-catenin,提升TCF1的表达,最终促进T细胞的干性分化。
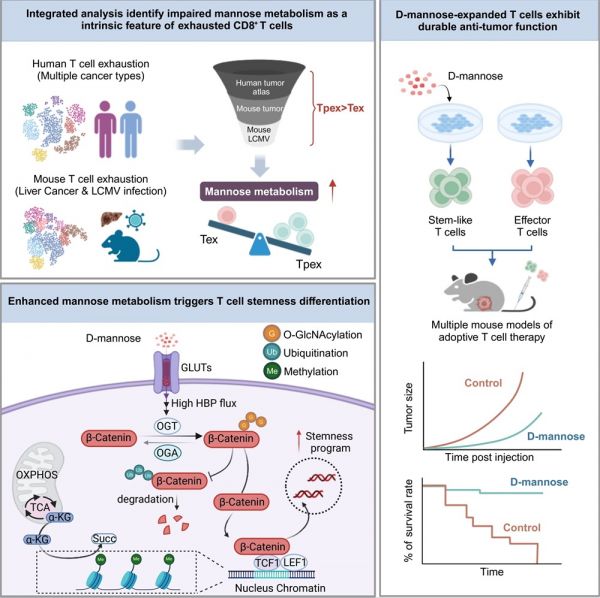
该研究首次系统地阐明了甘露糖代谢在T细胞干性分化和维持中的全新作用,并创新性地解析了O-GlcNAc修饰与T细胞干性分化之间的分子联系,为靶向甘露糖代谢途径增强T细胞免疫治疗的长效性提供了科学依据。同时,本研究开发的基于甘露糖的T细胞培养方法,能够高效制备干性样T细胞产品,尤其在TILs扩增和通用型CAR-T细胞的大规模制备中具有突破性意义,为未来开发更高效、持久且经济的T细胞疗法提供了全新的解决方案。
此外,澳大利亚彼得·麦克卡勒姆癌症中心的Phillip K. Darcy和Paul A. Beavis教授在Cancer Cell杂志以“A metabolic pathway for improving adoptive cellular therapy”为题进行了专题评述,指出甘露糖代谢可作为增强过继性T细胞记忆和持久性,提高其抗肿瘤活性的关键代谢途径。
中国医学科学院系统医学研究院/苏州系统医学研究所李贵登研究员与Fred Hutchinson癌症研究中心Philip D. Greenberg教授为该论文的共同通讯作者。中国医学科学院系统医学研究院/苏州系统医学研究所博士研究生邱雅静、谢二美和杜静,副研究员程洪成以及Fred Hutchinson癌症研究中心苏亚鹏博士为该论文的共同第一作者。该研究受到国家自然科学基金,中国医学科学院医学与健康科技创新工程以及江苏省自然科学基金等项目支持。
原文链接:https://authors.elsevier.com/c/1kDHf5TA51hPCS
课题组简介与招聘信息
中国医学科学院系统医学研究院/苏州系统医学研究所李贵登课题组聚焦于免疫及肿瘤的转化医学研究,以期望建立高效的T细胞免疫新疗法。主要研究方向:(1)建立新型TCR抗原筛选平台筛选治疗性TCR,(2)运用分子细胞生物学、高通量测序、计算生物学手段研究肿瘤抗原呈递以及T细胞受体与抗原的互作机制;(3)探究T细胞功能调控以及肿瘤微环境对免疫治疗耐药的机制,(4)通过基因改造等先进技术研发具有更强抗肿瘤能力的CAR/TCR-T细胞。截止目前为止,综合运用细胞生物学、生物信息学、表观遗传学等技术手段,课题组在T细胞肿瘤免疫方向取得一系列创新进展,并发表了系列研究性论文和综述,包括 Cancer Cell (2024),Nature Metabolism (2023,封面文章); Nature Methods (2019,2021,2022); Cell Metabolism (2020,2024); Nature Communications (2020);Nature Reviews Immunology (2019); Blood (2018); Advanced Science (2024,封面文章); Cell Reports (2024)。课题组长期招募有志于肿瘤免疫的并具有免疫学、细胞生物学、肿瘤学、神经学、生物信息学等多个不同学科背景的博士后、助理研究员、副研究员。优秀博士后可申请院校“协和青年学者”(年薪不低于50万元)。实验室网页https://www.ismsz.cn/Web/KXYJKYTDPage?Id=20&PageId=293。
相关知识
博雅干细胞一周资讯:科学家揭示衰老抑制T细胞抗肿瘤免疫机制
昨天Nature、今天Cell,迟洪波团队揭示Treg细胞保护癌症新机制及CD8+T细胞命运决定关键代谢通路
上海交通大学研究团队提出全新的肿瘤代谢激活免疫治疗策略
中国医学科学院等团队合作发现最新抗肿瘤免疫治疗策略
代谢激活,复旦大学研究团队提出肿瘤治疗全新范式!
体内稳态和肿瘤免疫中的T细胞代谢
为肿瘤治疗提供全新范式,材料科学系步文博团队提出基于营养素纳米化技术的代谢重激活抗肿瘤新疗法
为阿尔茨海默病防治提供新策略:厦门大学张杰团队揭示小胶质细胞糖脂代谢调控新机制
华中科技大学揭示糖原代谢调控炎性巨噬细胞机制
Nature子刊:王维民团队揭示间歇性甲硫氨酸饥饿促进肿瘤铁死亡并增敏免疫治疗的新机制
网址: 李贵登团队揭示甘露糖代谢增强T细胞干性分化的新机制并提出建立长效抗肿瘤能力的新策略 https://m.trfsz.com/newsview1484935.html

