以下文章来源于BioArt ,作者Victoria

BioArt
高屋建瓴,提供专家点评,引导学术争论,展现学术批评;诚心实意,关注科研生态,推广科研经验,倡导师生交流。

关注我们,获取更多相关资讯
目前大家普遍认为胰腺细胞感知并控制血糖的方式是通过葡萄糖激酶(GK)介导氧化磷酸化(OxPhos),降低ADP水平,从而控制胰岛素分泌所必需的质膜去极化【1】。从制药的角度考虑,如果使用GK激活剂通过葡萄糖引起细胞去极化就会刺激胰岛素分泌,但是目前尚无相关批准药物。
线粒体GTP(mtGTP)依赖的磷酸烯醇式丙酮酸(PEP)循环这条代谢通路对营养刺激的胰岛素分泌至关重要,它并不依赖氧化磷酸化,所以可能是另一条可靶向的治疗契机【2】。这个过程始于丙酮酸,丙酮酸通过线粒体丙酮酸羧化酶(PC)进入三羧酸循环,产生草酰乙酸(OAA),OAA通过GTP依赖的线粒体磷酸烯醇丙酮酸羧激酶(PCK2)分解生成PEP,PEP通过丙酮酸激酶(PK)水解,使得胞质ADP减少,循环完成,这个过程刺激了胰岛素的释放(图1)。于是作者提出问题:1)PK激活剂加速PEP循环在体内是否起作用?2)是否依赖于PCK2?3)胰岛性能有没有损伤?4)是否能够增强动物模型和糖尿病病人的胰岛素分泌?当然这个问题不局限于细胞,因为肝脏和红细胞中也有可激活形式的PK。
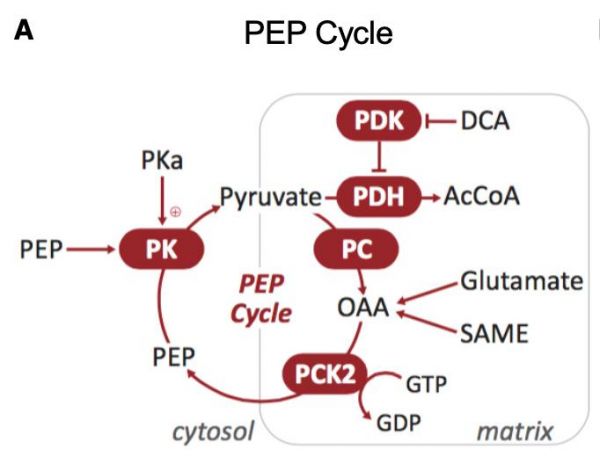
图1: mtGTP依赖的PEP周期示意图。
为了阐明这个问题,2020年11月3日,耶鲁大学Richard G. Kibbey团队和威斯康星大学麦迪逊分校的Matthew J. Merrins团队合作在Cell Metabolism杂志上发表题为Multi-Tissue Acceleration of the Mitochondrial Phosphoenolpyruvate Cycle Improves Whole-Body Metabolic Health的研究论文,在这篇研究论文中,作者发现PCK2依赖性磷酸烯醇丙酮酸(PEP)循环的小分子活化作用增加了葡萄糖刺激的胰岛素分泌,而这个过程并没有出现胰岛损伤的迹象,还改善了体内胰岛素敏感性。同时,在糖尿病动物模型还发现,这种现象伴随着糖异生减少、血红细胞糖酵解增加和肝脂肪变性减小等。提示PK激活剂可能是治疗糖尿病及其并发症的有效新途径。

mtGTP依赖性PEP循环将肝脏和胰岛中的PCK2与PK偶联以调节葡萄糖稳态。在糖尿病的动物模型中,作者发现小分子PK激活剂加速了PEP循环,使得胰岛功能以及代谢稳态得以改善。如果采用pck2-/-小鼠进行实验,发现用PK并不能改善胰岛素分泌。与其他临床上促进胰岛素分泌的药物不同,PK活化既增强了胰岛素分泌,还诱导长生了更多的胰岛素。
除了改善胰岛素分泌外,急性PK激活还抑制了糖异生途径,从而减少了内源性葡萄糖的产生,同时还加速了红细胞葡萄糖的更新。在高脂饲喂的大鼠中, PK激活剂能够重塑PK的磷酸化,减少肝脏脂肪,并改善肝脏和外周胰岛素敏感性。这些新发现为PK活化、加速PEP周期、从而改善代谢稳态和胰岛素敏感性提供了临床前依据(图2)。
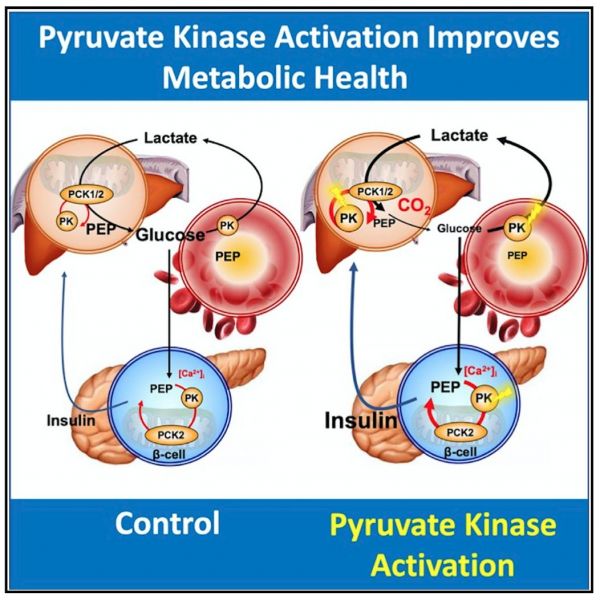
图2: PK活化改善代谢稳态和胰岛素敏感性
与这项研究呼应,在同期的Cell Metabolism杂志上,同样来自威斯康星大学麦迪逊分校的Matthew J. Merrins团队和耶鲁大学Richard G. Kibbey团队合作发表了题为Pyruvate Kinase Controls Signal Strength in the Insulin Secretory Pathway的研究论文,在这篇研究论文中,作者证明丙酮酸激酶(而非氧化磷酸化)触发ATP/ADP关闭细胞的KATP通道以启动胰岛素分泌。丙酮酸激酶的小分子激活剂通过将线粒体从氧化磷酸化转换为磷酸烯醇丙酮酸生物合成来有效地促进胰岛素分泌。

回顾前文,胰腺细胞维持血糖正常的方式是将营养代谢特别是葡萄糖代谢与适当的胰岛素分泌相结合,其中的机制是是通过线粒体中的葡萄糖氧化,产生质子动力,通过ATP合酶提高ATP/ADP比率,关闭KATP通道触发Ca2+内流,引起胰岛素与质膜融合【1】。以此为出发点,与上一篇文章不同的机制是,作者发现PK将ADP和PEP转化为ATP和丙酮酸,发挥了细胞感受器作用,用以感知糖酵解和线粒体代谢。
质膜定位的PK有能力关闭KATP通道并引发Ca2+内流。而小分子PK激活剂改善ATP/ADP和Ca2+波动,有效地增加了胰岛素的分泌。PK通过周期性地剥夺线粒体ADP来限制呼吸,从而加速PEP循环(图3),直到膜去极化恢复ADP和氧化磷酸化。
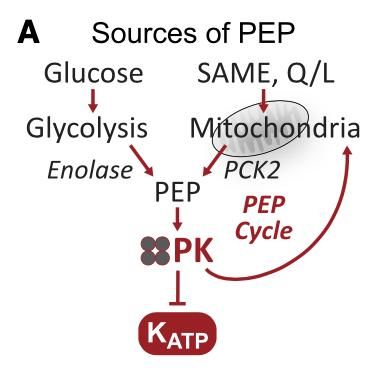
图3: 糖酵解和线粒体相关的PEP循环。(SAME:琥珀酸单甲酯;PCK2,线粒体磷酸烯醇式丙酮酸羧激酶;Q/L,谷氨酰胺/亮氨酸)
不同于经典模型(Canonical 1-state model),作者提出了2态模型(Revised 2-state model),这个机制是目前经典途径无法预测的,即通过降低ADP,PK在OxPhos和PEP生物合成之间切换(图4),这种切换模型不会影响葡萄糖氧化。
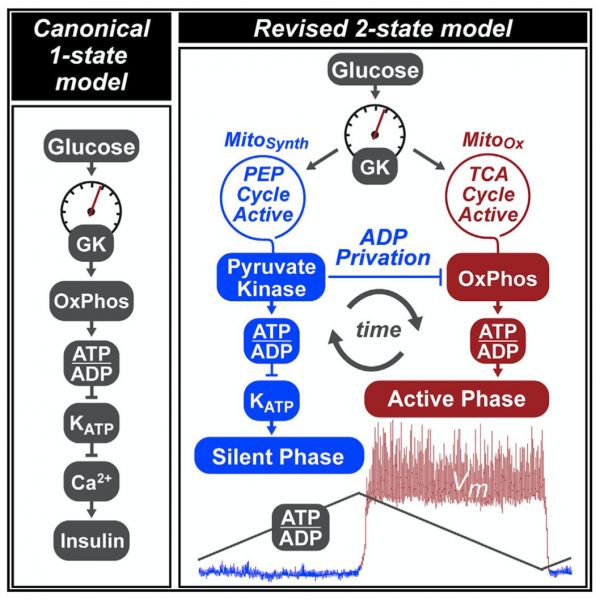
图4: PK在OxPhos和PEP生物合成之间的切换模型
这个模型在动物实验中的有效性于背靠背的前一篇论文中已经得到了验证,PK激活剂增强了胰岛素分泌的能力,同时还巩固了糖酵解能力。激活PK的优势体现在不增加葡萄糖氧化的情况下促进了代谢反应。
治疗2型糖尿病的常用策略包括增加胰岛输出和降低胰岛素抵抗,然而,通常通过促进胰岛素分泌的过程会引起胰岛过度劳损并加重胰岛素抵抗,在这两项研究中,作者采用的PK激活策略能同时改善胰岛输出和胰岛素抵抗,而且,还改善了胰岛本身的功能,更厉害的是,这种作用不仅仅在胰岛中,在肝脏和外周的胰岛素抵抗都得以改善。这些发现提示了基于PK活化的糖尿病潜在治疗途径。
当然,这两篇论文把PEP循环单独拉出来研究是有争议的,毕竟调控胰岛素分泌的机制非常复杂,除了作者提到的通路之外,有多种营养感应机制参与其中,在不同组织和物种中也都不同,这种活化PK以抗糖尿病的方法最终要经得起在人身上的验证,才能真正带来突破性的曙光。
原文链接:
https://doi.org/10.1016/j.cmet.2020.10.006
https://doi.org/10.1016/j.cmet.2020.10.007
参考文献
1. Prentki, M., Matschinsky, F.M., and Madiraju, S.R.M. (2013). Metabolic signaling in fuel-induced insulin secretion. Cell Metab. 18, 162–185.
2. Jesinkey, S.R., Madiraju, A.K., Alves, T.C., Yarborough, O.H., Cardone, R.L., Zhao, X., Parsaei, Y., Nasiri, A.R., Butrico, G., Liu, X., et al. (2019). Mitochondrial GTP links nutrient sensing to b cell health, mitochondrial morphology, and insulin secretion independent of OxPhos. Cell Rep. 28, 759–772.e10.
来源:BioArt

1980-2020
喜欢此内容的人还喜欢
原标题:《【学术前沿】糖尿病治疗新途径:丙酮酸激酶可同时改善胰岛素分泌和胰岛素抵抗》
