肠源性三甲胺生成机制及其饮食调控
摘 要: 食物中含有的胆碱、左旋肉碱、甜菜碱等物质在肠道菌群的作用下可转化为三甲胺(trimethylamine, TMA)。TMA极易被肠道上皮细胞吸收,通过门静脉循环被转运至肝脏后氧化为氧化三甲胺(trimethylamine-N-oxide, TMAO),血浆中TMAO的水平与人体心血管疾病的发生发展密切相关。因此,肠源性TMA被认为是一种心血管疾病的风险标志。TMA作为肠道菌群的一种代谢产物,将饮食、肠道菌群、心血管疾病三者有机地联系到了一起,为通过饮食和肠道菌群预防和治疗心血管疾病,提供了新的靶点;心血管疾病严重危害人类健康,通过对肠源性TMA生成机制及其饮食调控的分析,可为控制肠源性TMA、降低心血管疾病发生提供参考。阐述了肠源性TMA前体物质的食物来源、参与TMA生成的肠道微生物,系统阐释了TMA在人体内的代谢途径。针对肠源性TMA的控制,从减少食物中TMA前体物质摄入、降低产生TMA肠道菌群的比例、抑制产生TMA的酶类以及干预TMA分子合成途径等方面分别总结了肠源性TMA的控制策略。针对具有良好应用前景的益生菌和古菌干预策略,归纳和分析了目前益生菌和古菌对TMA影响的研究成果,为预防心血管疾病提供可能的方向。
三甲胺(trimethylamine, TMA)是一种低沸点、含氮小分子化合物[1]。食物中的胆碱、左旋肉碱、甜菜碱等物质在肠道菌群的作用下可转化为TMA[2],肠道中的TMA极易被肠道上皮细胞吸收进入血液并对心肌细胞产生细胞毒性作用,被认为是一种心血管疾病的风险标志[3]。研究发现,心血管疾病患者血液TMA含量与肾小球滤过率呈负相关(肾小球滤过率降低是一个独立的心血管危险因素)[4]。同时,TMA通过血液进入肝脏氧化形成氧化三甲胺(trimethylamine-N-oxide, TMAO),TMAO通过促进炎症反应、影响胆固醇代谢和氧化应激反应、参与血栓形成等方式,诱导动脉粥样硬化的发生和发展,动脉粥样硬化是心血管疾病的病理基础[5]。临床研究也表明,血液中高水平的TMAO与心血管疾病的发生、发展密切相关[6]。因此,了解肠源性TMA的生成机制及影响因素,对降低TMA和TMAO对健康的危害具有重要意义。
1 肠源性TMA的形成和代谢
1.1 形成TMA的食物前体物质
TMA食物前体是肠源性TMA产生的物质基础,常见的TMA食物前体包括胆碱、左旋肉碱、甜菜碱及TMAO[7]。最近研究表明,左旋肉碱的一种前体物质N6,N6,N6-三甲基-L-赖氨酸(N6,N6,N6-trimethyl-L-lysine, TML)和组氨酸的一种含硫衍生物麦角硫氨酸,也被认为是TMA的食物前体[2,8]。图1是三甲胺及三甲胺相关的食物前体化合物。
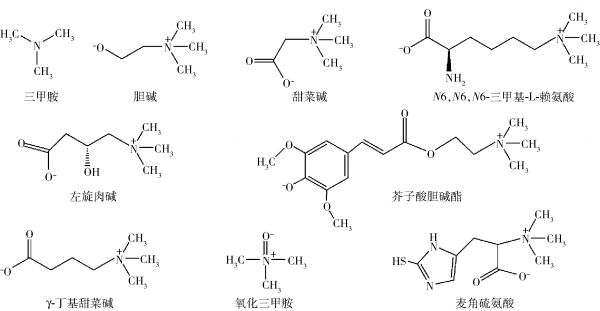
图1 三甲胺及三甲胺相关的食物前体化合物
Fig.1 Trimethylamine and trimethylamine-related food precursors
胆碱被认为是人体的条件必需营养素,可通过肝脏内源性生成,也能通过食物外源性摄入。肠道中的胆碱主要来自食物中游离的胆碱和胆碱酯。胆碱酯在相应酶类的作用下能够转化为胆碱,例如,卵磷脂在磷脂酶D的作用下可转化为胆碱[8]。通常,动物性食物比植物性食物含有更多的胆碱,鸡蛋和动物的肝脏是饮食中胆碱的主要来源,其次是肉和鱼、谷类、蔬菜、水果、牛奶、脂肪和油。一些植物性食物也含有丰富的胆碱,例如,芸苔科植物的种子中含有大量以酚类胆碱酯形式存在的胆碱,花椰菜和菜籽等食物中含有芥子酸胆碱酯[2]。左旋肉碱也分为内源性和外源性,外源性摄入的左旋肉碱主要来自动物性食物(如肉类和乳制品),谷物和蔬菜中也含有左旋肉碱但含量较低。红肉是左旋肉碱最丰富的食物来源,其次是动物的肝脏和蛋类食物。甜菜碱是甘氨酸的衍生物,人体可以通过胆碱代谢内源性合成甜菜碱,也可以通过食物外源性摄入[9],其中谷类食物是甜菜碱的主要来源,菠菜、甜菜、甲壳类和鳍鱼也含有丰富的甜菜碱。
TMAO是一种小分子胺,在鱼类和海洋无脊椎动物中广泛存在 [10]。人体内源性产生的TMAO主要来源于对TMA的氧化。海鱼和贝类是人体摄入外源性TMAO的主要来源,不同的鱼类TMAO含量存在显著差异,鳍鱼和软骨鱼中TMAO含量比其他鱼类高。TML是一种非蛋白质氨基酸,是左旋肉碱的前体,在蔬菜中主要以游离氨基酸的形式存在,是大多数哺乳动物日常营养的重要组成部分。通常,动物性食物中的TML高于植物性食物,在动物性食物中蛋和虾的含量较高,植物性食物中甜椒的含量较高[11]。麦角硫氨酸是组氨酸的一种含硫衍生物,目前只发现在一些真菌和细菌中能合成麦角硫氨酸。人体中麦角硫氨酸完全是通过食物获得,牛肝菌和平菇中麦角硫氨酸的含量较高,鸡肝、猪肝、猪肾、黑豆和红豆和燕麦麸皮中也含有麦角硫氨酸,但是含量较低[12]。
1.2 形成TMA的肠道菌群
肠源性TMA是其食物前体在肠道菌群的作用下产生的。肠道菌群的存在至关重要,因为人体自身不能合成产生TMA的酶类,产生TMA的酶都是肠道菌群代谢形成的[7]。参与肠源性TMA产生的肠道微生物涵盖了变形菌门(Proteus)、厚壁菌门(Firmicutes)、放线菌门(Actinomycetes)、拟杆菌门(Bacteroidetes)、梭杆菌门(Fusobacteria)等菌门[13-14]。
将胆碱转化为TMA的微生物主要包括:厚壁菌门中的链球菌属(Streptococcus)、生孢梭菌(Clostridium sporogenes)、哈氏梭菌(Clostridium hathewayi)、天冬酰胺梭菌(Clostridium asparagine)、氢化厌氧球菌(Hydrogenated anaerobic cocci),放线菌门中的动弯杆菌属(Campylobacter mobilis)、欧陆森菌属(Euglenum);蛋白菌门中的肠杆菌属(Enterobacter)、爱德华菌属(Edwardsiella)、弗格森大肠杆菌(Escherichia fergusonii )、脱硫弧菌(Desulfovibrio desulfuricans),变形菌门中的克雷伯氏菌属(Klebsiella)、彭内氏变形杆菌属(Proteus penneri)、普罗维登斯菌属(Providence)[15-16]。
将左旋肉碱转化为TMA的微生物主要包括:变形菌门(Proteus)、拟杆菌门(Bacteroidetes)和普氏杆菌科(Proteaceae)。
甜菜碱既作为胆碱和左旋肉碱转化为TMA的中间体,又作为一种单独的TMA饮食前体,将甜菜碱转化为TMA的主要微生物包括:放线菌门中的梭菌属(Clostridium)和真细菌属(Eubacteria)[17]。
饮食摄入的TMAO主要是在肠杆菌科(Enterobacteriaceae),尤其是大肠杆菌(Escherichia coli)和肺炎克雷伯氏菌(Klebsiella pneumoniae)的作用下转化为TMA[18]。
TMA是由肠道菌群代谢产生的,但是将TMA食物前体转化为TMA的物质是肠道菌群产生的酶,因此产生TMA的酶受到了广泛关注,目前大多数的研究集中在编码酶的基因上。例如,携带胆碱三甲胺裂解酶(choline TMA-lyase , CutC)的肠道厌氧微生物都含有CutC基因,该基因编码的CutC在胆碱TMA裂解酶活化酶(choline TMA-lyase activating enzyme, CutD)的作用下可催化胆碱初始C—N键的断裂,产生TMA和乙醛[19]。研究发现,携带CutC基因的肠道微生物存在于不同的生态位上,如乳链球菌(Streptococcus lactis)、克雷伯氏菌(Klebsiella pneumoniae)、催产克雷伯氏菌(Klebsiella oxytociae)、肠球菌(Enterococcus)等[20]。
1.3 TMA的代谢途径
食物中的TMA前体物质进入肠道,在肠道菌群及其代谢酶作用下转化为TMA,TMA被肠道上皮细胞吸收进入血液,经门静脉循环转运到肝脏中,随后被黄素单加氧酶(flavin-containing monooxygenases, FMOs)氧化为TMAO(如图2)。氧化生成的TMAO最终会随着尿液和汗液被机体排出体外。
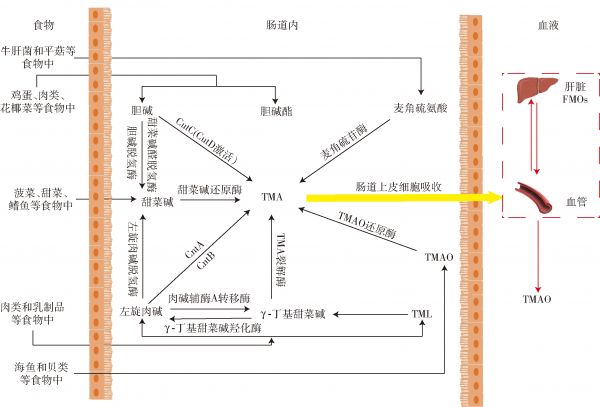
图2 TMA食物前体的主要食物来源、代谢途径以及TMA在肝脏FMOs作用下氧化为TMAO的代谢途径
Fig.2 Main food sources, metabolic pathways of TMA dietary precursors, and metabolic pathways of TMA oxidized to TMAO under action of hepatic FMOs
不同的TMA前体物质转变为TMA的路径是不一样的,胆碱产生TMA的途径有直接和间接两种方式,胆碱可被携带CutC(由CutD激活[16])的肠道厌氧微生物直接代谢成TMA,胆碱也可以通过胆碱脱氢酶和甜菜碱醛脱氢酶两种酶的协同作用被氧化成甜菜碱,再由甜菜碱还原酶还原为TMA[21]。左旋肉碱产生TMA也有直接和间接两种方式,肉碱加氧酶(carnitine oxygenase, CntA)和肉碱还原酶(carnitine reductase, CntB)是将左旋肉碱直接转化为TMA的主要酶,左旋肉碱也可先被肉碱辅酶A转移酶催化为γ-丁基甜菜碱(γ-丁基甜菜碱也可由γ-丁基甜菜碱羟化酶催化为左旋肉碱),然后在TMA裂解酶的作用下,γ-丁基甜菜碱转化为TMA[22]。
此外,左旋肉碱也可在左旋肉碱脱氢酶的作用下转化为甜菜碱,再由甜菜碱还原酶还原为TMA。在胆碱和左旋肉碱转化为TMA的过程中,甜菜碱可以作为其中间体转化为TMA,同时甜菜碱也作为一种单独的饮食前体存在于许多植物中,甜菜碱可在甜菜碱还原酶的作用下转化为TMA,但是目前的研究只发现甜菜碱在绵羊的瘤胃中能够代谢为TMA,还没有研究表明在大鼠和人类中甜菜碱可以代谢为TMA[23]。TML是左旋肉碱的一种前体物质,TML在体内可转化为左旋肉碱,进而通过左旋肉碱转化为TMA。麦角硫氨酸通过麦角硫苷酶可直接转化为TMA[2]。饮食摄入的TMAO可直接被TMAO还原酶还原为TMA[18]。
2 肠源性TMA的控制策略
2.1 减少食物中TMA前体物质摄入
肠源性TMA产生的物质基础是食物前体,减少食物中TMA前体物质的摄入,就可以从源头上降低TMA的产生。同时,通过饮食控制TMA产生是相对安全的方式,但是,这种方法在实际生活中却难以实施。TMA前体物质存在于不同的食物中,鸡蛋是胆碱和卵磷脂的主要来源,红肉是左旋肉碱、胆碱和卵磷脂的来源,海鲜是TMAO和甜菜碱的来源;因此,通过饮食控制十分困难。更重要的是,TMA前体物质本身也是一种营养物质,如果它们不被肠道菌群代谢成TMA,对人类是有益的,甚至是必不可少的。例如胆碱是一种基本营养素,缺乏胆碱会导致严重的肝功能障碍、脂肪变性和神经紊乱,左旋肉碱是人体必需的营养物质,负责脂肪酸的转运[24]。因此,通过减少食物中TMA前体物质的摄入来控制肠源性TMA,难以操作。
2.2 降低产生TMA肠道菌群的比例
通过调节肠道菌群,降低产生TMA肠道菌群的比例是控制肠源性TMA的主要研究方向[25]。但是将TMA前体物质代谢成TMA的微生物非常多,从庞大的肠道微生物区系中精准地抑制产生TMA的微生物十分困难[26]。此外,健康人体的肠道菌群拥有显著的多样性和弹性,可以抵抗外界的干扰。抑制产生TMA的肠道菌群,使TMA产生变少,这种作用效果有可能是短暂的,最终由于人体肠道区系的自我调节,这种抑制作用可能减弱或消失[27]。使用抗生素来调节肠道菌群减少TMA的产生,是一种最直接且简单的方法,但是这种方式会消灭肠道内对人体健康有益的微生物。
目前更多的研究集中在重塑肠道微生物区系,降低肠道中TMA的生成。Chen 等[28]研究表明,白藜芦醇能够重塑肠道微生物区系进而减少TMA的生成。Su 等[29]研究提出,二甲双胍可通过重塑肠道微生物区系并降低代谢胆碱三甲胺裂解酶的肠道菌群丰度来减少TMA的产生。Li 等[30]发现从黄连、小檗等中草药中提取的黄连素(小檗碱)可通过调节肠道菌群进而减少TMA的产生。
2.3 抑制产生TMA的酶类
TMA是由肠道菌群代谢的酶类对TMA前体物质直接作用生成的,抑制产生TMA的酶类能够直接抑制TMA产生。抑制产生TMA的酶类是比较安全可靠的方式,但是产生TMA酶类较多,这也为抑制产生TMA酶类带来一定的困难[31]。胆碱和左旋肉碱作为TMA的两大主要食物前体,抑制它们转化为TMA尤为重要。左旋肉碱转化为TMA的CntA是种好氧酶,然而人体肠道中氧气体积分数范围在0.2%~1%,这可能会限制CntA作用的发挥[32]。目前主要考虑的是抑制CutC的活性, Wang等[33]研究表明,胆碱的结构类似物3,3-二甲基-1-丁醇(3,3-dimethyl-1-butanol, DMB)能够抑制CutC的活性,并降低高胆碱饮食小鼠的TMAO水平。Roberts等[34]研究显示,氟甲基胆碱和碘甲基胆碱比DMB抑制CutC效果更突出,降低高胆碱饮食小鼠血浆TMAO水平更显著。
2.4 其他方式
除了抑制产生TMA的前体物质、肠道菌群和相关酶类外,在TMA分子合成途径进行干预或者对已生成的TMA进行干预也可以降低肠源性TMA的水平。找到原本会形成TMA的季胺(如胆碱、肉碱和甜菜碱)去甲基化的物质,使其不能正常的合成TMA分子,对肠道中已经生成的TMA产生降解或者促进TMA的排泄也能一定程度上控制肠道中的TMA。此外,通过益生菌和古菌,降低肠源性TMA也被广泛关注。
3 益生菌和古菌对TMA产生的影响
3.1 益生菌对TMA产生的影响
益生菌通过调节肠道菌群,使产生TMA的肠道微生物丰度下降,进而降低肠道中TMA的产生[35]。此外,益生菌也可能直接将肠道中的TMA降解或者促进TMA转化为其他物质。表1列举了益生菌降低机体肠道TMA的相关案例。
表1 益生菌对机体TMA的影响及其机制
Tab.1 Effects of probiotics on TMA and its mechanism
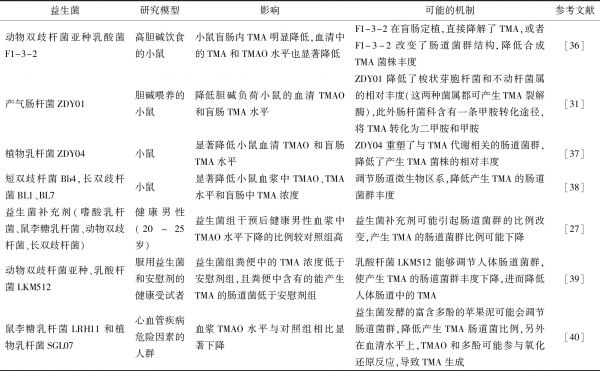
益生菌研究模型影响可能的机制参考文献动物双歧杆菌亚种乳酸菌F1-3-2高胆碱饮食的小鼠小鼠盲肠内TMA明显降低,血清中的TMA和TMAO水平也显著降低F1-3-2在盲肠定植,直接降解了TMA,或者F1-3-2改变了肠道菌群结构,降低合成TMA菌株丰度[36]产气肠杆菌ZDY01胆碱喂养的小鼠降低胆碱负荷小鼠的血清TMAO和盲肠TMA水平ZDY01降低了梭状芽胞杆菌和不动杆菌属的相对丰度(这两种菌属都可产生TMA裂解酶),此外肠杆菌科含有一条甲胺转化途径,将TMA转化为二甲胺和甲胺[31]植物乳杆菌ZDY04小鼠显著降低小鼠血清TMAO和盲肠TMA水平ZDY04重塑了与TMA代谢相关的肠道菌群,降低了产生TMA菌株的相对丰度[37]短双歧杆菌Bb4,长双歧杆菌BL1、BL7小鼠显著降低小鼠血浆中TMAO、TMA水平和盲肠中TMA浓度调节肠道微生物区系,降低产生TMA的肠道菌群丰度[38]益生菌补充剂(嗜酸乳杆菌、鼠李糖乳杆菌、动物双歧杆菌、长双歧杆菌)健康男性(20~25岁)益生菌组干预后健康男性血浆中TMAO水平下降的比例较对照组高益生菌补充剂可能引起肠道菌群的比例改变,产生TMA的肠道菌群比例可能下降[27]动物双歧杆菌亚种、乳酸杆菌LKM512服用益生菌和安慰剂的健康受试者益生菌组粪便中的TMA浓度低于安慰剂组,且粪便中含有的能产生TMA的肠道菌低于安慰剂组乳酸杆菌LKM512能够调节人体肠道菌群,使产生TMA的肠道菌群丰度下降,进而降低人体肠道中的TMA[39]鼠李糖乳杆菌LRH11和植物乳杆菌SGL07心血管疾病危险因素的人群血浆TMAO水平与对照组相比显著下降益生菌发酵的富含多酚的苹果泥可能会调节肠道菌群,降低产生TMA肠道菌比例,另外在血清水平上,TMAO和多酚可能参与氧化还原反应,导致TMA生成[40]
3.2 古菌对TMA产生的影响
古菌作为潜在的益生菌,其安全性需要进一步验证,目前应用古菌降低肠源性TMA仍有一定的局限性,但是古菌降低人体TMA的可能性早已有文献报道。通常认为,古菌降低TMA的产生,主要是通过将肠道中的TMA转化为甲烷,甲烷不易被肠道吸收、对人体生理不起作用;此外,古菌代谢的特定成分也可以作为肠道TMA的隔离物,促进TMA随粪便排泄[41]。
Brugère等[42]提出利用存在于人体肠道中的产甲烷菌将TMA转化为惰性分子来减少TMA在肠道中的形成,并通过实验证实发光甲烷球菌B10能够利用氢气(肠道中存在的氢气浓度较高)还原TMA产生甲烷,为发光甲烷球菌B10降低肠道中TMA的产生提供一种可能性。Hania等[43]从人类粪便样本中分离的肠道高山甲烷杆菌Mx1201能够在氢气存在的情况下利用TMA,从而降低肠道TMA 。Ramezani等[44]筛选了5种能够利用TMA作为前体物质产生甲烷的产甲烷古菌,在饲喂高胆碱饲料的正常C57BL/6小鼠中评估了它们的定植能力和降低TMA能力,发现这5种产甲烷古菌都具有在小鼠体内定植和降低血浆TMAO水平的能力;进一步将其中表现较好的4种菌移植到饲喂高胆碱的基因缺陷型(ApoE-/-)小鼠体内,结果发现,血浆TMAO浓度随产甲烷古菌定植程度的增加而显著降低,其中一种来源于人类肠道的史密斯分枝杆菌对高胆碱喂养的基因缺陷型(ApoE-/-)小鼠的血浆TMAO水平的降低效果最好,且有减轻动脉粥样硬化的趋势。
4 结 语
心血管疾病严重危害人类健康。据世界心脏联盟统计,在全世界范围内,每死亡3人,就有1人是心血管病症。2021年7月发布的《中国心血管健康与疾病报告》显示,2018年我国心血管疾病患病人数3.3亿,死亡率居榜首。如何预防、减缓心血管疾病的发生是应对我国老龄化日趋严重背景下的重要课题。肠源性TMA作为新的心血管疾病的风险标志,为从饮食和肠道菌群的角度预防心血管疾病提供了新的物质基础和靶点。长期以来,肠道菌群与健康的相关性被大量研究所证实,然而两者的因果关系却一直存在争议;由于微生物难以像化学成分一样被精准检测和监测,导致相关性研究停留在以现象解释现象的表观相关性研究。TMA作为第一个被充分研究的肠道微生物代谢相关的分子,为深入阐释饮食、肠道菌群与健康疾病之间复杂的互动机制,提供了新的契机,必将被更广泛地关注。
参考文献:
[1] CHHIBBER-GOEL J, GAUR A, SINGHAL V, et al. The complex metabolism of trimethylamine in humans: endogenous and exogenous sources[J]. Expert Reviews in Molecular Medicine, 2016, 18: e8.
[2] SIM C, GARCA-CAAS V. Dietary bioactive ingredients to modulate the gut microbiota-derived metabolite TMAO: new opportunities for functional food development[J]. Food & Function, 2020, 11(8):6745-6776.
[3] JAWORSKA K, HERING D, MOSIENIAK G, et al. TMA, a forgotten uremic toxin, but not TMAO, is involved in cardiovascular pathology[J]. Toxins, 2019, 11(9):490.
[4] GO A S, CHERTOW G M, FAN D, et al. Chronic kidney disease and the risks of death, cardiovascular events, and hospitalization[J]. New England Journal of Medicine, 2004, 351(13):1296-1305.
[5] HE Z, CHEN Z Y. The origin of trimethylamine-N-oxide (TMAO) and its role in development of atherosclerosis[J]. Journal of Food Bioactives, 2018, 2:28-36.
[6] TANG W W, WANG Z, KENNEDY D J, et al. Gut microbiota-dependent trimethylamine-N-oxide (TMAO) pathway contributes to both development of renal insufficiency and mortality risk in chronic kidney disease[J]. Circulation Research, 2015, 116(3):448-455.
[7] ONISZCZUK A, ONISZCZUK T, GANCARZ M, et al. Role of gut microbiota, probiotics and prebiotics in the cardiovascular diseases[J]. Molecules, 2021, 26(4):1172.
[8] JANEIRO M H, RAMREZ M J, MILAGRO F I, et al. Implication of trimethylamine-N-oxide (TMAO) in disease: potential biomarker or new therapeutic target[J]. Nutrients, 2018, 10(10):1398.
[9] WILLINGHAM B D, RAGLAND T J, ORMSBEE M J. Betaine supplementation may improve heat tolerance: potential mechanisms in humans[J]. Nutrients, 2020, 12(10):2939.
[10] ZERBST-BOROFFKA I, KAMALTYNOW R M, HARJES S, et al. TMAO and other organic osmolytes in the muscles of amphipods (Crustacea) from shallow and deep water of lake baikal[J]. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physio-logy, 2005, 142(1):58-64.
[11] LI X S, WANG Z, CAJKA T, et al. Untargeted metabolomics identifies trimethyllysine, a TMAO-producing nutrient precursor, as a predictor of incident cardiovascular disease risk[J]. JCI Insight, 2018, 3(6): 99096.
[12] BORODINA I, KENNY L C, MCCARTHY C M, et al. The biology of ergothioneine, an antioxidant nutraceutical[J]. Nutrition Research Reviews, 2020, 33(2):190-217.
[13] JIN M, QIAN Z, YIN J, et al. The role of intestinal microbiota in cardiovascular disease[J]. Journal of Cellular and Molecular Medicine, 2019, 23(4):2343-2350.
[14] ZHANG W Q, WANG Y J, ZHANG A, et al. TMA/TMAO in hypertension: novel horizons and potential therapies[J]. Journal of Cardiovascular Translational Research, 2021, 14(6): 1117-1124.
[15] 周嘉,李宾公.肠道菌群及其代谢产物氧化三甲胺在心血管疾病中的研究进展[J].广东医学,2020,41(24):2590-2593.
ZHOU J,LI B G. Research progress of intestinal flora and its metabolite trimethylamine-N-oxide in cardiovascular diseases[J]. Guangdong Medicine,2020, 41(24):2590-2593.
[16] RAMIREDDY L, TSEN H Y, CHIANG Y C, et al. The gene expression and bioinformatic analysis of choline trimethylamine-lyase (CutC) and its activating enzyme (CutD) for gut microbes and comparison with their TMA production levels[J]. Current Research in Microbial Sciences, 2021,2:100043.
[17] FENNEMA D, PHILLIPS I R, SHEPHARD E A. Trime-thylamine and trimethylamine-N-oxide, a flavin-containing monooxygenase 3 (FMO3)-mediated host-micro-biome metabolic axis implicated in health and disease[J]. Drug Metabolism and Disposition, 2016, 44(11):1839-1850.
[18] HOYLES L, JIMÉNEZ-PRANTEDA M L, CHILLOUX J, et al. Metabolic retroconversion of trimethylamine-N-oxide and the gut microbiota[J]. Microbiome, 2018, 6(1):1-14.
[19] HENG X, LIU W, CHU W. Identification of choline-degrading bacteria from healthy human faeces and used for screening of trimethylamine (TMA)-lyase inhibitors[J]. Microbial Pathogenesis, 2021, 152:104658.
[20] VIA A D, GARGARI G, TAVERNITI V, et al. Urinary TMAO levels are associated with the taxonomic composition of the gut microbiota and with the choline TMA-lyase gene (CutC) harbored by enterobacteriaceae[J]. Nutrients, 2020, 12(1):62.
[21] ZHU Y, LI Q, JIANG H. Gut microbiota in atherosclerosis: focus on trimethylamine-N-oxide[J]. APMIS, 2020, 128(5):353-366.
[22] DAY-WALSH P, SHEHATA E, SAHA S, et al. The use of an in-vitro batch fermentation (human colon) model for investigating mechanisms of TMA production from choline, L-carnitine and related precursors by the human gut microbiota[J]. European Journal of Nutrition, 2021, 60(7): 3987-3999.
[23] SCHMIDT A C, LEROUX J C. Treatments of trimethylaminuria: where we are and where we might be heading[J]. Drug Discovery Today, 2020, 25(9): 1710-1717.
[24] UELAND P M. Choline and betaine in health and disease[J]. Journal of Inherited Metabolic Disease, 2011, 34(1):3-15.
[25] AN A. Gut microbiota in vascular disease: therapeutic target?[J]. Current Vascular Pharmacology, 2017, 15(4):291-295.
[26] LOUCA S, JACQUES S M, PIRES A P, et al. High taxonomic variability despite stable functional structure across microbial communities[J]. Nature Ecology & Evolution, 2016, 1(1):1-12.
[27] CHEN S, JIANG P P, YU D, et al. Effects of probiotic supplementation on serum trimethylamine-N-oxide level and gut microbiota composition in young males: a double blinded randomized controlled trial[J]. European Journal of Nutrition, 2021, 60(2): 747-758.
[28] CHEN M, LONG Y, YONG Z, et al. Resveratrol attenuates trimethylamine-N-oxide (TMAO)-induced atherosclerosis by regulating TMAO synthesis and bile acid metabolism via remodeling of the gut microbiota[J]. mBio, 2016, 7(2):e02210-e2215.
[29] SU C, LI X, YANG Y, et al. Metformin alleviates choline diet-induced TMAO elevation in C57BL/6J mice by influencing gut-microbiota composition and functionality[J]. Nutrition & Diabetes, 2021, 11(1):1-6.
[30] LI X, SU C, JIANG Z, et al. Berberine attenuates choline-induced atherosclerosis by inhibiting trimethylamine and trimethylamine-N-oxide production via manipulating the gut microbiome[J]. NPJ Biofilms and Microbiomes, 2021, 7(1):1-14.
[31] QIU L, YANG D, TAO X, et al. Enterobacter aerogenes ZDY01 attenuates choline-induced trimethylamine-N-oxide levels by remodeling gut microbiota in mice[J]. Journal of Microbiology and Biotechnology, 2017, 27(8):1491-1499.
[32] KALNINS G, SEVOSTJANOVS E, HARTMANE D, et al. CntA oxygenase substrate profile comparison and oxygen dependency of TMA production in Providencia rettgeri[J]. Journal of Basic Microbiology, 2018, 58(1):52-59.
[33] WANG Z, ROBERTS A B, BUFFA J A, et al. Non-lethal inhibition of gut microbial trimethylamine production for the treatment of atherosclerosis[J]. Cell, 2015, 163(7):1585-1595.
[34] ROBERTS A B, GU X, BUFFA J A, et al. Development of a gut microbe-targeted nonlethal therapeutic to inhibit thrombosis potential[J]. Nature Medicine, 2018, 24(9):1407-1417.
[35] SKELLY A N, SATO Y, KEARNEY S, et al. Mining the microbiota for microbial and metabolite-based immunotherapies[J]. Nature Reviews Immunology, 2019, 19(5):305-323.
[36] LIANG X, ZHANG Z, LV Y, et al. Reduction of intestinal trimethylamine by probiotics ameliorated lipid metabolic disorders associated with atherosclerosis[J]. Nutrition, 2020, 79:110941.
[37] QIU L, TAO X, XIONG H, et al. Lactobacillus plantarum ZDY04 exhibits a strain-specific property of lowering TMAO via the modulation of gut microbiota in mice[J]. Food & Function, 2018, 9(8):4299-4309.
[38] WANG Q, GUO M, LIU Y, et al. Bifidobacterium breve and bifidobacterium longum attenuate choline-induced plasma trimethylamine -N-oxide production by modulating gut microbiota in mice[J]. Nutrients, 2022, 14(6):1222.
[39] MATSUMOTO M, KITADA Y, SHIMOMURA Y, et al. Bifidobacterium animalis subsp. lactis LKM512 reduces levels of intestinal trimethylamine produced by intestinal microbiota in healthy volunteers: a double-blind, placebo-controlled study[J]. Journal of Functional Foods, 2017, 36:94-101.
[40] TENORE G C, CARUSO D, BUONOMO G, et al. Lactofermented annurca apple puree as a functional food indicated for the control of plasma lipid and oxidative amine levels: results from a randomised clinical trial[J]. Nutrients, 2019, 11(1):122.
[41] FADHLAOUI K, ARNAL M-E, MARTINEAU M, et al. Archaea, specific genetic traits, and development of improved bacterial live biotherapeutic products: another face of next-generation probiotics[J]. Applied Microbiology and Biotechnology, 2020, 104(11):4705-4716.
[42] BRUGRE J, BORREL G, GACI N, et al. Archaebio-tics: proposed therapeutic use of archaea to prevent trimethylaminuria and cardiovascular disease[J]. Gut Microbes, 2014, 5(1): 5-10.
[43] HANIA W B, BALLET N, VANDECKERKOVE P, et al. Archaebiotics: archaea as pharmabiotics for treating chronic disease in humans?[M]∥SGHAIER H. Archaea: new biocatalysts, novel pharmaceuticals and various biotechnological applications. Rijeka, Italian: InTech Open Access Publisher, 2017: 41-62.
[44] RAMEZANI A, NOLIN T D, BARROWS I R, et al. Gut colonization with methanogenic archaea lowers plasma trimethylamine-N-oxide concentrations in apolipoprotein E-/- mice[J]. Scientific Reports, 2018, 8(1): 1-11.
相关知识
肠源性三甲胺生成机制及其饮食调控
荷叶生物碱成分及其调脂机制研究进展
食品中化学性危害及预防控制.ppt
华大基因正式发布“氧化三甲胺代谢通路检测”产品,世界肠道健康日
康源牌甲壳素胶囊的药理机制
碧生源牌减肥茶的药理机制
仔猪肠道菌群演替调控肠道免疫发育的作用与机制
运动角度:肠道菌群对机体的益处及其机制
一种甲壳素纳米纤维/聚苯胺复合凝胶膜及其制备方法专利转让
营养研究进展:肉鸡肠道微生物及其调控
网址: 肠源性三甲胺生成机制及其饮食调控 https://m.trfsz.com/newsview1737979.html