运动和癌症都会导致脂肪组织萎缩。然而,只有癌症相关的体重减轻,即恶病质,以严重的脂肪炎症和纤维化为特征。
2025年2月27日,北京大学肖瑞平、胡新立共同通讯在Cell Metabolism 在线发表题为“MIF-ACKR3 causes irreversible fat loss by impairing adipogenesis in cancer cachexia”的研究论文,该研究证明MIF-ACKR3通过损害癌症恶病质中的脂肪生成导致不可逆的脂肪减少。
在这里,研究人员确定了肿瘤分泌的巨噬细胞移动抑制因子(MIF)是一个主要的驱动因子,它使脂肪干细胞和祖细胞(ASPCs)的分化偏向促炎和促纤维化的方向,在癌症恶病质中具有降低的成脂能力。相比之下,运动后循环MIF适度减少。从机制上讲,ASPCs中的非典型趋化因子受体3(ACKR3)是介导其病理效应的主要MIF受体。通过肿瘤细胞的基因切除或药物阻断抑制MIF,以及ASPC特异性Ackr3缺陷,显著缓解肿瘤诱导的恶病质。这些发现揭示了MIF-ACKR3信号是肿瘤和恶病质表现之间的关键联系,为癌症恶病质提供了有希望的治疗靶点。

癌症恶病质是一种破坏性的消耗综合征,影响患者的生活质量,并限制治疗的疗效和选择。尽管进行了广泛的研究,但由于缺乏对其病因的深入了解,仍然没有有效的解决方案来满足这种医疗需求。
已有研究证明,在动物模型中,脂肪组织消耗先于骨骼肌萎缩,并且加速的脂肪组织损失是患者生存结果不佳的重要指标。与健康体重减轻不同,癌症恶病质相关的体重减轻以夸大的脂肪炎症和纤维化为特征,其潜在机制仍然知之甚少。
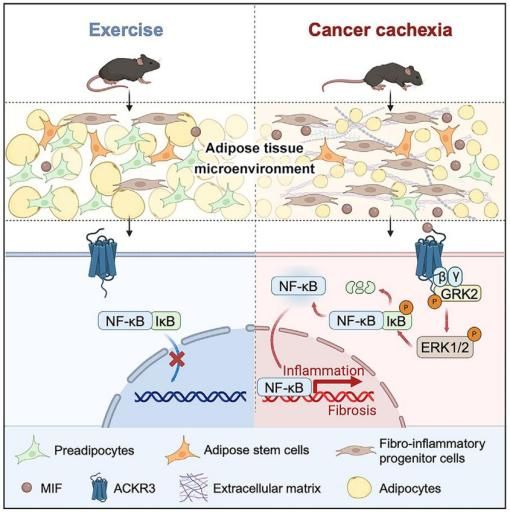
机理模式图(图源自Cell Metabolism)
在这项研究中,研究人员发现受损的脂肪生成是小鼠腹股沟白色脂肪组织(iWAT)中运动(EX)诱导的和肿瘤(TB)触发的体重减轻之间的主要区别过程。单细胞RNA测序(scRNA-seq)揭示了肿瘤细胞与脂肪干细胞和祖细胞(ASPCs)之间通过巨噬细胞移动抑制因子(MIF)及其受体非典型趋化因子受体3 (ACKR3)的通讯促进了恶病质小鼠的脂肪炎症和纤维化,促成了异常的成脂程序,而MIF-ACKR3信号在慢性感染后没有增强。重要的是,在肺腺癌(LUAD)诱导的恶病质患者中也观察到MIFACKR3的激活,这突出了靶向MIF-ACKR3信号在治疗癌症恶病质中的治疗潜力。
论文链接:
https://www.cell.com/cell-metabolism/fulltext/S1550-4131(25)00018-X
本文转载自公众号:iNature
往期推荐
原标题:《【科技前沿】Cell Metab | 北京大学肖瑞平/胡新立揭示肿瘤引起脂肪不可逆消耗关键机制》