Nature子刊:孙宇团队发现衰老细胞代谢调控关键机制,揭示其对肿瘤等增龄相关慢病的深刻影响
 2023年10月31日,中国科学院上海营养与健康研究所孙宇研究组在 Nature 子刊 NatureMetabolism 上发表了题为:PDK4-dependenthypercatabolism and lactate production of senescence cells promotes cancermalignancy 的研究论文。该研究揭示了衰老相关分泌表型(SASP)广谱表达的同时一种关键代谢因子——丙酮酸脱氢酶激酶4(PDK4)在衰老细胞中显著上调,后者可以介导衰老细胞代谢重编程并使其呈现一种葡萄糖高分解代谢的特性。该研究系统解析了细胞衰老、乳酸生成、器官退行和增龄相关疾病之间的关联,并开创了相应的干预策略。
2023年10月31日,中国科学院上海营养与健康研究所孙宇研究组在 Nature 子刊 NatureMetabolism 上发表了题为:PDK4-dependenthypercatabolism and lactate production of senescence cells promotes cancermalignancy 的研究论文。该研究揭示了衰老相关分泌表型(SASP)广谱表达的同时一种关键代谢因子——丙酮酸脱氢酶激酶4(PDK4)在衰老细胞中显著上调,后者可以介导衰老细胞代谢重编程并使其呈现一种葡萄糖高分解代谢的特性。该研究系统解析了细胞衰老、乳酸生成、器官退行和增龄相关疾病之间的关联,并开创了相应的干预策略。 在深度分析衰老细胞的表达特征和代谢活性时,研究团队注意到与葡萄糖分解代谢有关的蛋白酶PDK4在细胞衰老过程中显著上调,并且在不同类型衰老细胞中均有出现。在表达规律上,PDK4跟大多数SASP因子几乎同步上调,此后基本维持在一个平台期,并且在基质细胞中的幅度显著高于癌细胞。在对前列腺癌和乳腺癌临床样本进行分析时,发现化疗后阶段癌症患者病灶中PDK4的表达水平同组织中的细胞衰老程度直接相关,并跟疗后阶段癌症患者的生存期之间负相关。这些数据表明,PDK4在衰老细胞群中的表达可能具有重要的病理意义。研究团队进而发现与增殖细胞相比,衰老细胞的糖酵解强度和TCA循环活性均发生了深刻变化。与葡萄糖酵解密切相关的代谢物如DHAP、GAP和3-PG的产量均有上升,后两者的变化表明衰老细胞能进一步利用一些中间代谢物,如柠檬酸、α-酮戊二酸、谷氨酸、琥珀酸、富马酸和苹果酸。一些酵解支路和TCA循环相关的基因,如GLUT1、MCT4、HIF1α、PGK1、PGI和CS普遍在衰老细胞中上调表达。在基于荷瘤小鼠的预临床试验中,发现衰老细胞的存在加速了肿瘤进展,但敲除PDK4之后这一趋势则被明显抑制。尽管PDK4特异性抑制剂PDK4-IN的单独治疗没有产生明显益处,但化疗药物MIT治疗则导致肿瘤显著缩小。当PDK4-IN与MIT联合使用时,研究团队观察到肿瘤进一步缩小;与安慰剂组相比,肿瘤体积总体降低了75.1%。组织学分析表明,接受MIT治疗的小鼠肿瘤组织中SA-β-GAL阳性水平升高,但PDK4-IN给药则导致SA-β-GAL阳性率降低,暗示PDK4可能会促进化疗条件下动物体内衰老进程。
在深度分析衰老细胞的表达特征和代谢活性时,研究团队注意到与葡萄糖分解代谢有关的蛋白酶PDK4在细胞衰老过程中显著上调,并且在不同类型衰老细胞中均有出现。在表达规律上,PDK4跟大多数SASP因子几乎同步上调,此后基本维持在一个平台期,并且在基质细胞中的幅度显著高于癌细胞。在对前列腺癌和乳腺癌临床样本进行分析时,发现化疗后阶段癌症患者病灶中PDK4的表达水平同组织中的细胞衰老程度直接相关,并跟疗后阶段癌症患者的生存期之间负相关。这些数据表明,PDK4在衰老细胞群中的表达可能具有重要的病理意义。研究团队进而发现与增殖细胞相比,衰老细胞的糖酵解强度和TCA循环活性均发生了深刻变化。与葡萄糖酵解密切相关的代谢物如DHAP、GAP和3-PG的产量均有上升,后两者的变化表明衰老细胞能进一步利用一些中间代谢物,如柠檬酸、α-酮戊二酸、谷氨酸、琥珀酸、富马酸和苹果酸。一些酵解支路和TCA循环相关的基因,如GLUT1、MCT4、HIF1α、PGK1、PGI和CS普遍在衰老细胞中上调表达。在基于荷瘤小鼠的预临床试验中,发现衰老细胞的存在加速了肿瘤进展,但敲除PDK4之后这一趋势则被明显抑制。尽管PDK4特异性抑制剂PDK4-IN的单独治疗没有产生明显益处,但化疗药物MIT治疗则导致肿瘤显著缩小。当PDK4-IN与MIT联合使用时,研究团队观察到肿瘤进一步缩小;与安慰剂组相比,肿瘤体积总体降低了75.1%。组织学分析表明,接受MIT治疗的小鼠肿瘤组织中SA-β-GAL阳性水平升高,但PDK4-IN给药则导致SA-β-GAL阳性率降低,暗示PDK4可能会促进化疗条件下动物体内衰老进程。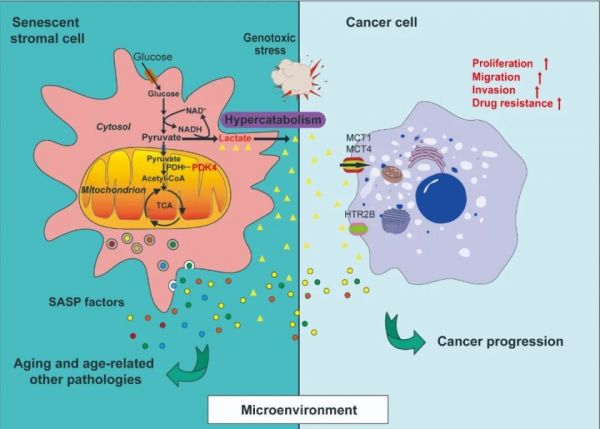 衰老细胞PDK4介导的代谢重编程和乳酸富集型微环境对于癌症等增龄性疾病的影响研究团队随后选择在治疗开始后的第7天从体内解剖肿瘤,而这是耐药性克隆出现之前的一个重要时间点。与安慰剂组相比,MIT本身导致癌细胞显著的DNA损伤和凋亡。虽然PDK4-IN单独用药既不能引起典型的DDR,也不能诱导细胞凋亡,但与MIT联合使用则对提高这些指标有显著效果。在MIT给药后,典型的凋亡指标尤其caspase 3自裂解增加,而PDK4-IN与MIT联用则进一步增强了这一趋势。将PDK4靶向药物与经典化疗相结合可增强肿瘤对治疗的反应,而不会引起严重的全身性细胞毒效应,肝肾等主要器官功能未受影响,说明这一组合方案的可行性和安全性,具有将来向临床转化的良好前景。中国科学院上海营养与健康研究所博士生窦雪峰、滨州医学院教授付强及复旦大学附属中山医院泌尿外科龙启来博士为该论文共同第一作者。中国科学院上海营养与健康研究所孙宇研究员、华东理工大学药学院赵玉政教授为共同通讯作者。该工作得到中国科学院战略先导科技专项、国家重点研发计划、国家自然科学基金、上海市科委以及中国科学院上海营养与健康研究所所级公共技术平台和动物平台的支持。
衰老细胞PDK4介导的代谢重编程和乳酸富集型微环境对于癌症等增龄性疾病的影响研究团队随后选择在治疗开始后的第7天从体内解剖肿瘤,而这是耐药性克隆出现之前的一个重要时间点。与安慰剂组相比,MIT本身导致癌细胞显著的DNA损伤和凋亡。虽然PDK4-IN单独用药既不能引起典型的DDR,也不能诱导细胞凋亡,但与MIT联合使用则对提高这些指标有显著效果。在MIT给药后,典型的凋亡指标尤其caspase 3自裂解增加,而PDK4-IN与MIT联用则进一步增强了这一趋势。将PDK4靶向药物与经典化疗相结合可增强肿瘤对治疗的反应,而不会引起严重的全身性细胞毒效应,肝肾等主要器官功能未受影响,说明这一组合方案的可行性和安全性,具有将来向临床转化的良好前景。中国科学院上海营养与健康研究所博士生窦雪峰、滨州医学院教授付强及复旦大学附属中山医院泌尿外科龙启来博士为该论文共同第一作者。中国科学院上海营养与健康研究所孙宇研究员、华东理工大学药学院赵玉政教授为共同通讯作者。该工作得到中国科学院战略先导科技专项、国家重点研发计划、国家自然科学基金、上海市科委以及中国科学院上海营养与健康研究所所级公共技术平台和动物平台的支持。相关知识
营养与健康所孙宇研究组发现衰老细胞代谢调控关键机制并揭示其对肿瘤等增龄相关慢病的深刻影响
营养与健康所等发现衰老细胞代谢调控关键机制
昨天Nature、今天Cell,迟洪波团队揭示Treg细胞保护癌症新机制及CD8+T细胞命运决定关键代谢通路
浙大孙毅团队发现拟素化修饰调控肿瘤细胞谷氨酰胺吸收和代谢
Nature|抗衰老新发现!研究揭示衰老细胞如何影响脂肪积累
Hepatology:尹慧勇团队发现肝癌肿瘤细胞代谢影响肿瘤免疫新机制
为阿尔茨海默病防治提供新策略:厦门大学张杰团队揭示小胶质细胞糖脂代谢调控新机制
Nature子刊:林爱福团队揭示LncRNA通过重编程铁代谢调控肿瘤进程
Nature子刊:朱正江团队发现蛋白激酶RIPK1对饥饿应激的代谢调控机制
骨骼健康关键在“抗衰”:张长青团队刊发成果揭示骨细胞调控骨骼衰老
网址: Nature子刊:孙宇团队发现衰老细胞代谢调控关键机制,揭示其对肿瘤等增龄相关慢病的深刻影响 https://m.trfsz.com/newsview1863977.html