ω
肖御喆编译 医学营养MNT 2022-08-10 22:26 发表于江西
收录于合集

摘要氧化应激和炎症被认为是慢性非传染性疾病风险的重要因素。多不饱和脂肪酸(PUFAs)可能调节抗氧化信号通路与炎症过程。它们还会影响肝脏的脂质代谢和包括心脏在内的其他器官的生理反应。纵向前瞻性队列研究表明,适量摄入omega-6多不饱和脂肪酸亚油酸与较低的心血管疾病(CVD)风险之间存在关联,这很可能是由于血液中胆固醇浓度较低所致。目前的证据表明,增加花生四烯酸的摄入量(每天高达1500mg)对血小板聚集和凝血、免疫功能和炎症标志物没有不良影响,但可能有利于肌肉和认知能力。许多研究表明,omega-3多不饱和脂肪酸,特别是二十碳五烯酸(EPA)和二十二碳六烯酸(DHA)的摄入量较高,与包括心血管疾病在内的以炎症升高为特征的慢性疾病的发病率较低有关。这是因为EPA和DHA的多种分子和细胞作用。使用EPA+DHA的干预试验表明,EPA+DHA对心血管疾病死亡率有好处,EPA+DHA摄入量与心血管疾病结局之间存在显著的反线性剂量-反应关系。除了抗氧化和消炎作用外,omega-3脂肪酸还被认为可以调节血小板稳态,降低血栓形成的风险,这些都表明它们在新冠肺炎治疗中的潜在用途。关键词:ω-6脂肪酸;ω-3脂肪酸;炎症;氧化应激;新冠肺炎
1、简介
尽管去年 COVID-19 大流行因严重急性呼吸系统综合症冠状病毒 2 感染导致超过 340 万人死亡,但慢性非传染性疾病 (NCD) 仍然很容易成为全球最常见的发病和死亡原因。世界卫生组织 (WHO) 估计,2018 年有 4100 万人死于非传染性疾病 [1],非传染性疾病包括心血管疾病 (CVD)、癌症、非传染性呼吸系统疾病和代谢疾病。除其他风险因素外,氧化应激和炎症已被认为是非传染性疾病风险的重要因素。非传染性疾病患者的炎症标志物水平升高,包括多种细胞因子和趋化因子 [2]。炎症是宿主防御的重要组成部分,首先通过为微生物创造不利的环境,然后通过启动组织修复、恢复和维持体内平衡。然而,长期(未解决)的炎症和促炎介质的持续释放会导致组织损伤、代谢变化和功能丧失 [3–5]。因此,炎症是一把“双刃剑”。同样,在低或中等浓度下,自由基(用于描述活性氧 (ROS) 和活性氮 (RNS) 的术语)在保护细胞免受各种有害影响(包括微生物)方面具有生理作用。此外,自由基在多种细胞类型(例如内皮细胞、成纤维细胞、心肌细胞和甲状腺组织)的细胞内信号级联中具有调节功能 [6]。然而,当自由基的产生超过特定浓度并干扰细胞氧化还原电位时,就会出现不利影响。例如,许多细胞结构会因氧化应激而受损,包括细胞膜、蛋白质、脂质、脂蛋白和 DNA [6]。炎症和氧化应激是相互关联的:氧化应激可以激活炎症信号通路,而炎症诱导氧化应激(图1 [7])。
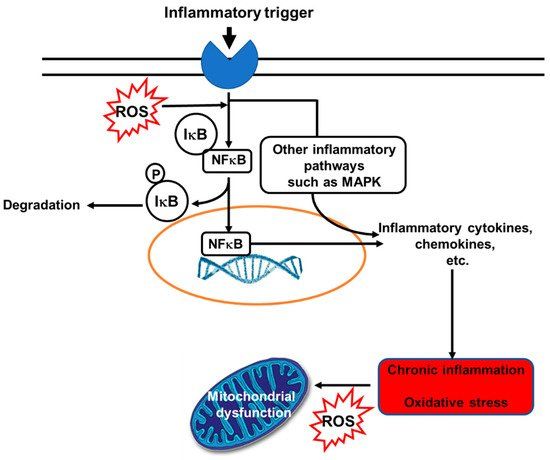
图 1. 炎症和氧化应激之间的双向联系。活性氧 (ROS) 可以作为引发炎症的炎症触发器。另一方面,炎症会诱发氧化应激。使用的缩写:IkB,NFkB 的抑制亚基;MAPK,丝裂原活化蛋白激酶;NFkB,活化 B 细胞的核因子 kappa-轻链增强子;P,磷酸盐;ROS,活性氧。转载自[7]。
脂肪酸是细胞膜磷脂的一个组成部分,具有特定的功能、代谢和信号作用 [8]。不同的细胞具有不同的脂肪酸组成,这些组成会影响膜的流动性和柔韧性,以及膜蛋白的功能 [8]。多不饱和脂肪酸 (PUFA) 摄入量不同会导致细胞膜磷脂中 PUFA 水平不同,从而对细胞功能以及细胞和组织对信号的反应性发挥作用(图 2)。多不饱和脂肪酸可以通过调节抗氧化信号通路 [9,10]起到抗氧化剂的作用,并且可以调节炎症过程 [10,11]。本综述将提供有关 PUFA 及其对人类健康影响的知识的最新信息。
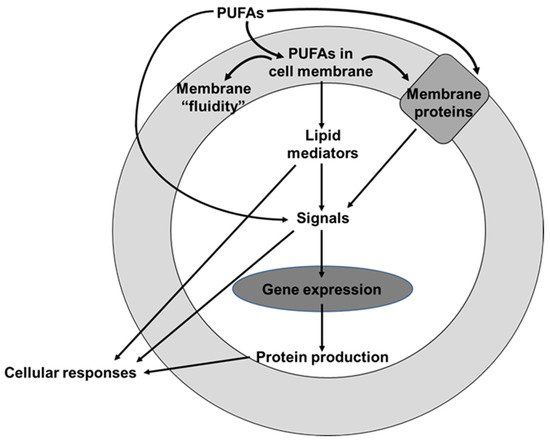
图 2. 多不饱和脂肪酸 (PUFA) 如何影响细胞反应的示意图。
2. Omega-6 和 Omega-3 多不饱和脂肪酸
与人类健康相关的 PUFA 主要有两个家族,即 omega-6 和 omega-3 PUFA。在大多数饮食中,含量最高的 PUFA 是亚油酸 (LA, 18:2ω-6) 和 α-亚麻酸 (ALA, 18:3ω-3)。LA 和 ALA 不在动物体内合成,因此被视为必需脂肪酸。因为它们是在植物中合成的,所以 LA 和 ALA 主要以高比例存在于植物源食品中。例如,许多种子、坚果和植物油都富含 LA;这些包括红花、向日葵和南瓜子;核桃; 以及玉米、向日葵、红花和大豆油。南瓜籽、核桃和大豆油也是 ALA 的良好来源,亚麻籽和亚麻籽油也是如此。PUFA 的重要性首先在大鼠研究中得到描述,在大鼠研究中,PUFA 缺乏会导致许多严重的症状[12]。人体中很少描述必需脂肪酸缺乏症,但据说摄入量低会导致皮炎、肾性高血压、线粒体活动障碍、心血管疾病、2 型糖尿病、大脑发育受损、关节炎、抑郁和身体对感染的抵抗力降低 [13]。其中一些缺陷可能是由于 LA 和 ALA 摄入量低造成的。然而,它们也可能是由于 LA 和 ALA 的代谢产物水平低,包括长链 omega-6 PUFA 花生四烯酸 (AA, 20:4ω-6) 和长链 omega-3 PUFA 二十碳五烯酸(EPA, 20:5ω-3) 和二十二碳六烯酸 (DHA, 22:6ω-3)。LA 到 AA 和 ALA 到 EPA 的代谢转化共享相同的酶(图 3),这意味着 AA 和 EPA 的合成速率将取决于底物(即 LA 和 ALA)的相对可用性。典型的西方饮食的特点是 LA 摄入量比 ALA 高 5 到 15 倍 [14],这意味着 LA 是该途径的主要底物。这或许可以解释为什么人类的 ALA 代谢为 EPA 和 DHA 似乎受到限制[14],以及为什么血液和许多细胞类型中的 AA 水平大大超过 EPA 和 DHA 的水平 [15]。
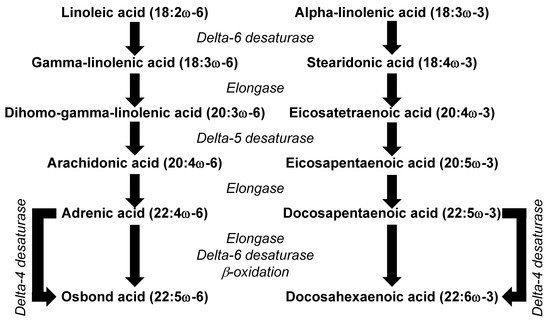
图 3. 必需脂肪酸转化为更不饱和及更长链的衍生物的途径。
3. Omega-6 多不饱和脂肪酸与人类健康
3.1.概述
LA 本身可能具有生理作用和健康益处,也可能作为合成其他 omega-6 PUFA 的底物,包括 γ-亚麻酸(GLA,18:3ω-6)、二高-γ-亚麻酸(DGLA) , 20:3ω-6) 和 AA(见图 3)。据认为,正常生长和发育需要 1-2% 的每日能量摄入量作为 LA。LA、GLA、DGLA 和 AA 都可以结合到细胞膜磷脂中,尽管 AA 通常以最高的量存在[15]。这具有生理学意义,因为 AA 是生物活性脂质介质的底物,其中许多被统称为类二十烷酸(见下文)。
3.2.Omega-6 多不饱和脂肪酸和皮肤
LA 在皮肤结构完整性和屏障功能方面具有特殊而独特的作用,因为它是神经酰胺的重要组成部分 [16]。表皮由细胞和富含脂质的细胞外基质(含 50% 神经酰胺、25% 胆固醇和 15% 游离脂肪酸)组成 [17]。细胞外基质形成角质层渗透屏障,其流动性取决于LA的含量,其他脂肪酸似乎无法替代LA的这一作用。由于缺乏所需的酶,皮肤将 LA 转化为 AA 的能力有限[18]。脂肪酸可以通过脂蛋白受体的细胞摄取传递到表皮,随后它们可以起到保护皮肤功能和外观并调节炎症反应的作用 [19,20]。不同的 PUFA 可以缓解与炎症性皮肤病(例如,特应性皮炎 (AD)/湿疹;银屑病)相关的症状,最有可能是通过促炎和抗炎类二十烷酸的比例变化 [18,21,22]。AD是具有复杂和多因素病理生理学的皮肤长期炎症。在 AD 的急性期,Th2 炎症通路占主导地位,白细胞介素 (IL)-4、-5、-13 和 -31 的释放增加,随后激活肥大细胞和嗜酸性粒细胞并产生特异性免疫球蛋白 E 抗体。细胞因子谱的变化伴随着急性到慢性皮肤炎症的进展,包括从 Th2 表型转向 Th1、Th22 和 Th17 表型 [22]。PUFA可以通过作为底物的脂质介质,如类二十烷酸(见后面),它直接参与炎症过程影响皮肤炎症[23,24],并通过类二十烷酸或其他机制调节免疫细胞功能和细胞因子的产生。预防活动性炎症和改善表皮屏障功能可能是 AD 患者的极好治疗方法。联合 omega-6 多不饱和脂肪酸(LA 油和 GLA 作为膳食补充剂)和长链 omega-3 多不饱和脂肪酸(特别是 EPA 和 DHA)治疗有可能改善皮肤的炎症过程[18],帮助疾病管理。
3.3.亚油酸、血液胆固醇和心血管疾病
已经确定适度摄入 LA 作为饱和脂肪酸的部分替代品,可降低血液总胆固醇和低密度脂蛋白 (LDL)-胆固醇浓度 [25,26]。这似乎是肝脏低密度脂蛋白受体(LDLR)基因和蛋白表达上调的结果,从而促进肝脏对循环低密度脂蛋白的清除[26]。LA 可能通过过氧化物酶体增殖物激活受体 (PPAR) 增强肝脏 X 受体α (LXRα) 基因的转录。反过来,LXRα 上调胆固醇 7α-羟化酶 (CYP7) 基因的表达,该基因编码调节胆固醇转化为胆汁酸途径的酶。因此,LA 有助于通过促进 CYP7 活性来分解胆固醇 [26]。为响应肝细胞中胆固醇的使用(用于胆汁酸合成),LDLR 的数量和活性增加 [26]。这涉及甾醇调节元件结合蛋白 (SREBP),它们是在调节体内胆固醇和甘油三酯水平方面具有重要作用的转录因子 [27]。SREBP 激活编码参与胆固醇摄取(即 LDLR)和胆固醇、脂肪酸和甘油三酯合成的蛋白质的基因的转录 [27]。SREBPs 是作为需要裂解激活的蛋白质产生的:这个过程由 SREBP 裂解激活蛋白 (SCAP) 促进,该蛋白结合天然 SREBPs,将它们运输到高尔基体进行蛋白水解加工 [28,29]。因此,SCAP 起到促进 SREBP 裂解的作用,从而调节 SREBP 活性。甾醇与 SCAP 结合并阻止 SCAP-SREBP 复合物离开内质网,从而阻碍天然 SREBP 的蛋白水解裂解并起到控制肝脏胆固醇稳态的作用 [29]。因此,SCAP 通路在肝脏脂质代谢的反馈调节中起着至关重要的作用 [28,29]。通过胆汁酸合成去除肝脏胆固醇,LA 将促进 SREBP 激活(通过 SCAP 活性),导致 LDLR 表达上调,因此有利于从循环中清除 LDL 胆固醇。
LA 对循环低密度脂蛋白胆固醇的另一个好处是它对前蛋白转化酶枯草杆菌蛋白酶 9 型 (PCSK9) [30] 的抑制作用,后者直接与 LDLR 相互作用 [31]。分泌的 PCSK9 与 LDLR 结合,促进其内化。通过降低 PCSK9,LA 有助于维持肝细胞膜上的 LDLR,因此有利于清除 LDL 胆固醇。LDLR、PCSK9 和载脂蛋白 B 基因的遗传变异与致动脉粥样硬化的脂质谱相关,因此心血管结果更差 [32]。在 232 名无关的日本患者中,6% 有 LDLR/PCSK9 基因变异,并且与只有 LDLR 基因变异的患者相比,LDL-胆固醇水平更高 [32]。此外,这些患者发生非致命性心肌梗死的风险更大 [32]。
预计 LA 降低 LDL-胆固醇的能力将导致降低 CVD 发病率和死亡率。一项前瞻性队列研究的系统评价和荟萃分析发现,用 LA 替代 5% 的饱和脂肪酸能量与冠心病 (CHD) 减少 9% 相关 [33]。在另一项对 30 项前瞻性队列研究的最新荟萃分析中,较高的循环和脂肪组织 LA(反映 LA 的摄入量)均与较低的主要心血管事件风险相关 [34]。因此,队列研究表明,较高的 LA 摄入量会导致较低的 CVD,这与通过上述机制发生的 LA 降低 LDL-胆固醇是一致的。然而,洛杉矶调查心血管死亡率的随机对照试验 (RCT) 模棱两可,表明死亡率增加 [35] 或没有总体影响 [36]。此类研究在别处进行了讨论 [37,38],需要着重注意的是,他们经常采用超过当前推荐摄入量的 LA 摄入量,将总 PUFA 限制为能量的 5% 至 10% [39,40]。此外,由于食用基于植物油的涂抹酱,大量反式脂肪的存在似乎混淆了对 LA 的干预 [41]。尽管 RCT 明显失败,但目前的证据支持摄入 LA 在降低 CVD 风险方面的潜在长期益处。最新的荟萃分析报告了 38 项研究的结果,涉及 44 个前瞻性队列,共 811,069 名参与者(几乎一半的研究发表于 2014 年至 2020 年期间),比较了高和低膳食 LA 摄入量 [42]。在为剂量反应分析提供足够数据的研究中,洛杉矶类别的估计中位数摄入量介于能量的 1.1% 至 11.6% 之间。通过饮食调查或通过使用生物标志物(脂肪组织或血液隔室中的 LA 浓度)评估,较高的 LA 摄入量与适度降低全因、CVD 和癌症导致的死亡风险相关 [42]。膳食 LA 摄入量与癌症或所有原因导致的死亡率之间的关联是非线性的。与从 LA 摄入的最低能量相比,5% 来自 LA 的能量摄入和 10% 从饮食 LA,它是 0.88 (95% CI 0.73, 1.05)。对于癌症死亡率,来自洛杉矶的 5% 和 10% 的能量摄入的 RR 分别为 0.96 (95% CI 0.94, 0.98) 和 0.83 (95% CI 0.78, 0.89)。当排除参与者在基线时患有癌症的两项研究时,对于来自洛杉矶的 5% 和 10% 的能量摄入,总死亡率的 RR 分别为 0.94 (95% CI 0.86, 1.02) 和 0.81 (95% CI 0.69, 0.96) ,以最低的 LA 摄入量作为参考。膳食 LA 摄入量与 CVD 死亡率之间呈线性关系。
3.4.亚油酸和大脑
由于它在大脑中的浓度较低(< 总脂肪酸的 2%),LA 被认为是无功能的,特别是与 AA 和 DHA 相比,它们可以贡献高达 40% 的大脑脂肪酸 [43] . 似乎超过一半进入大脑的 LA 成为 β-氧化的底物或作为合成氧化代谢物的前体 [44]。这些代谢物在大脑中的作用尚不完全清楚,尽管它们可能与偏头痛等疾病有关。在这种情况下,拉姆斯登等人。表明,将膳食 LA 从能量的 7% 降低到 2%,并在三个月内每天摄入 1.5 克 EPA 和 DHA 可降低偏头痛频率并提高生活质量 [45]。目前尚不清楚这是否是低 LA 的影响、增加的长链 omega-3 多不饱和脂肪酸或两者结合的影响。因此,在不改变 EPA 和 DHA 的情况下单独长期降低 LA 方案对偏头痛的影响仍有待研究。
3.5.花生四烯酸作为生物活性脂质介质的前体
在骨骼肌、大脑、肝脏、血小板和免疫细胞的磷脂中,AA 可以提供高达 25% 的脂肪酸 [46]。细胞膜中 AA 的脱酰化和再酰化使细胞中游离 AA 的水平保持在较低水平,并限制了其氧化作用 [47]。AA 与分子氧通过环氧化酶 (COX)、脂肪氧化酶 (LOX) 和细胞色素 P450 途径的反应导致产生介质,这些介质统称为类花生酸,包括前列腺素 (PG)、血栓烷 (TX) 和白三烯 ( LTS)(图4)[24,48]。
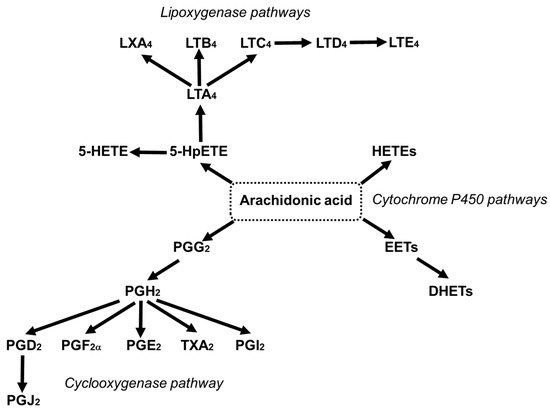
图 4. 花生四烯酸转化为生物活性介质的环氧合酶、脂肪加氧酶和细胞色素 P450 途径概述。DHET,二羟基二十碳三烯酸;EET,环氧二十碳三烯酸;HETE,羟基二十碳四烯酸;HpETE,氢过氧二十碳四烯酸;LX,脂氧素;LT,白三烯;PG,前列腺素;TX,血栓素。
磷脂酶 A2 可以将 AA 从细胞膜释放到细胞质中 [49,50]。在生理上,释放的大部分 AA 会迅速并入膜磷脂,使脂肪酸无法作为氧化底物 [51]。因此,在“休息”条件下,类二十烷酸产量低,产生的代谢物通过调节生理过程在维持体内平衡方面发挥作用 [24]。然而,在某些刺激(例如炎症刺激)存在的情况下,会释放足够的 AA 以驱动类二十烷酸形成的显著增加。因此,在这种情况下,类二十烷酸如 PGD2和 E2和 4 系列 LT 的产量增加,并具有作为炎症反应的介质和调节剂的作用 [24]。因此,这些类二十烷酸中的许多与炎性疾病有关,并且多种抗炎药靶向参与其合成和作用的酶 [24]。然而,现在认识到 AA 衍生的代谢物在炎症消退中也有作用:例如,脂氧素 A 4是一种有效的促消退介质 [52,53]。有趣的是,炎症反应早期类二十烷酸的产生与后期诱导消退有关。这些考虑使我们对 omega-6 多不饱和脂肪酸(尤其是 AA)在炎症中的作用的理解变得复杂 [54]。
除了它们在调节免疫和炎症中的作用[24],AA衍生的类二十烷酸参与调节血小板聚集,止血,血栓形成和血管张力[55,56,57]。类二十烷酸可以作为血管扩张剂(例如,PGE2和 PGI2)或血管收缩剂(例如,TXA 2和半胱氨酰-LTs),因此影响血流和血压。TXA2和 PGI2通过它们对血小板和血管平滑肌细胞的作用,在血管稳态和控制血流中发挥核心作用。TXA2主要由血小板通过 COX-1 产生,当血小板被激活时其产生增加。TXA2促进平滑肌收缩,作为血管收缩剂,并且是血小板的有效激活剂,导致它们聚集并导致血栓形成。PGI2(有时称为前列环素)主要由内皮细胞产生。它是一种有效的血管扩张剂,可抑制血小板聚集和平滑肌细胞增殖。因此,TXA2和PGI2产生的平衡建立了血管张力和血栓形成潜力。PGD 2也是血小板聚集的抑制剂 [58],而 PGE2的作用与其浓度有关 [58]。
3.6.增加花生四烯酸摄入量的影响
AA 常见于动物源性食物中,例如肉类、内脏(肝脏、肾脏)和鸡蛋。在发达国家,AA 的平均每日摄入量估计在 100 至 350 mg的范围内,约占总能量摄入量的 0.1% [59]。此外,AA 可以从 LA 合成(图 3)。尽管 LA 向其他 omega-6 PUFA 的转化有限(大约 1% 到 2.2%),但从 LA 合成 AA 似乎是一种重要的代谢途径,用于维持细胞膜中的 AA 水平 [60,61] 。然而,在西方饮食中看到的范围内 LA 摄入量的变化不会导致血液或细胞脂质中 AA 含量的差异 [62],并且补充 6.5 克/天的 LA(如葵花籽油)的饮食不会影响健康受试者外周血单核细胞(淋巴细胞和单核细胞)的 AA 含量 [63],无论 LA 是 AA 合成的前体。后一个发现的原因可能是西方饮食中 LA 的摄入量已经很高,这意味着从 LA 合成 AA 的途径已经饱和。一项包含 36 项 RCT 结果的系统评价发现,相对于西方饮食中的平均摄入量(约 10 克/天),增加或减少 LA 的摄入量都不会影响血浆/血清磷脂或红细胞中的 AA 浓度 [62]。
补充 AA 本身会以剂量依赖性方式增加不同血池中 AA 的含量 [59]。预计这可能会影响炎症、免疫反应和血液凝固等过程,这些过程都由 AA 产生的类二十烷酸调节(见上文)。然而,最近对成人进行的一项研究的系统评价得出结论,将 AA 摄入量增加至 1000-1500 mg/天对血小板聚集和凝血、免疫功能和炎症标志物没有不利影响 [59]。事实上,已经报道了额外的 AA 对认知功能的一些好处 [64],这在人口老龄化中尤为重要。此外,在体育训练活动期间补充 AA(600 mg/天)可改善运动表现并增加身体力量、峰值功率和运动后合成代谢信号 [65]。有人提出 1000 mg/天的 AA 实际上减少了炎症,表现为较低的 IL-6,同时它增加了 PGE2,这是一种潜在的致力因子,从而增加了对高强度训练的耐受性 [66]。来自 AA 的类二十烷酸通过控制成肌细胞的分化、增殖和存活来促进骨骼肌生长,特别是在健康受试者的体力活动期间和之后 [50]。此外,AA是参与社会行为、疼痛和心境调制和控制神经过程的一些常见的内源性大麻素的组分[67,68]。此外,发现内源性大麻素可调节胃肠道炎症 [69]、肾功能 [70]和精子活力 [71]。游离 AA 在通过负责大脑、心脏和肌肉细胞兴奋性的离子通道起作用的神经元活动中也发挥着重要作用 [72]。
3.7.γ-亚麻酸和二高-γ-亚麻酸的作用
GLA 存在于一些植物种子油中,包括月见草油、黑醋栗油和琉璃苣油(分别占脂肪酸的 9%、17% 和 21%)[73]。然而,它在典型饮食中的含量非常低。GLA 似乎在许多细胞和组织中有效转化为 DGLA,包括一些炎症细胞 [73]。GLA 在循环脂质、细胞和组织中的含量很低,因为它可以快速转化为 DGLA。另一方面,DGLA 存在于大多数细胞的循环脂质和膜磷脂中,补充 GLA 后,DGLA 水平升高 [63,74,75]。DGLA 是 COX 和 LOX 及其代谢物(例如 PGE1) 据报道主要具有抗炎特性和抑制血小板聚集 [73]。因此,循环、细胞或组织中 AA/DGLA 的比例可能会影响炎症过程和血栓形成。细胞和组织将 GLA 延长为 DGLA,然后将 DGLA 去饱和为 AA 的不同酶活性将决定 AA/DGLA 的比率,从而决定其代谢物的平衡。一些炎症细胞,如人类中性粒细胞,似乎具有相对于去饱和酶活性而言较高的延长酶,但许多其他组织(脑、肠、肝、肾)似乎同时具有这两种活性 [73]。有趣的是,补充 GLA 会导致特定炎症细胞中 DGLA 升高,但不会导致 AA 升高,而循环脂质和某些组织中的 DGLA 和 AA 水平均升高 [73]。
4. Omega-3 多不饱和脂肪酸与人类健康
4.1.DHA 与大脑和眼睛的发育
EPA 和 DHA 在体内都具有重要的功能 [76]。DHA有许多作用:它参与透过细胞膜调节氨基酸(胆碱,甘氨酸,牛磺酸)的主动运输[77,78],调节钠通道的功能[72],并在启动的视紫红质的响应视觉刺激[79]。DHA是在中枢神经系统和视网膜最丰富的ω-3脂肪酸[80],这并不奇怪,因为它的作用:它是神经传递,神经可塑性和信号转导重要[81,82,83,84]。DHA 会增加神经组织中血清素和乙酰胆碱的浓度 [85],并且是独特调节分子的前体,包括(神经)保护素 D1 [86]。DHA 不仅对于视觉和神经系统的功能和维持,而且对于产前和产后早期的大脑和视觉发育 [80,87]似乎都是是必不可少的。在这种情况下,有证据表明,怀孕期间补充 omega-3 多不饱和脂肪酸与后代的认知和视觉发育以及大脑功能有关 [80,85]。然而,对孕期补充 omega-3 多不饱和脂肪酸的 11 项随机对照试验的系统评价表明,各组之间在认知、语言或运动发育方面几乎没有差异,除了 2 至 5 岁儿童的认知评分,其中母亲omega-3 补充剂导致更高的发育标准分数 [88]。然而,由于 DHA 在认知和视觉发育中早期作用的有力证据,欧洲食品安全局已强制要求将 DHA 包含在婴儿配方奶粉中 [89]。
4.2.EPA 和 DHA 以及心理、精神和行为障碍
尽管历史上非常关注 DHA 在早期认知和视觉发育中的作用,但由于其在大脑和视觉系统中的含量高,omega-3 多不饱和脂肪酸可能在婴儿期后的大脑中发挥重要作用,并且可能对大脑很重要在整个生命过程中发挥作用 [85,90,91,92,93]。
许多研究报告称,与对照儿童相比,患有注意力缺陷多动障碍或自闭症谱系障碍的儿童血流中的 EPA 和 DHA 水平较低 [94] 并且假定使脂肪酸水平正常化将导致临床获益。这些条件。这已经在大量针对注意力、学习或行为障碍的儿童和青少年进行的试验中得到检验,一些试验显示出一些改善,但另一些则发现没有效果[76]。这些试验经过多次审查和荟萃分析,得出不同的结论 [95-99]。不同的发现很可能与研究之间不同的几个因素有关,包括使用的 omega-3 多不饱和脂肪酸的剂量、EPA 与 DHA 的平衡、补充的持续时间、测量的精确结果以及儿童的差异学习了。一项综述得出结论,使用更高剂量的 omega-3 多不饱和脂肪酸或持续时间更长的研究或在社会经济地位低的儿童/青少年中进行的研究更有可能证明其益处[95]。
来自九个国家的数据被用来证明年度鱼类消费量与重度抑郁症的患病率之间存在显著的负相关 [100]。这一观察结果与 omega-3 多不饱和脂肪酸对抑郁症的保护作用相一致。许多观察性研究调查了鱼类与 omega-3 脂肪酸摄入量和抑郁症之间的关系;此类研究经过荟萃分析 [101]:与最低摄入量的 EPA + DHA 相比,最高摄入量与 0.82 的抑郁症相对风险相关(95% CI 0.73, 0.92)。在抑郁症患者中也有一些 EPA + DHA 的随机对照试验。例如,一项使用非常高剂量的 EPA + DHA(9.6 g/d)的小型研究报告了抑郁症状的减少[102],而在单独使用较低剂量 DHA(2 g/d)的研究中未观察到这种效果[103]。EPA + DHA(6.2 g/d)给予 4 个月显著改善了双相躁狂抑郁症患者的几乎所有结果,包括抑郁症状 [104]。同样,EPA(2 g/d,持续 4 周)改善了单相抑郁症患者的症状 [105]。有许多涉及抑郁症参与者的 RCT 荟萃分析,包括最近发表的一些文章 [106-111]对 26 项研究(包括 2160 名参与者)的分析确定了 EPA + DHA 的总体益处 [108]。此外,分析表明,使用纯 EPA 制剂或含有 >60% EPA 的制剂与临床益处相关,而纯 DHA 或富含 DHA 的制剂没有显示益处。另一项对 20 项 RCT 的荟萃分析也确定了 omega-3 多不饱和脂肪酸 [109] 的显著益处,但得出的结论是需要更高质量的证据。最近的另一项荟萃分析发现 EPA + DHA 对“健康”的老年人(> 65 岁)的抑郁症状没有显著影响,而 EPA + DHA 对患有抑郁症的老年人有“巨大影响”[110]。故得出的结论是“omega-3 PUFA 可有效治疗老年抑郁症患者”[110]。尽管有这些发现,但重要的是要注意,最近对抑郁症中 EPA + DHA 的随机对照试验的一些荟萃分析没有发现有益的证据 [111]。尽管如此,国际营养精神病学研究学会支持使用 omega-3 PUFA 来预防高危人群的抑郁症以及治疗孕妇、儿童和老年人的抑郁症 [112]。建议使用纯 EPA 或 EPA + DHA 的组合,比例至少为 2 有利于 EPA,而建议的 EPA 剂量为 1 - 2g/d。
精神分裂症患者的红细胞中 EPA 和 DHA 水平低于对照组[76]。omega-3 PUFAs治疗精神分裂症的第一个试验发现EPA(2 g/d)有临床改善,但DHA[113]没有,而随后的试验也显示EPA[114,115]有益处,但并不是所有的研究都看到了这种现象[116]。另一项研究报告了对精神分裂症患者服用 26 周 omega-3 多不饱和脂肪酸的显著益处 [117]。尽管有这些发现,但 Cochrane 的一项综述得出结论,omega-3 多不饱和脂肪酸应仅被视为精神分裂症的实验性治疗方法 [118]。一项研究报告了每天 1 g EPA 对边缘型人格障碍的显著益处 [119],而少数研究报告了 DHA 的抗攻击作用 [120,121]。
4.3.EPA 和 DHA 与认知衰退
一项观察性研究的荟萃分析显示,膳食摄入量或血浆 DHA 水平与成人记忆力呈正相关 [122]。通过观察性研究的荟萃分析确定了 DHA 摄入量与痴呆和阿尔茨海默病风险之间的负相关 [123]。验尸研究报告称,阿尔茨海默病患者的大脑中 DHA 含量低于非阿尔茨海默病患者 [124,-,126],一些研究还将血液中低水平的 omega-3 多不饱和脂肪酸与痴呆症联系起来 [127-129]。在弗雷明汉心脏研究 [130] 的一个亚组中,较高的血浆磷脂酰胆碱 DHA 与患全因痴呆的风险降低 47% 和患阿尔茨海默病的风险降低 39% 相关。
辛恩等人[131]报告说,EPA + DHA(1.8 g/d,持续 6 个月)减轻了患有轻度认知障碍的成年人的抑郁症状并改善了认知能力。然而,与安慰剂相比,每天补充 1.7 g DHA 和 0.6 g EPA 持续 6 个月不会影响正在接受乙酰胆碱酯酶抑制剂治疗的阿尔茨海默病患者的简易精神状态检查评分 [132]。尽管如此,omega-3 PUFA 对通过阿尔茨海默病评估评分以及子项目衡量的认知功能有显著影响,并且发现与血浆 omega-3 PUFA 的增加存在相关性 [133]。这表明 omega-3 多不饱和脂肪酸的作用取决于评估的认知健康的具体方面。此外,亚组分析表明,omega-3 多不饱和脂肪酸对基线认知下降非常轻微的组有益 [132]。一项对持续时间为 3-40 个月并每天使用 0.14 - 1.8 g EPA + DHA 的六项 RCT 的荟萃分析发现,接受 omega-3 脂肪酸的人认知能力下降的速度较慢 [134],而系统评价得出的结论是EPA 和 DHA 补充剂对阿尔茨海默病患者的最有益效果可以预期在疾病的早期阶段 [135]。这些发现都表明,轻度认知能力下降的个体将是 omega-3 多不饱和脂肪酸的良好目标群体。然而,在任何认知能力下降之前开始使用 omega-3 多不饱和脂肪酸进行干预可能更有益 [136]。在这种情况下,已经表明,健康老年人补充 omega-3 PUFA 对白质微观结构完整性、特定大脑区域的灰质体积和血管参数具有有益影响,并伴随着执行功能的改善 [137]。这表明,omega-3 多不饱和脂肪酸的预防性用途可能有可能用于维持老年人的认知健康。
4.4.EPA 和 DHA 与炎症
EPA和DHA二者具有一定范围的抗炎作用[11,138,139,140]。主要是,EPA 和 DHA 会减少 AA 衍生的类二十烷酸的产生。它们部分通过与 AA 竞争掺入细胞膜磷脂(即,EPA 和 DHA 导致细胞膜中 AA 的含量较低),部分通过减少 AA 从膜中的释放,部分通过抑制酶 COX 的作用来做到这一点-2 和 5-LOX 对 AA,部分是通过与 AA 竞争 COX 和 LOX 酶的代谢 [138]。干预研究表明,增加 EPA + DHA 的摄入量会导致参与炎症的细胞膜中 EPA 和 DHA 的浓度增加(很可能在许多其他细胞类型中)[138]。以及与 AA 衍生的类二十烷酸产量减少有关,这种 omega-3 PUFA 含量的增加与其他炎症标志物水平的降低有关,包括各种细胞因子和趋化因子、急性期蛋白和粘附分子 [11,138,139,140,141]。例如,许多人类的研究表明EPA和DHA状态之间负相关(例如,ω-3指数,这是EPA加DHA在红细胞的总和)和炎症的血液标志物如C反应性蛋白[142-144],细胞因子如IL-6 [142-144]和粘附分子,例如可溶性细胞间粘附分子1 [143]。此外,在C-反应蛋白浓度EPA和DHA减少确认的随机对照试验的元分析[145,146]和几种细胞因子[147]。
据报道,EPA 和 DHA 的抗炎作用通常涉及激活 B 细胞 (NFκB) 的促炎转录因子核因子 kappa-轻链增强子的激活减少,以响应炎症刺激,这是抑制作用的结果的NFκB,IκB的抑制亚基的磷酸化[148,149]。一些研究将这种效应与 EPA 和 DHA 的膜介导作用联系起来,后者抑制炎症信号的早期阶段 [150]。这些作用需要将 EPA 和 DHA 结合到细胞膜磷脂中。然而,EPA 和 DHA 似乎也可以通过膜受体直接作用于炎症细胞以减少炎症反应。GPR120 是一种质膜 G 蛋白偶联受体(也称为游离脂肪酸受体 4),能够结合长链脂肪酸,尤其是 DHA [151]。GPR120 在脂肪细胞和炎症细胞(如巨噬细胞)上高表达 [151]。GPR120 的 DHA 激活被证明可以减少巨噬细胞中 NFKB 的激活并减少炎性细胞因子的产生 [151]。通过 GPR120 介导的 omega-3 PUFA 作用的最新更新可以在别处找到 [152-,155]。这种作用机制意味着 EPA 和 DHA 可以发挥抗炎作用,不需要将它们掺入细胞膜中,也不涉及脂质介质产生的修饰。
EPA 和 DHA 也被认为是合成新型特化促分解介质 (SPM) 的前体。SPM 包括分解素、保护素和 maresins [53,156,157,158]。Resolvins 由 EPA(E 系列)和 DHA(D 系列)合成,而 maresins 和protectins 由DHA 合成(图5)。这些途径使用参与类二十烷酸合成途径的酶(图 5)。
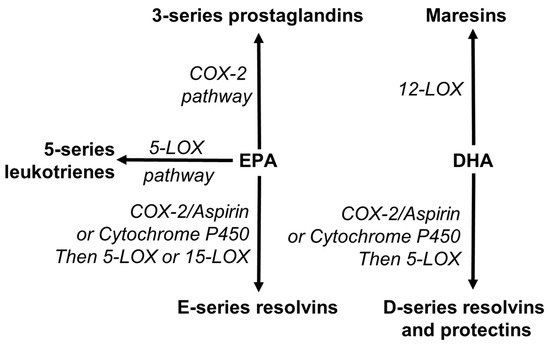
图 5. 二十碳五烯酸 (EPA) 和二十二碳六烯酸 (DHA) 向脂质介质的转化概述,包括专门的促分解介质(分解素、保护素、maresins)。COX,环氧合酶;LOX,脂肪氧化酶。
顾名思义,SPM 激活炎症的消退。因此,缺乏 omega-3 多不饱和脂肪酸,尤其是 EPA 和 DHA,可能不利于炎症的消退,事实上,可能会促进涉及炎症的各种疾病的发病机制。据报道,增加 EPA 和 DHA 的摄入量会导致人体血液和组织中某些 SPM 的浓度升高[159]。
由于它们具有多种相互作用的抗炎和消炎作用,增加 EPA 和 DHA 的摄入量可能对涉及炎症的疾病具有治疗潜力。这在类风湿性关节炎的 RCT 中得到了很好的探讨,其中高剂量的这些 omega-3 多不饱和脂肪酸会产生多种临床益处 [160,161,162]。对类风湿性关节炎患者使用 EPA 和 DHA 的系统评价证实疼痛减轻 [163,164]。一项观察性研究报告称,血液中 EPA 水平越高,抗肿瘤坏死因子抗体对类风湿性关节炎患者的治疗效果越好 [165]。EPA和DH
相关知识
烘焙亚麻籽——ω
有机奶中Ω
中国居民摄入ω
怎样减肥才最健康。我想快点瘦下来= ̄ω ̄=
如图所示,匝数为100匝的矩形线圈abcd处于磁感应强度B=T的水平匀强磁场中,线圈面积S=0.5m2,内阻不计.线圈绕垂直于磁场的轴以角速度ω=“10π”rad/s匀速转动。线圈通过金属滑环与理
女性平衡饮食必需脂肪酸 不仅保健康还能美容
人体健康和生命的必需脂肪酸
人体健康与脂肪酸密切相关
科学补充脂肪酸对人体健康至为关键
如何摄入优质脂肪
网址: ω https://m.trfsz.com/newsview343021.html