一种益生菌与茶多酚复配的组合物、制剂及其应用的制作方法
1.本发明涉及医药生物制剂或口腔保健品技术领域,具体而言,涉及一种益生菌与茶多酚复配的组合物、制剂及其应用。
背景技术:
2.口腔疾病的发生与口腔致病菌的粘附定殖以及生物膜的形成密切关联。尤其是致病菌形成的生物膜,对外界环境有很强的适应性。口腔致病菌不仅能够引起口腔微生态失衡,从而诱发口腔疾病,也是阿尔茨海默症、肺炎、肿瘤和糖尿病等疾病诱发因素之一。伴放线放线杆菌是一种具有高致病潜力的革兰氏阴性口腔致病细菌,易在口腔中滋生定殖形成结构复杂的牙菌斑生物膜,引发牙周病。另外,伴放线放线杆菌能够分泌合成多种高毒力因子,引起牙周炎的发生和发展,进而造成牙龈出血,牙齿松动、口臭等症状。有研究报道,伴放线放线杆菌与胃癌、白血症等病症也有一定相关性。
3.近年来,运用益生菌预防和治疗口腔疾病受到越来越多的关注。相比于传统的机械疗法及药物疗法,益生菌能够起到调节口腔微生态平衡、抑制生物膜以及破坏致病菌毒力等作用。益生菌改善口腔健康主要是通过与口腔致病菌竞争结合位点,阻碍致病菌的定殖,从而使致病菌从口腔中排出。益生菌产生的代谢物质,如有机酸、细菌素等,能够有效抑制致病菌的生长以及生物膜的形成。有研究表明将益生菌进行灭活处理后仍可对机体发挥相应的功效,且效果优于活菌。副干酪乳杆菌是口腔微生物群中最常见的乳杆菌,其灭活菌粉能与口腔致病菌产生凝聚沉淀。有研究同时表明益生菌与致病菌共凝聚能力与益生菌的疏水性有很大关系,可能是因为菌体表层蛋白影响了菌体表面性质。然而,益生菌灭活菌粉对口腔致病菌的共凝聚机理目前尚不清楚。
4.茶多酚作为绿色无污染的天然抑菌剂在食品中应用广泛。茶多酚能够抑制口腔致病菌生物膜的形成,通过破坏细菌膜和细菌壁、抑制核酸合成等方式杀死致病菌,而且能够抑制致病菌产生有害代谢产物及促炎相关基因表达。现有研究表明茶多酚对口腔致病菌有抑制作用,目前已经广泛用于牙膏产品中。
5.目前研究表明,虽然益生菌与茶多酚均是目前市场上防治口腔疾病的常用活性成分,然而,将茶多酚与益生菌复配使用对抑制口腔致病菌的协同抑菌机理研究目前未见报道。由于口腔疾病的发展具有长期性、缓慢性的特点,目前市场上对于口腔疾病的预防或治疗尚未开发出十分安全、有效的药品或口腔保健品。与此同时,市场上用于防治口腔疾病的药品或口腔保健品普遍存在抑菌效果不佳、抑菌机理不明确的问题。因此,针对上述缺陷,亟需开发一种抑菌效果更好、机理明确的预防和/或治疗口腔疾病的药品或口腔保健品,这对口腔疾病的防治具有重要意义。
技术实现要素:
6.本发明的主要目的在于提供了一种益生菌与茶多酚复配的组合物、制剂及其应用,以解决现有技术中的常见的防治口腔疾病的药品或口腔保健品存在抑菌效果不佳、抑
菌机理不明确的问题。
7.为了实现上述目的,本发明的目的之一是提供一种益生菌与茶多酚复配的组合物,该组合物包括:益生菌、茶多酚。
8.进一步地,该组合物由下列重量份的原料组成:益生菌1~100份、茶多酚1~100份。
9.进一步地,该组合物由下列重量份的原料组成:益生菌1~50份、茶多酚1~50份。
10.进一步地,该组合物由下列重量份的原料组成:益生菌1~10份、茶多酚1~10份。
11.进一步地,该组合物由下列重量份的原料组成:益生菌4~8份、茶多酚1~6份。
12.进一步地,该组合物由下列重量份的原料组成:益生菌8份、茶多酚1份;或,所述组合物按下列重量份的原料组成:益生菌4份、茶多酚1份;或,所述组合物按下列重量份的原料组成:益生菌2份、茶多酚1份;或,所述组合物按下列重量份的原料组成:益生菌4份、茶多酚3份。
13.进一步地,所述益生菌与茶多酚复配的组合物中,所述益生菌为酵母菌、益生芽孢菌、丁酸梭菌、乳杆菌、双歧杆菌或放线菌中的一种或几种。
14.进一步地,所述益生菌与茶多酚复配的组合物中,所述益生菌为乳杆菌。
15.进一步地,所述益生菌与茶多酚复配的组合物中,所述益生菌为副干酪乳杆菌。
16.进一步地,所述益生菌与茶多酚复配的组合物中,所述益生菌的浓度为0.001g/ml~0.05g/ml。
17.进一步地,所述益生菌与茶多酚复配的组合物中,所述益生菌的浓度为0.01g/ml~0.03g/ml。
18.进一步地,所述益生菌与茶多酚复配的组合物中,所述益生菌的浓度为0.01g/ml。
19.进一步地,所述益生菌与茶多酚复配的组合物中,所述茶多酚的浓度为0.001g/ml~0.05g/ml。
20.进一步地,所述益生菌与茶多酚复配的组合物中,所述茶多酚的浓度为0.001g/ml~0.01g/ml。
21.进一步地,所述益生菌与茶多酚复配的组合物中,所述茶多酚的浓度为0.0025g/ml。
22.进一步地,所述益生菌与茶多酚复配的组合物中,益生菌与茶多酚的重量比为1:1~8:1,优选地,所述益生菌与茶多酚的重量比为4:3~8:1,优选地,益生菌与茶多酚的重量比为8:1。
23.根据本发明的另一方面,提供了一种益生菌与茶多酚复配的制剂,该制剂是制备牙膏、漱口水、消毒液、口腔喷雾或含片。
24.进一步地,所述益生菌与茶多酚复配的制剂中,所述制剂为牙膏。
25.根据本发明的另一方面,提供了一种益生菌与茶多酚复配的口腔保健品,所述口腔保健品是制备牙膏、漱口水、消毒液、口腔喷雾或含片。
26.进一步地,所述益生菌与茶多酚复配的口腔保健品中,所述口腔保健品为牙膏。
27.根据本发明的另一方面,提供了一种上述组合物在制备用于预防和/或治疗口腔疾病的制剂或口腔保健品中的用途。
28.进一步地,所述口腔疾病为牙周炎、龋齿、牙石、牙菌斑、牙龈出血、牙齿松动、牙本
质敏感、牙齿不洁白或口臭中的一种或几种。
29.根据本发明的另一方面,提供了一种益生菌与茶多酚复配的组合物在制备抑菌的制剂或口腔保健品中的应用。
30.进一步地,所述抑菌为抑制伴放线放线杆菌、变异链球菌和具核梭杆菌中的一种或多种。
31.进一步地,所述抑菌是通过共凝聚和/或杀菌作用。
32.本发明建立了可量化的益生菌和茶多酚复配模型,确定了其对口腔致病菌的抑菌机理及其在牙膏中的功效作用。通过实验确立益生菌与茶多酚的最佳配比,运用扫描电镜(sem)、原子力显微镜(afm)、傅里叶红外光谱(ft-ir)、表面电荷分析等多种材料学和生物化学分析手段进行生物膜抑制量等特性指标测定、菌体形态观察、细菌表面成分及粗糙度分析,探究益生菌和茶多酚对伴放线放线杆菌的协同抑菌机理。实验结果表明,益生菌与茶多酚的最佳配比为2:1,对致病菌生物膜的抑制率提高至71.7%,复配模型通过共凝聚和杀菌双重作用抑制伴放线放线杆菌的生长。比对益生菌、茶多酚单独添加以及益生菌和茶多酚复配抑菌模型在牙膏中对三种常见致病菌(伴放线放线杆菌、变异链球菌和具核梭杆菌)的抑菌作用结果的差异性,为益生菌干粉复配茶多酚抑菌模型在牙膏等口腔清洁护理用品中的应用,提供充分的理论依据与运用技术的支撑。综上,本发明阐明了益生菌与茶多酚的协同抑菌机理,验证了益生菌和茶多酚复配抑菌模型在牙膏中的抑菌作用。
33.与现有技术相比,本发明组合物有益的技术效果如下:
34.1、本发明代表性选用的副干酪乳杆菌能够与伴放线放线杆菌产生共凝聚作用,减少致病菌在口腔中的定殖。当与茶多酚协同作用时,不仅能够与致病菌产生共凝聚作用,还能够起到杀灭致病菌的作用。同时建立益生菌与茶多酚协同抑菌模型,大大提升了对致病菌生物膜形成的抑制作用。
35.2、研究益生菌与茶多酚对伴放线放线杆菌的抑菌机理。本发明通过运用多种材料学和生物化学手段,可量化地观测益生菌和致病菌的表面形态、化学组分和表面粗糙度,多维度分究并阐明了益生菌与茶多酚对伴放线放线杆菌的抑菌机理。
36.3、将研究建立的益生菌与茶多酚复配抑菌模型运用在牙膏中,同时与单独添加益生菌或茶多酚的牙膏比对,益生菌与茶多酚复配抑菌模型对口腔常见的三株致病菌(伴放线放线杆菌、变异链球菌和具核梭杆菌)的抑菌作用增强。由此可见,益生菌协同茶多酚具有显著的口腔益生特性,在口腔清洁护理用品方面有广大应用前景。
附图说明
37.为了更清楚地说明本发明实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍。
38.图1为益生菌作用后伴放线放线杆菌的降低量(不同的小写字母表示数据之间具有显著差异性,p《0.05)。
39.图2为不同益生菌添加量下伴放线放线杆菌降低量(不同的小写字母表示数据之间具有显著差异性,p《0.05)。
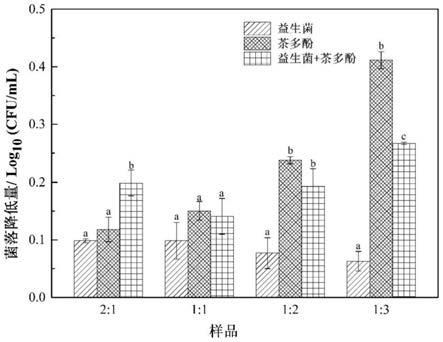
40.图3为益生菌与茶多酚不同配比处理后伴放线放线杆菌的降低量(不同的小写字母表示数据之间具有显著差异性,p《0.05)。
41.图4为不同处理下伴放线放线杆菌生物膜抑制率(不同的小写字母表示数据之间具有显著差异性,p《0.05)。
42.图5为扫描电镜图(a,伴放线放线杆菌;b,益生菌;c,益生菌+伴放线放线杆菌;d,茶多酚+伴放线放线杆菌;e,益生菌:茶多酚(2:1)+伴放线放线杆菌)。
43.图6为不同菌体的傅里叶近红外光谱图(a,益生菌;b,致病菌;c,益生菌和致病菌共凝聚;d,茶多酚和致病菌共凝聚)
44.图7为菌体的2d原子力显微镜光学图片(a,致病菌;b,益生菌)和3d粗糙度轮廓图(c,致病菌;d,益生菌)。
45.图8为益生菌和茶多酚的协同抑菌机理示意图。
具体实施方式
46.下面将结合本技术实施例,对本技术实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例是本技术一部分实施例,而不是全部的实施例。基于本技术中的实施例,本领域技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本技术保护的范围。
47.需要说明的是,在不冲突的情况下,本技术中的实施例及实施例中的特征可以相互组合。下面将结合实施例来详细说明本发明。
48.以下结合具体实施例对本发明作进一步详细描述,这些实施例不能理解为限制本技术所要求保护的范围。
49.试剂与仪器:
50.选用现牙膏中常用的两款益生菌:副干酪乳杆菌干粉、复合益生菌干粉;血平板和0.5%结晶紫染色液购于常德比克曼生物科技有限公司,2.5l厌氧罐c-31、二氧化碳产气袋c-3和厌氧产气袋购于上海创凌生物科技有限公司;baclight
tm
细菌活性检测试剂盒7012购于陕西捷科达科技有限公司;磷酸盐缓冲液(ph7.2-7.4)、2.5%戊二醛固定液(分析纯)、氯化钠(分析纯)、茶多酚(95%)购于国药集团化学试剂有限公司,牙膏样品由苏州市金茂日化学品有限公司提供。
51.菌液制备:本试验中选用的伴放线放线杆菌atcc 29523购自广东省科学院微生物研究所,使用血平板培养基(tsa+5%脱纤维蛋白羊血)进行培养,在37℃、5%co2环境下培养48h,用磷酸缓冲盐液(pbs,ph 7.2-7.4)调节菌体浓度至1
×
109cfu/ml备用。
52.主要仪器设备如表1所示:
53.表1主要仪器
[0054][0055]
数据分析:试验中,使用spss 18.0软件以5%的显著性水平对数据进行统计分析,试验数据表达形式为平均值
±
标准偏差,所有试验均设置3个重复试验。
[0056]
实施例1确定益生菌最佳有效添加量
[0057]
通过测定两种益生菌干粉产品的抑菌性能,以选取抑菌效果胜出的益生菌。采用lv等(xin,lv.,pan,hu.,ying dang.,etc.purification and partial characterization of a novel bacteriocin produced by lactobacillus casei tn-2isolated from fermented camel milk(shubat)of xinjiang uygur autonomous region,china[j].food control,2014,43(5):276-283.)所用的牛津杯双层平板法,首先配置浓度为0.02g/ml的副干酪乳杆菌和复合益生菌菌液。配置含100μl伴放线放线杆菌菌液(浓度约为1
×
109cfu/ml)的血平板(tsa+5%脱纤维蛋白羊血),吸取100μl制备好的益生菌菌液加入牛津杯孔中,培养皿于37℃培养48h后测量抑菌圈直径。
[0058]
同时,通过共凝聚试验方法进一步测定益生菌对伴放线放线杆菌的作用效果。在arellano-ayala(k,arellano-ayala.,f,j,ascencio-valle.,p,gutierrez-gonzalez.,etc.hydrophobic and adhesive patterns of lactic acid bacteria and their antagonism against foodborne pathogens on tomato surface(solanum lycopersicum l.)[j].journal of applied microbiology,2020,129:876-891.)和fadare(o,s,fadare.,v,singh.,o,i.,enabulele.,etc.in vitro evaluation of the synbiotic effect of probiotic lactobacillus strains and garlic extract against salmonella species.lwt-food science and technology,2022,153,112439)等所用的方法基础上进行方法优化:将副干酪乳杆菌益生菌干粉和复合益生菌干粉配置成浓度为0.02g/ml的菌液,分别与制备好的伴放线放线杆菌菌悬液按照1:1体积混合,静置0.5h和1h后轻轻吸取100μl上清液,用十倍稀释法稀释,吸取100μl不同比例的稀释液涂布,37℃下培养48h后计数。最后,通过比较抑菌圈直径以及伴放线放线杆菌降低量,选出作用效果较好的益生菌进行下一步试验,试验重复三次。
[0059]
结果显示:相同浓度下,副干酪乳杆菌与复合益生菌对伴放线放线杆菌的抑制作用没有显著差异(表2),但是抑菌效果均明显小于茶多酚(p《0.05)。如图1所示,将浓度均为0.02g/ml的副干酪乳杆菌和复合益生菌与伴放线放线杆菌菌悬液等比例混合放置0.5h后,
伴放线放线杆菌的降低量没有显著差异(p》0.05)。放置1h后,经副干酪乳杆菌处理后的伴放线放线杆菌降低量为0.22
±
0.02log
10
cfu/ml,显著高于复合益生菌作用后伴放线放线杆菌的降低量(0.17
±
0.02log
10
cfu/ml),据此,选用副干酪乳杆菌进行下一步研究。
[0060]
表2 不同物质对伴放线放线杆菌的抑制作用
[0061][0062][0063]
注:平均值
±
标准偏差是三次重复试验的结果,每列不同的小写字母(a,b)表示数据之间具有显著差异性(p《0.05)。
[0064]
将筛选出的益生菌干粉按照0.3%、0.5%、0.7%、1%、1.5%、2%、2.5%、3%和4%(m/v)的添加量用pbs缓冲液配置成不同浓度的益生菌溶液。按照上述方法操作,通过比较静置1h后伴放线放线杆菌的菌落降低量选出合适的益生菌添加量,试验重复三次。
[0065]
结果表明:将不同浓度的副干酪乳杆菌与伴放线放线杆菌混合作用1h后,当益生菌添加量小于1.0%(0.01g/ml)时,伴放线放线杆菌的降低量没有显著差异(p》0.05),随着益生菌浓度增高,伴放线放线杆菌的降低量增加(图2)。然而,当益生菌添加量大于3.0%(0.03g/ml)时,伴放线放线杆菌的降低量逐渐减少。因此,副干酪乳杆菌最适的添加量范围为1.0%~3.0%。
[0066]
实施例2建立益生菌和茶多酚最佳抑菌模型
[0067]
测定茶多酚对伴放线放线杆菌的最小抑菌浓度(mic),配置浓度为0.02g/ml的茶多酚溶液,按照二倍稀释法稀释(l,zhang.,l,wang.,l,h,yi.,etc.a novel antimicrobial substance produced by lactobacillus rhamnous ls8[j].food control,2017,73:754-760.),与伴放线放线杆菌的菌悬液按照1:1的比例混合,置于96孔板中于37℃培养48h,以肉眼观察无细菌生长为最小抑菌浓度。结果表明:茶多酚的最小抑菌浓度(mic)为2.5mg/ml。
[0068]
另外,按照副干酪乳杆菌的添加量为1%配置益生菌溶液,配置最小抑菌浓度的茶多酚溶液,与益生菌溶液按2:1、1:1、1:2、1:3的体积比例混合,即益生菌与茶多酚的重量比为8:1、4:1、2:1、4:3,之后与伴放线放线杆菌的菌悬液按照1:1的体积比例混合,静置1h,轻轻吸取上清进行计数,阳性对照为添加等量的益生菌或茶多酚,阴性对照为添加等量的pbs缓冲液。通过比较伴放线放线杆菌的降低量确定益生菌与茶多酚的最佳比例,试验重复三次。
[0069]
结果表明:当益生菌(0.01g/ml)和最小抑菌浓度的茶多酚体积比例为2:1时,即重量比为8:1时,茶多酚和益生菌协同作用下伴放线放线杆菌的降低量显著高于单独的益生菌或茶多酚(图3)。另外,随着茶多酚量的增加,茶多酚作用后伴放线放线杆菌的降低量显著增加,这是因为茶多酚具有杀菌作用(y,li.,x,g,jiang.,j,q,hao.,etc.tea polyphenols:application in the control of oral microorganism infectious diseases.archives of oral biology,2019,102:74-82.),随着茶多酚浓度增加,茶多酚和益生菌复配以后的抑菌效果低于单独的茶多酚。这和上述益生菌和茶多酚的抑菌试验结
果一致,进一步表明益生菌的抑菌作用主要依靠共凝聚作用,而茶多酚依靠杀菌作用抑制伴放线放线杆菌的生长。因此,益生菌和茶多酚最佳抑菌模型为益生菌(0.01g/ml)和茶多酚比例为2:1。
[0070]
实施例3益生菌和茶多酚复配抑菌模型的抑菌机理研究-对伴放线放线杆菌生物膜量分析测定
[0071]
参照秦苏佳(秦苏佳,徐晚晴,张秋香,等.植物乳杆菌ccfm8724对致龋双菌生物膜的抑制作用[j].食品与发酵工业,2020,46(13):127~132.)和phumat等(p,phumat.,s,khongkhunthian.,p,wanachantararak.,etc.comparative inhibitory effects of 4-allylpyrocatechol isolated from piper betle on streptococcus intermedius,streptococcus mutans,and candida albicans.archives of oral biology,2020,113,104690.)采用的方法,对伴放线放线杆菌生物膜量作分析测定。用tsb液体培养基配置最佳配比的益生菌和茶多酚溶液,将配置的益生菌、茶多酚以及益生菌和茶多酚最佳复配模型溶液吸取100μl置于96孔板中,与100μl的伴放线放线杆菌菌悬液等比例混合。阴性对照为tsb培养基与伴放线放线杆菌菌悬液按照等比例混合,37℃下培养48h。之后吸取出培养液,用pbs清洗两遍,加入50μl浓度为0.5%的结晶紫避光染色15min,洗涤晾干后用200μl 95%乙醇溶解结晶紫,用酶标仪在od
595nm
下测吸光度,试验重复三次。生物膜抑制率计算公式为:
[0072][0073]
牙菌斑生物膜是引起牙周炎的初始因素,抑制致病菌生物膜的形成能够有效治疗牙周病(w,j,kim.,y,soh.,s,m,heo.recent advances of therapeutic targets for the treatment of periodontal disease.biomolecules&therapeutics,2021,29:263-267.)。通过生物膜形成量的测定,可知益生菌和茶多酚均能有效抑制致病菌生物膜的形成,抑制率分别达到62.3%和61.4%(图4)。益生菌和茶多酚最佳配比抑菌模型对伴放线放线杆菌生物膜量的抑制率上升为71.7%,显然高于单独益生菌或茶多酚的抑制率(图4)。
[0074]
实施例4益生菌和茶多酚复配抑菌模型的抑菌机理研究-扫描电镜形貌分析
[0075]
利用扫描电镜观察用益生菌和茶多酚处理后伴放线放线杆菌细胞表面形态。参考song等(y,y,song.,l,h,zhang.,l,m,dong.,etc.ph-responsive smart wettability surface with dual bactericidal and releasing properties.acs applied materials&interfaces,2021,13:46065-46075.)描述的方法,将益生菌和茶多酚最佳配比抑菌模型与伴放线放线杆菌菌悬液等比例混合,静置1h后弃去上清。阳性对照为添加等量益生菌或茶多酚,阴性对照为添加等量的pbs缓冲液。处理组和对照组的菌体沉淀用2.5%戊二醛4℃过夜固定,接着用pbs(0.1mol/l,ph 7.2)清洗两次,然后用30%、50%、70%、80%、90%和100%的乙醇脱水,最后干燥喷金并进行形态观察。
[0076]
如图5a所示,单独的伴放线放线杆菌菌体比较完整,表面较为平整。大部分益生菌菌体完整,少部分菌体有轻微凹陷(5b),分析是因为益生菌制备成干粉时,对菌体有部分损伤。然而,单独的益生菌和伴放线放线杆菌菌落分散或者单纯叠加一起,没有共凝聚现象。经过益生菌处理以后,益生菌和致病菌菌体粘连一起,表明益生菌与致病菌菌体之间产生共凝聚现象(图5c)。而茶多酚处理以后,菌体表面变得凹凸不平,有部分菌体破裂,细胞内物质流出(图5d),说明茶多酚对致病菌具有杀菌作用,破坏了细菌细胞完整性(y,han.,j,
ch
2-基团都具有较低的表面能,这在疏水性聚合物中非常丰富。伴放线放线杆菌表面也同时具有-ch
2-和-ch3官能团。因此具有相似低表面能基团的益生菌和伴放线放线杆菌会发生共凝聚,二者共凝聚后未测出-ch
2-和-ch3基团,说明含有低表面能基团的位点由于物质共凝聚被遮挡,红外光谱只能检测表面官能团,难以准确测定物质内部基团。而茶多酚和伴放线放线杆菌共凝聚后依然能检测出-ch
2-和-ch3基团,说明二者共凝聚不是由于低表面能官能团,而是静电吸附作用。
[0086]
实施例7益生菌和茶多酚复配抑菌模型的抑菌机理研究-细菌表面粗糙度测定
[0087]
细菌表面粗糙度与细菌粘附力大小有关。除了表面成分,本研究也从表面结构上分析了共凝聚机理。配置浓度为0.02g/ml益生菌溶液,参考sandin(j,n,sandin.,s,p,aryal.,t,wilkop.,etc.near simultaneous laser scanning confocal and atomic force microscopy(conpokal)on live cells.jove journal of visualized experiments,2020,162,e61433.)等和韦蕾(韦蕾.原子力显微镜研究对硝酸银和纳米银对细菌的抑菌机理[d].广西大学,2019.)所用的方法测定细菌表面粗糙度。具体方法为:将益生菌溶液与伴放线放线杆菌(109cfu/ml)菌液分别用2.5%戊二醛固定30min,随后取5μl滴在云母片上,自然晾干后用原子力显微镜测定两株细菌表面粗糙度。
[0088]
图7a和c是致病菌的2d原子力显微镜光学图片和3d粗糙度轮廓图。致病菌表面的平均面粗糙度ra=11.5nm。图7b和d是益生菌的2d原子力显微镜光学图片和3d粗糙度轮廓图。益生菌表面的平均面粗糙度ra=19.5nm。益生菌比伴放线放线杆菌菌体表面粗糙,结果表明益生菌粘附作用更强,在口腔内能与致病菌竞争粘附位点,减少致病菌的粘附。
[0089]
因此综合上述分析,益生菌和茶多酚的协同抑菌机理如图8所示,共有的疏水基团导致益生菌和致病菌发生共凝聚,将致病菌从口腔内带走,同时天然抑菌物质茶多酚也能够辅助杀死致病菌,与益生菌起到协同抑菌的增强叠加效应。
[0090]
实施例8评价益生菌与茶多酚复配抑菌模型在牙膏中抑菌作用
[0091]
8.1试验方法
[0092]
为了评价益生菌与茶多酚在牙膏中对致病菌的抑菌效果,将益生菌与茶多酚按照最佳配比加入牙膏中。除了伴放线放线杆菌atcc 29523,同时选取变异链球菌cgmcc 12499和具核梭杆菌atcc 25586,两株菌均由江苏大学食品学院提供,将两株菌接种于血平板上,置入含有80%n2、10%h2、10%co2的厌氧袋中37℃培养48h,调节菌体浓度为109cfu/ml。采用高鹰等(高鹰,宁科功,蔡英,等.副干酪乳杆菌对口腔致病菌选择性抑制作用[j].口腔护理用品工业,2016,26(5):26~28.)的方法稀释牙膏样品,具体方法为:称取0.5g牙膏溶于1ml pbs(ph 7.2-7.4)溶液中,充分振荡溶解,去除溶液中气泡。之后分别与三株致病菌菌悬液按照1:1比例混合,静置培养1h后轻轻吸取上清进行涂布计数,阳性对照为添加等量的益生菌或茶多酚牙膏,阴性对照为未添加益生菌和茶多酚的牙膏。通过比较致病菌降低量来评价益生菌与茶多酚在牙膏中的抑菌功效,试验重复三次。
[0093]
8.2试验结果
[0094]
表4为益生菌、茶多酚单独添加以及益生菌和茶多酚共同添加在牙膏中对口腔常见三种致病菌的作用结果。添加益生菌和茶多酚后,牙膏对致病菌的抑制作用增强(表4)。同时验证,将益生菌与茶多酚复配抑菌模型运用在牙膏中,与单独添加益生菌或茶多酚的牙膏相比,能够进一步提升致病菌的降低量。从而能更有效地发挥抑制口腔常见的牙周炎
等致病菌的功效作用。
[0095]
表4 不同物质在牙膏中对伴放线放线杆菌的抑制作用
[0096][0097]
注:平均值
±
标准偏差是三次重复试验的结果,每列不同的小写字母(a,b)表示数据之间具有显著差异性(p《0.05)。
[0098]
本发明建立了可量化的益生菌和茶多酚复配模型,确定了其对口腔致病菌的抑菌机理及其在牙膏中的功效作用。通过实验确立益生菌与茶多酚的最佳配比,运用扫描电镜(sem)、原子力显微镜(afm)、傅里叶红外光谱(ft-ir)、表面电荷分析等多种材料学和生物化学分析手段进行生物膜抑制量等特性指标测定、菌体形态观察、细菌表面成分及粗糙度分析,探究益生菌和茶多酚对伴放线放线杆菌的协同抑菌机理。实验结果表明,益生菌与茶多酚的最佳配比为2:1,对致病菌生物膜的抑制率提高至71.7%,复配模型通过共凝聚和杀菌双重作用抑制伴放线放线杆菌的生长。比对益生菌、茶多酚单独添加以及益生菌和茶多酚复配抑菌模型在牙膏中对三种常见致病菌(伴放线放线杆菌、变异链球菌和具核梭杆菌)的抑菌作用结果的差异性,为益生菌干粉复配茶多酚抑菌模型在牙膏等口腔清洁护理用品中的应用,提供充分的理论依据与运用技术的支撑。综上,本发明阐明了益生菌与茶多酚的协同抑菌机理,验证了益生菌和茶多酚复配抑菌模型在牙膏中的抑菌作用。
[0099]
以上对本技术实施例进行了详细介绍,本文中应用了具体个例对本技术的原理及实施方式进行了阐述,以上实施例的说明仅用于帮助理解本技术的方法及其核心思想。同时,本领域技术人员依据本技术的思想,基于本技术的具体实施方式及应用范围上做出的改变或变形之处,都属于本技术保护的范围。综上所述,本说明书内容不应理解为对本技术的限制。
相关知识
一种含有青梅的抗氧化保健食品组合物及其制备方法
茶多酚的作用与禁忌
一种生产母乳脂质替代品酿酒酵母菌株及其应用的制作方法
益生菌与肠道健康的主要作用机制及益生菌在消化道疾病的应用
一种罗布麻保健茶及其制备方法与流程
一种油茶面及其制作方法
从作用机制到临床应用,一文详解益生菌与益生元
茶多酚的十大功效与应用:从预防到治疗,全方位解析茶多酚对人体的重要作用
绿色植物益源保健茶技术配方及工艺的制作方法
茶多酚——人体生命保鲜剂
网址: 一种益生菌与茶多酚复配的组合物、制剂及其应用的制作方法 https://m.trfsz.com/newsview548322.html