人体肠道细菌的代谢过程促进Th17细胞活化和肠炎发展
人体肠道细菌的代谢过程促进Th17细胞活化和肠炎发展 | Cell Press青促会述评 原创 Cell Press CellPress细胞科学 收录于话题#Cell Press青促会述评 82 个内容 #Cell Host & Microbe 6 个内容

生命科学
Life science
作为世界领先的全科学领域学术出版社,细胞出版社特与“中国科学院青年创新促进会”合作开设“青促会述评”专栏,以期增进学术互动,促进国际交流。
2021年第四十三期(总第80期)专栏文章,由中科院微生物所研究员 中国科学院青促会会员 王硕,就 Cell Host & Microbe 中的论文发表述评。

肠道微生物的组成与宿主免疫系统的功能密切相关,肠道微生物的个体间差异也被认为是影响免疫相关疾病发展的重要因素。然而,人体肠道细菌中参与疾病调节的关键的分子和它们的作用机制尚不清楚。另一方面,饮食摄入和疾病的发展也会调控肠道菌群。饮食、肠道菌群和免疫应答间的互作机制及其与疾病的关系也有待进一步阐明。
近日,来自美国加州大学旧金山分校的Peter J. Turnbaugh研究团队发现人类肠道放线菌Eggerthella lenta可以通过激活Rorc和Th17相关基因的表达,从而促进肠道炎症。E. lenta在IBD等病人的粪便中明显富集,E. lenta表达的强心苷还原酶Cgr2能够代谢甾苷类物质,促进Th17细胞活化。精氨酸能够抑制Cgr2的活性,利用Cgr2对膳食精氨酸的敏感性可以缓解E. lenta诱导的肠道炎症。这一研究揭示了菌株特异性的微生物代谢对自身免疫调节的影响以及与肠道炎症之间的关系。该研究成果在线发表于Cell出版社旗下的Cell Host & Microbe杂志。
作者首先用E. lenta 菌株 (DSM 2243)灌胃SPF小鼠和无菌(GF)小鼠,结果显示无论是在SPF或是GF小鼠中,其回肠和结肠固有层中的IL17a+CD4+细胞及IL17a的水平均相较于对照组明显增加,表明E. lenta对Th17的活性和功能的影响与肠道内其他菌群存在与否无关(图1)。作者对IBD患者的粪便进行了宏基因组测序分析,发现E. lenta在IBD患者粪便样本中显著高于健康对照组。随后作者采用IBD小鼠模型研究E. lenta定殖对肠炎的影响,发现在DSS诱导的肠炎模型与IL10-/-肠炎模型小鼠中,E. lenta定殖加剧了结肠炎的严重程度。
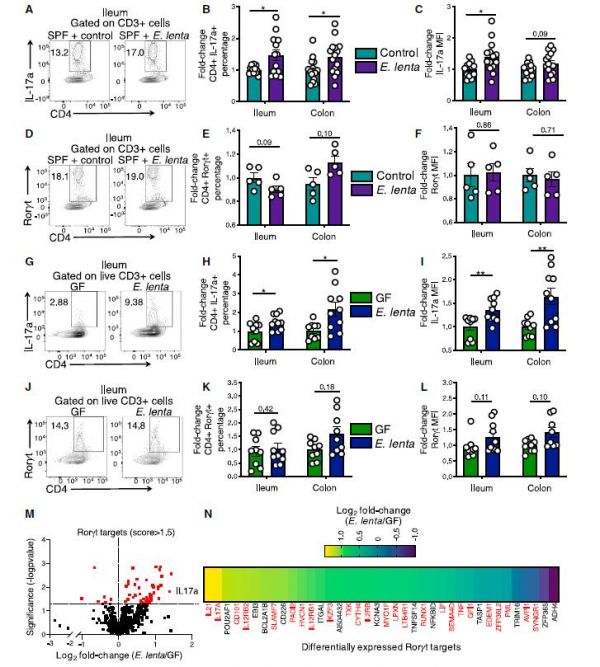
▲图1. E. lenta活化Th17并促进Rorγt靶基因的表达。
为了评估E. lenta不同菌株间免疫调节的能力,作者通过体外实验检测了10种不同的菌株,发现有4种菌株具有诱导IL17a产生的潜力,并通过比较基因组学确定了与Th17激活模式匹配的基因组位点,发现7个基因均位于cgr相关基因簇内,是强心药物地高辛和其他强心甾烯类药物代谢所必需的。体内实验中,作者用cgr2野生型菌株与cgr2部分功能缺失的菌株Y33N证实了Cgr2对Th17的激活有重要作用。作者进一步检测了Th17相关的疾病(如:IBD和类风湿性关节炎)患者的粪便样本,发现cgr2+E. lenta与疾病严重程度显著正相关(图2)。
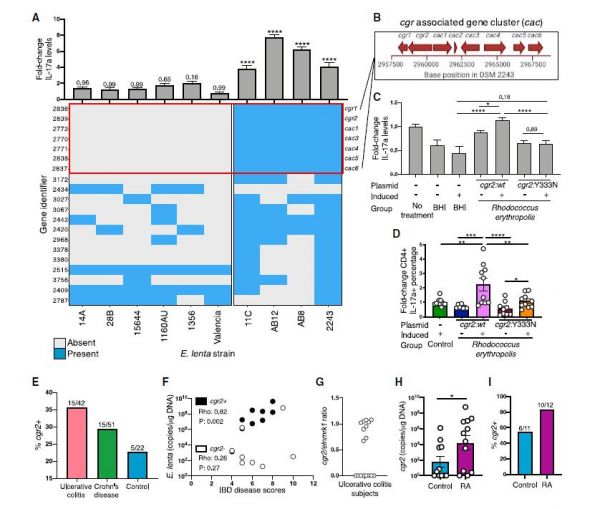
▲图2. 肠道细菌代谢酶Cgr2促进IL-17a的产生,并与自身免疫性疾病的进程相关。
已有研究表明肠腔中精氨酸(Arg)水平增加可阻断Cgr2对地高辛的抑制作用。作者采用两种含有不同浓度精氨酸的饲料喂食GF小鼠,发现1% Arg喂食的小鼠中,cgr2+ E. lenta的定殖明显增加了Th17的比例,而3% Arg喂食的小鼠抵消了该效应。随后用上述不同Arg浓度的饮食方式喂食SPF小鼠,同时灌胃cgr2+和cgr2- E. lenta 并诱导肠炎,结果显示较高浓度的精氨酸水平可抑制cgr2+E. lenta对Th17的激活及对结肠炎的促进作用。
综上,本研究聚焦了人类肠道细菌E. lenta与自身免疫性疾病的关系,通过体内、体外实验及不同动物模型,发现了表达强心苷还原酶Cgr2的E. lenta可以解除地高辛对Th17转录因子Rorγt的抑制作用,激活Th17产生IL17a,进而加剧小鼠结肠炎。同时也发现饮食中高精氨酸水平可用于调节cgr2+ E. lenta对Th17的激活作用,以缓解肠炎(图3)。该研究揭示了人类肠道细菌的代谢过程在自身免疫性疾病中的重要作用和调节机制。上述工作于11月24日发表在Cell Press旗下旗舰刊Cell Host & Microbe上面。
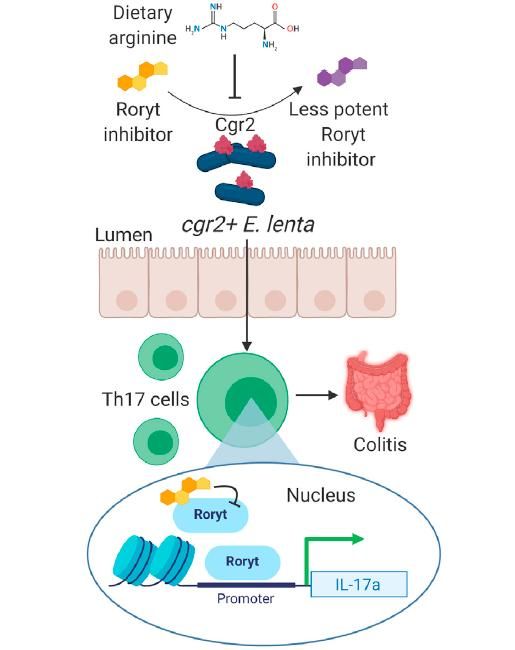
▲图3. E. lenta通过激活Th17细胞调节肠炎的模式图
论文摘要
细菌激活的Th17细胞可加剧小鼠的自身免疫,但人相关的细菌如何影响Th17相关疾病的发展仍未被阐明。我们的研究发现人类肠道放线菌属的Eggerthella lenta 通过解除对Th17转录因子Rorγt的抑制作用,进而诱导了肠道Th17的激活。在炎症性肠病(IBD)患者中E. lenta显著富集,在小鼠模型中,E. lenta通过激活Rorc加剧结肠炎。不同的E. lenta菌株对Th17的激活存在差异,该差异是由强心苷还原酶(Cgr2)导致。Cagr2能够诱导Th17产生细胞因子IL17a。体外培养实验表明cgr2+E. lenta会消耗甾体苷,甾体苷与人类IBD的严重程度呈负相关。最后,我们通过利用Cgr2对膳食中精氨酸的敏感性,抑制了E. lenta诱导的小鼠肠道炎症。以上研究表明,人类肠道细菌的代谢在诱导Th17相关的自身免疫性疾病过程中发挥了重要作用。
Bacterial activation of T helper 17 (Th17) cells exacerbates mouse models of autoimmunity, but how human associated bacteria impact Th17-driven disease remains elusive. We show that human gut Actinobacterium Eggerthella lenta induces intestinal Th17 activation by lifting inhibition of the Th17 transcription factor Rorγt through cell- and antigen-independent mechanisms. E. lenta is enriched in inflammatory bowel disease (IBD) patients and worsens colitis in a Rorc-dependent manner in mice. Th17 activation varies across E. lenta strains, which is attributable to the cardiac glycoside reductase 2 (Cgr2) enzyme. Cgr2 is sufficient to induce interleukin (IL)-17a, a major Th17 cytokine. cgr2+ E. lenta deplete putative steroidal glycosides in pure culture; related compounds are negatively associated with human IBD severity. Finally, leveraging the sensitivity of Cgr2 to dietary arginine, we prevented E. lenta-induced intestinal inflammation in mice. Together, these results support a role for human gut bacterial metabolism in driving Th17-dependent autoimmunity.
向下滑动阅览摘要原文
中文内容仅供参考,请以英文原文为准
述评人简介

王硕
中科院微生物所研究员
中国科学院青促会会员
王硕,中科院微生物所研究员,博士生导师。2012年获中国科学院生物物理研究所所理学博士学位,2019年任中国科学院微生物研究所研究员,课题组长,博士生导师 。2015年入选中国科学院青年创新促进会,2019年获得中科院青促会优秀会员称号。2017年获得国家优秀青年科学基金资助。王硕研究员主要从事肠道黏膜固有淋巴样细胞发育分化和免疫应答的研究,曾在肠道黏膜免疫与肠道炎症/肿瘤调节、天然免疫细胞抗感染机制等方面取得重要研究成果。
Dr. Shuo Wang, principle investigator of Institute of Microbiology, CAS. In 2012, she obtained the doctorate of science from Institute of Biophysics, CAS. In 2019, she served as a principle investigator and doctoral supervisor of Institute of Microbiology, CAS. In 2015, she joined the Youth Innovation Promotion Association of CAS and won the title of excellent member of the Youth Innovation Promotion Association of CAS in 2019. In 2017, she was supported by the Excellent Young Scientists Fund of NSFC. Dr. Wang is mainly engaged in the research on the development, differentiation and immune response of innate lymphoid cells in intestinal mucosa. She has made important research achievements in intestinal mucosal immunity, intestinal inflammation / tumor regulation, anti-infection mechanism of innate immune cells, etc
阅读原文
相关知识
健康肠道,健康骨骼:瞄准肠道菌群,促进骨骼健康
Nature子刊:肠道细菌代谢物通过抑制铁死亡来促进结直肠癌
谷物调节肠道菌群,促进代谢健康
【论肿道麻】Sirtuins: T细胞代谢和功能的重要调节因子
体内稳态和肿瘤免疫中的T细胞代谢
益生菌介导色氨酸代谢通过肠道
优化肠道菌群——对抗肌肉减少和骨质流失
科学网—[转载]谷物调节肠道菌群,促进代谢健康
肠道微生物群对胆汁酸代谢和信号传导影响的最新研究成果
Protein & Cell:肠道菌群及其代谢物在代谢性疾病中的作用
网址: 人体肠道细菌的代谢过程促进Th17细胞活化和肠炎发展 https://m.trfsz.com/newsview683392.html