母乳低聚糖的体内代谢与体外合成研究进展
摘 要:母乳低聚糖(human milk oligosaccharides,HMOs)是母乳中独特的营养成分,结构复杂,种类繁多,不同的HMOs可能具有不同的功能。本文在HMOs的个体差异性、结构多样性与功能活性方面介绍了HMOs的最新研究进展,重点阐述了HMOs在人体内的代谢途径以及体外的合成途径,最后阐述了HMOs在婴儿配方粉中的应用现状,提出了研究及应用中面临的问题。HMOs的应用是婴儿配方奶粉发展中的重大突破,缩小了配方奶粉喂养儿在肠道菌群组成、免疫功能以及认知等方面上与母乳喂养儿的差距。HMOs的深入研究为新型婴儿配方奶粉的开发提供理论依据。
母乳是婴儿营养的最佳选择。母乳中的HMOs是仅次于乳糖和脂肪的第三大营养物质,HMOs不能被人近端肠道吸收,但可在大肠发挥益生元的作用,其对婴儿生长发育、免疫系统发育、肠道微生态系统建立和肠黏膜屏障功能等方面有重要的作用。HMOs或许能缩小配方粉喂养婴儿与母乳喂养儿的差距[1]。母乳中约含有1%的HMOs,在足月母乳中岩藻糖基化、唾液酸化和非岩藻糖基化中性HMOs的比例大约为35%~50%、12%~14%和42%~55%[2]。HMOs的体内代谢关系到其功能活性,其复杂的结构特性又决定了体外合成的难度。因此,了解HMOs的体内代谢与体外合成对HMOs的深入研究与应用具有重要意义。
1 HMOs的差异性与多样性
1.1 HMOs在个体间的差异性
研究指出HMOs在不同个体间存在着明显的差异。Mcguire等[3]的研究团队报告了不同地理环境的人群HMOs在组成与浓度上的差异。出现这种差异主要受到母亲的血型和相关基因的表达以及外在环境因素的影响。不同Lewis(Le)血型及分泌类型与HMOs的组成密切相关,其在体内表达的含量和活性的高低决定了HMOs糖链中成分结构的差异。其次,外在原因还包含母亲饮食、地域环境(比如一个地区城市与农村之间)等因素的影响。HMOs在同一个体的不同哺乳期也存在不同,并且随着体质量与年龄的变化而变化[3]。HMOs在人初乳中质量浓度达到20~25 g/L,而在成熟乳中降至5~10 g/L。在24~28 岁母亲的乳中,HMOs的含量明显高于14~18 岁母亲的乳汁[4]。此外,与足月分娩的妇女相比,早产儿的母乳中HMOs的浓度高于足月儿,并且早产妇女乳汁中含有的岩藻糖基化或唾液酸化的HMOs存在更大的差异[5]。
了解不同HMOs的结构差异是非常重要的,因为越来越多的研究表明,不同结构的HMOs可能对婴儿健康和疾病风险有特定的影响。例如,一项关于墨西哥婴儿的研究中,食用低浓度2’-岩藻糖基乳糖(2’-fucosyllactose,2’-FL)的婴儿腹泻发病率显著高于食用高浓度2’-FL的婴儿[6]。另一项研究表明含有更高浓度的Fut2基因编码的HMOs与婴儿低过敏风险有关[7]。此外,较低浓度的总HMOs与较高浓度的3’-唾液酸乳糖(3’-sialyllactose,3’-SL)与人类免疫缺陷病毒(human immunodeficiency virus,HIV)的传播有关[8]。目前,众多的研究表明了HMOs在人体间差异的原因,但对于这些因素以什么样的形式产生影响,以及影响的程度尚不明确;因此,需要进行针对性的基因组学分析,以确定这些差异受遗传变异影响的程度,同时,需进一步分析生活条件、行为和环境因素对差异产生的贡献大小。
1.2 HMOs结构的多样性
HMOs结构复杂、种类繁多。了解母乳中HMOs不同的结构与含量具有重要意义。目前已经具有较为成熟的检测分析方法能够对部分HMOs进行定性定量分析。首先,由于母乳中含有的多种成分,如脂类、蛋白质、乳糖和盐类,可能会干扰HMOs的定量检测,因此分析检测样品中HMOs必须进行前处理。脂类和蛋白质通常通过在0~4 ℃下离心、氯仿/甲醇萃取(重复2~3 次)、乙醇沉淀、乙腈沉淀和超滤分离等技术去除[9-10]。然后,采用无孔石墨化碳将样品进一步纯化去除盐类、乳糖、还原剂等[11]。最后,将处理后的样品先进行分离,之后通过检测器检测。用于样品分离的技术,包括多孔石墨化碳、毛细管电泳、液相色谱,一般采用质谱和荧光检测器检测。目前,已有超过150 种HMOs被检测出来。
HMOs是由5种单体排列组合后加到乳糖分子上构成的,这5 种单体分别是N-乙酰葡萄糖胺(N-acetylglucosamine,GlcNAc)、D-葡萄糖(D-glucose,Glc)、D-半乳糖(D-galactose,Gal)、L-岩藻糖(L-fucose,Fuc)、唾液酸(sialic acid,SA)。HMOs一般包含3~22 个糖单元,具有一定的结构骨架(图1A、B),其还原端都含有一个乳糖(Galβ1-4Glc)[12]。乳糖可以直接被Fuc与N-乙酰神经氨酸(N-acetylneuraminic acid,Neu5Ac)(SA的前体)修饰。同时,HMOs糖链的延伸也可以通过在还原端的乳糖上连接两种二糖结构(I型链Gal-β-1,3-GlcNAc和II型链Gal-β1-4GlcNAc)进行糖链的延伸。利用β-1,3键添加二糖结构使糖链发生线性延伸,而两个二糖之间的β-1,6键则引入链的分支[13],延伸的糖链又可以进行岩藻糖基化或唾液酸化。一些HMOs还会以几种异构体形式存在,例如乳酰-N-岩藻糖基五糖(图1C)。之前的研究基于所发现的HMOs结构,提出了一个由13 个结构组成的核心单元。但随着检测技术的进步,发现了更多新的HMOs结构,13 个核心单元已不能完全描述所发现的HMOs结构。因此,有研究人员提出将13 个核心单元扩展到19 个。本文给出了新提出的6 种核心单元的结构示意图[14](图1D)。
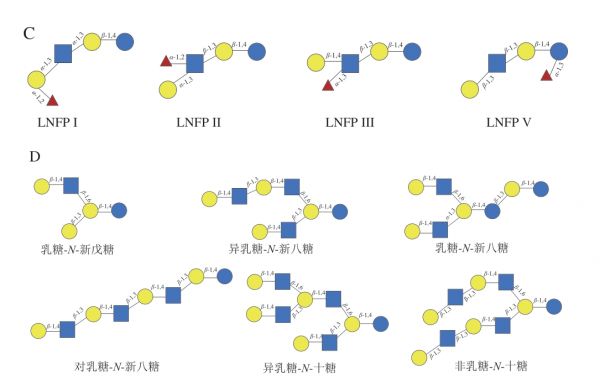
图1 HMOs的结构[12,14]
Fig. 1 Structures of HMOs[12,14]
A. HMOs结构骨架;B. HMOs结构中化学键链接方式;C.乳糖-N-岩藻酸激酶异构体;LNFP.乳糖-N-岩藻五糖(lacto-N-fucopentose);D. 6 种新的核心结构。
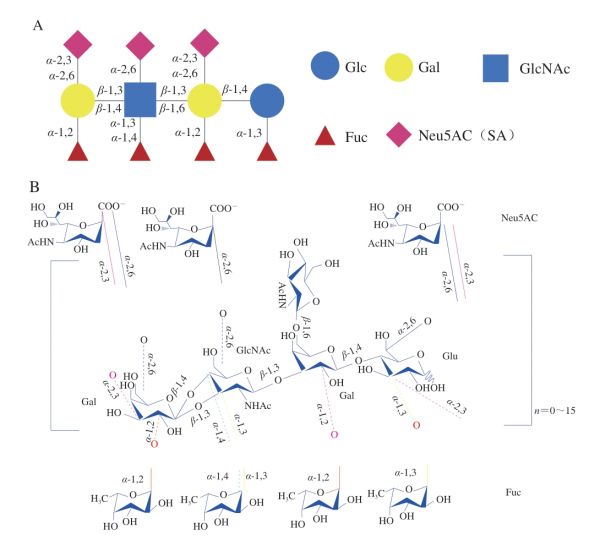
HMOs是在母亲乳腺中糖基转移酶的作用下生成的,乳腺中糖基转移酶的合成受基因调控,除岩藻糖基转移酶外,所有的母亲自身都能够合成其他糖基转移酶[15]。而岩藻糖基转移酶与母亲分泌类型和Lewis血型抗原有关,分泌型(secretor,Se)基因编码一个α-1,2岩藻糖基转移酶(fucosyltransferase 2,FUT2),Le基因编码α-1,3/4岩藻糖基转移酶(FUT3)[16]。不同母亲的岩藻糖基转移酶基因的表达具有很大差异,导致酶活性不同,从而导致不同个体中岩藻糖基化HMOs的差异。因此,可以将女性分为4 组(Se±/Le±)不同的表现形式。唾液酸化的HMOs则通过唾液酸转移酶将一个或多个SA添加到HMOs的糖链上,这一过程是将Neu5Ac连接至末端Gal或内部GlcNAc上[17]。
2 HMOs的生物学功能
2.1 调节肠道菌群
肠道菌群与宿主的健康和疾病有着密切的关系,它在肠道营养物质代谢、抵抗致病微生物定植、促进免疫系统发育及成熟等方面发挥着重要作用[18]。健康肠道菌群结构的建立对婴儿的生长发育至关重要,婴儿在生命前期肠道内微生物状态是逐渐向着双歧杆菌占主导地位过渡的[19],而婴儿肠道的微生物定植是一个具有挑战的过程[20]。研究发现缺少HMOs的配方奶粉喂养的婴儿与母乳喂养的婴儿相比肠道菌群更脆弱[21]。一方面,HMOs能够作为婴儿肠道中有益细菌的代谢基质,有助于塑造婴儿肠道微生物群;另一方面,HMOs经肠道益生菌代谢后产生多种人体可吸收利用的短链脂肪酸和乳酸盐,并使肠道的pH值呈酸性,从而抑制过度繁殖的有害菌[22]。
2.2 调节免疫
HMOs在婴儿免疫系统的发育中发挥着特殊的作用。HMOs的丰富多样性具有调节婴儿先天性免疫和适应性免疫的潜力。胃肠道对婴儿的免疫至关重要,肠道上皮构成一个功能屏障,阻止肠道内微生物群特别是病原菌对宿主的侵袭,并且提供大量免疫细胞。婴儿的胃肠道极为敏感,容易出现炎症基因的过度表达和负责先天性信号反馈调节的基因表达不足,这可能导致免疫反应的放大,导致过度炎症[23]。母乳喂养可以显著改善婴儿肠道免疫功能,这主要是因为母乳中的HMOs可以阻止婴儿肠内炎症基因的表达,提高婴儿的免疫力。
岩藻糖基HMOs通过竞争机制抑制细菌毒素与肠黏膜受体的黏附,如空肠弯曲菌和大肠杆菌毒素[24]。大多数岩藻糖基HMOs能够促进辅助型T细胞2(T helper 2 cell,Th2)的活性,如2’-FL、LNFP I、LNFP III[24]。同时2’-FL与LNFP I在体外降低了促炎性巨噬细胞源性白介素(interleukin,IL)-12和γ-干扰素(interferon-γ,IFN-γ)的水平,增加了促进Th2极化的IL-10水平[25]。而LNFP Ⅲ在体外抑制巨噬细胞和树突状细胞2(dendritic cell 2,DC2)的成熟,从而促使IL-4和抑制促炎性IFN-γ的产生[26]。与岩藻糖基HMOs类似,唾液酸化HMOs也被证明能阻止病原菌与肠道上皮细胞的结合,增强机体免疫反应。含一个或两个唾液酸残基的HMOs组分显著降低血小板中性粒细胞复合体(platelet-neutrophil complex,PNC)的形成和中性粒细胞的活化[27]。3’-SL通过肽聚糖模式识别3(peptidoglycan pattern recognition 3,PGlyRP3)促进Th2反应,减少细胞IL-8、IL-12和TNF-α基因的表达[28]。另外,唾液酸化HMOs刺激DCs释放细胞因子,促进T细胞转向免疫应答更为平衡的表型Th1和Th2[29]。许多研究证实半乳糖基乳糖(galactosyllactoses,GL)具有调节免疫的能力,如3’-GL、4’-GL、6’-GL通过抑制IL-8的产生,进而抑制多胞二酸(polycytodilic acid,PIC)诱导的肠上皮细胞的炎症[30]。
碳水化合物的结合物是HMOs在免疫系统中发挥作用的潜在机制,一些凝集素已被证明参与调节免疫系统功能,如C型凝集素、类动物凝集素和半乳糖凝集素[23]。一方面,HMOs可能影响凝集素功能,从而有助于细胞信号传导。大多数凝集素受体在与多价碳水化合物配体交联后通过其多聚体诱导信号通路[31]。另一方面,HMOs可以作为抑制性配体,唾液酸化HMOs能够抑制选择素介导的白细胞黏附内皮细胞[32]。同样,已有研究表明,一些HMOs能够调节在启动细胞免疫反应中起着中心作用的Toll样受体(toll-like receptor,TLR)的表达和信号转导途径。体外实验表明,添加LNFP I和6’-GL可促进TLR4的mRNA表达,而3’-SL、6’-SL和6’-GL可增强TLR4和TLR2的表达[24]。
2.3 抗病毒、抗菌作用
HMOs具有很强的抗病毒、抗菌潜力。可以抵御多种病毒病原体,如诺若病毒、轮状病毒、流感病毒、HIV[33-34](表1)。病毒附着于宿主表面是建立病毒感染的关键,通过特定的碳水化合物黏附于宿主上皮细胞,许多参与这一过程的细胞表面聚糖表位已经被鉴定,如人类血型抗原(human blood group antigens,HBGAs),根据糖基转移酶的活性,将HBGAs分为4 种不同类型,即血型A、B、H和Lewis[33]。HMOs抗病毒最可能的机制是通过减少病毒对靶细胞的黏附,HMOs类似于各种细胞表面糖基化结构如糖脂或糖蛋白结构,能够充当病毒的可溶性受体[34]。一些具有抗病毒作用的HMOs单体已经被证明(表1)。
表1 HMOs抗病毒作用
Table1 Antiviral effect of HMOs

注:LNDFH.乳糖-N-二岩藻六糖(lacto-N-difucohexaose);LNT.乳糖-N-四糖(lacto-N-tetrose);LNnT.乳糖-N-新四糖(lacto-Nneotetraose);DFLNH.二岩藻糖基内酯-N-六糖(difucosyllacto-Nhexaose)。
病毒 分类 结合表位 抗病毒作用的HMOs诺若病毒 GI~GVIA type、B type、H type、Leb、Ley、Lex2’-FL、3’-FL、LNFP I、LNFP III、LNDFH I、DFLNH轮状病毒 G型和P型 A type、B type、H type、Leb、Lex LNT、LNnT、LNDFH I、LNFP I流感病毒 禽流感病毒 SA-α-2,6-Gal 6’-SL人流感病毒 SA-α-2,6-Gal 6’-SL
HMOs还可以像其抗病毒作用一样,作为细菌特别是致病菌与宿主相互作用界面上的抗黏接剂,HMOs可以显著减少大肠杆菌对培养的上皮细胞的附着,阻止微生物病原体进入[35],如导致大多数细菌性腹泻的空肠弯曲菌[36]和肠致病性大肠杆菌[35]。此外,HMOs可能有一种更直接的方法来控制病原体。HMOs可以不依赖于宿主免疫,直接抑制无乳链球菌(Streptococcus agalactiae,GB)的生长,GB是婴儿侵袭性细菌感染的主要原因,通常是在分娩时垂直获得,与婴儿患肺炎、败血症和脑膜炎密切相关[37]。研究发现,当存在HMOs时,GB不再增殖[38]。体外研究表明,HMOs具有类似于一些抗生素的作用,GB利用一种糖基转移酶将特定的HMOs结合到细胞膜中,进而阻止GB增殖[39]。进一步研究分离不同的HMOs组分,发现其抑制GB活性仅限于特定的非唾液酸化HMOs,这些非唾液酸化HMOs与多种常规抗生素具有协同作用[38]。
2.4 HMOs对脑发育的影响
越来越多的证据表明,HMOs在大脑的生长发育以及认知能力的建立中起着关键作用。髓鞘化、突触的形成以及神经递质的释放都受到受体糖基化的调节。有报道称在大鼠大脑的突触连接中有岩藻糖基化糖蛋白,并且放射性标记的岩藻糖经颅内注射后可迅速并入糖蛋白并转移到神经末梢[40]。Vázquez等[41]首次在啮齿动物中证明了岩藻糖基化母乳低聚糖能提升大鼠与小鼠的认知能力,并且增加了脑源性神经营养因子等参与记忆形成的分子。
在大脑中,SA是脑神经节苷脂和修饰神经细胞黏附分子的poly-SA链的重要组成部分。SA在中枢神经系统中与神经元细胞间的通讯有关。母乳中的SA主要以唾液酸化的HMOs形式存在。这些唾液酸化神经节苷脂在突触形成、轴突生长、树突再生和神经传递中起着重要作用。动物研究表明,学习能力的提高与脑神经节苷脂和糖蛋白中SA的浓度有关[42]。此外,研究发现饮食中添加3’-SL或6’-SL会增加大脑不同区域的总SA和神经节苷脂结合SA的浓度[43]。HMOs对婴儿脑结构和认知的发育的潜在机制解析尚不完善,在婴儿个体中的研究鲜有报道。因此,关于HMOs对脑发育影响的深入研究尤为重要,这也会为HMOs在婴儿配方粉中的应用增加必要性。
3 HMOs在机体内的吸收与利用
HMOs被认为是人类第一益生元,在婴儿胃肠道的上端不能被消化,这是由于婴儿胃肠道上端缺乏糖苷水解酶和肠膜转运蛋白[44],所以大多数HMOs能直接到达胃肠道远端,作为特定微生物的底物影响胃肠道微生物群的组成和活性。婴儿代谢不同HMOs的能力与微生物群密切相关,是通过特定的细菌组合进行的,特别是双歧杆菌属、拟杆菌属和乳酸杆菌属[45]。HMOs与利用它的细菌具有特异性,HMOs能够特异性地刺激肠道内微生物的活性,而这些微生物又能够特异性地表达唾液酸酶或者岩藻糖苷酶来切割唾液酸化和岩藻糖基化的HMOs[46]。所以肠道内多种双歧杆菌和类杆菌可以对不同种类HMOs加以利用,而肠杆菌等条件致病菌对HMOs的利用能力相对较差,一些有害细菌如致泻性大肠杆菌、梭状芽孢杆菌等几乎不能利用HMOs[47]。
3.1 双歧杆菌代谢HMOs的途径
在生命早期,双歧杆菌是母乳喂养婴儿肠道的优势菌群,这些细菌具备专用的糖苷水解酶、转运体和其他有助于利用HMOs的分子,所以是HMOs的主要消耗者。虽然有多种双歧杆菌可利用HMOs,但并不是所有双歧杆菌都能利用HMOs,不同的双歧杆菌物种和菌株在利用HMOs的能力方面具有高度特异性,这种利用HMOs的能力取决于双歧杆菌所配备的酶[48]。研究发现了两种长双歧杆菌亚种代谢HMOs的途径(图2)。其一,两歧双歧杆菌(Bifidobacterium bifidum)通过半乳糖-N-二糖/乳糖-N-二糖(galacto-N-biose/lactose-N-biose,GNB/LNB)途径代谢HMOs[49]。两歧双歧杆菌具有细胞膜结合的LNB糖苷酶,能在细胞外解聚HMOs,并产生LNB水解产物,LNB通过ABC转运体导入,并在GNB/LNB途径中被LNB磷酸化酶进一步水解(图2A)。其二,婴儿双歧杆菌(Bifidobacterium longum subsp. infantis)与两歧双歧杆菌不同,其没有胞外将HMOs裂解为LNB的乳糖-N-生物糖苷酶同系物,但是婴儿双歧有一个独特的43 kb基因簇,负责编码一系列糖苷酶、ABC转运体和细胞外寡糖溶质结合蛋白[50]。所以HMOs能够通过ABC转运体完整地运输到胞内,由各种胞浆糖苷酶进行水解。如:岩藻糖苷酶、β-半乳糖苷酶、唾液酸酶(图2B)[51]。
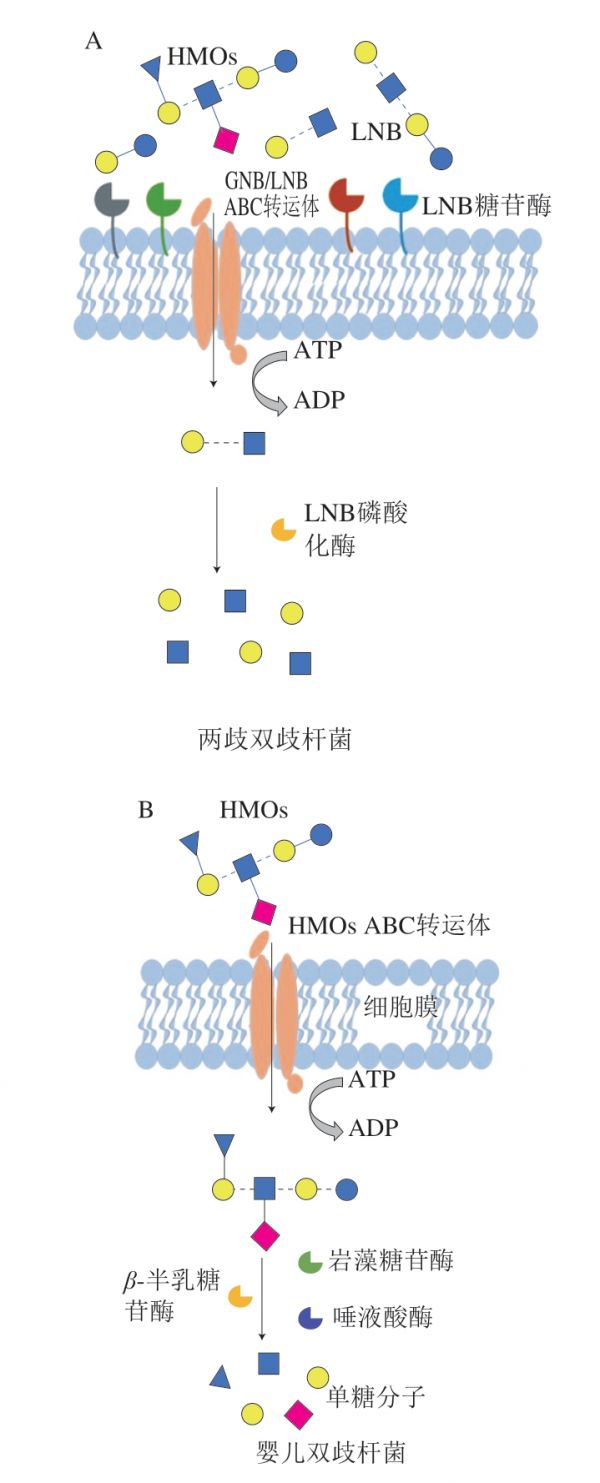
图2 两歧双歧杆菌(A)和婴儿双歧杆菌(B)代谢HMOs的途径[52]
Fig. 2 Metabolic pathways of HMOs in Bifidobacterium bifidum (A)and Bifidobacterium infantis (B)[52]
3.2 Roseburia代谢HMOs的途径
低聚糖抵抗人体胃部及肠道前端酶的消化到达肠道末端为肠道菌群的建立提供主要驱动力。双歧杆菌属不同成员在利用HMOs方面的竞争力,加强了双歧杆菌在母乳喂养婴儿的肠道菌群中的优势地位。婴儿肠道微生物群在断奶和引入固体食品期间发生显著变化,即双歧杆菌被硬壁菌取代,成为成熟肠道菌群中最丰富的门。在这一时期,来自碳水化合物发酵产生的短链脂肪酸如丙酸盐和丁酸盐,其浓度显著增加[53]。鉴于在肠道菌群建立初期,双歧杆菌在HMOs上的竞争优势决定其在菌群中的优势地位,因此在断奶期以及之后一段时期,处于优势地位的梭状芽孢杆菌目特别是Roseburia对HMOs的代谢能力受到关注。
Pichler等[54]通过基因组分析,发现在Roseburia中,HMOs利用位点具有多样性并普遍存在,并提出了Roseburia代谢HMOs的全新途径(图3)。研究揭示了Roseburia两个亚种R. homis和R. inulinivorans代谢HMOs的机制。在R. homis中,LNT、LNB和黏蛋白衍生的GNB被LNB转运体捕获并进入细胞质随后水解为LNB,然后被磷酸化酶(RhGLnbp112)进一步磷酸化为1-磷酸-α-D-半乳糖和相应的N-乙酰己糖胺。乳糖则被β-半乳糖苷酶水解。在R.inulinivorans中,HMOs在细胞外表面先进行初步水解,由相应的酶(RiLea/b136)催化发生,初步水解的HMOs通过相应的转运体(RiLea/bBP)进入到细胞内,通过岩藻糖苷酶(RiFuc29和RiFuc95)的协同作用去除Fuc,然后与在R. homis中一样,被磷酸化酶进一步分解。同时,SA单糖也可以通过相应的转运体进入到R. inulinivorans进行分解。分解产生的半乳糖和1-磷酸半乳糖通过Leloir途径转化为6-磷酸葡萄糖,N-乙酰己糖胺在进入糖酵解前转化为6-磷酸-N-乙酰葡萄糖胺。部分经过糖酵解产生的丙酮酸可以转化为丁酸盐[55]。
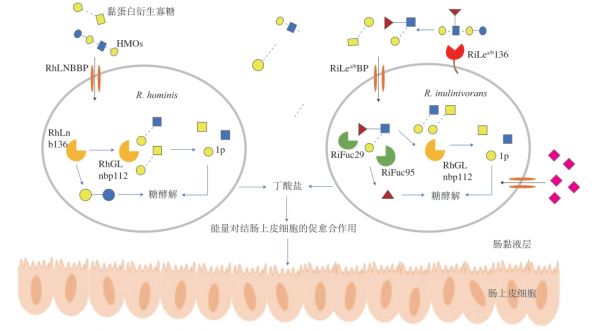
图3 Roseburia代谢HMOs的途径[54]
Fig. 3 Metabolic pathway of HMOs in Roseburia[54]
3.3 极少量被胃肠道吸收的HMOs的代谢途径
虽然HMOs在胃肠道上端不被消化,但HMOs对母乳喂养的婴儿具有全身健康益处,如全身免疫调节。这需要HMOs进入婴儿的血液,研究发现高达1%的HMOs被胃肠道吸收[56],在全身循环中可以被利用。一些研究利用13C标记的半乳糖喂养哺乳期妇女,该标记物可以直接进入到母亲的母乳低聚糖中,最终在婴儿的尿液中检测到这些13C-HMOs。这表明HMOs在吸收后可能先进入婴儿的血液循环中,然后通过尿液排出[57]。研究人员对16 例健康母乳喂养婴儿的尿液和血浆研究发现,一些小分子质量的HMOs能被完整地吸收到血液循环中,如2’-FL、3’-FL、LNnT[58]。
4 HMOs体外合成
从母乳中分离出HMOs仅在结构鉴定和基础研发有一定的应用,但是,受限于其极低的产量,这种方法不适合商业化的生产,HMOs的有限供应阻碍了其在婴儿营养中的应用,并阻碍了对其生物学效应的研究。因此,对于HMOs人工合成的探索与开发尤为重要。从化学合成到生物技术制造的转变,使得它们的产量和价格都更加趋向于商业化应用,特别是应用在婴儿配方奶粉。它也加速了临床前的基础研究和临床HMOs生物学领域的研究。
4.1 合成策略
越来越多关于HMOs合成的研究提出了许多HMOs合成的有效策略,这些策略为高效、精准以及大量合成HMOs提供了有力依据。Faijes等[17]在研究中总结并提出了逆向聚合合成策略来进行HMOs的合成(图4)。最常用的逆合成策略是2+2聚合反应,将I型或II型糖链结构组装到乳糖受体上,并且根据相关的化学或酶反应对其进行适当保护和活化。该反应能够产生不同的线性糖链或分支糖链结构,这些糖链结构可以进一步被岩藻糖基化或唾液酸化以获得相应的衍生物。另一个逆合成策略类似于HMOs的生物合成途径,在乳糖分子上以顺序的方式依次添加N-乙酰氨基葡萄糖和半乳糖进行糖链延伸,在延伸的糖链结构上进行岩藻糖基化或唾液酸化生成各种HMOs。这两种策略都先添加I型或II型糖链再进行岩藻糖基化或唾液酸化,而另一种策略则是直接使用岩藻糖基化或唾液酸化的供体,如Lewis表位(Lea/Lex或Leb/Ley)直接添加到乳糖分子上[1]。
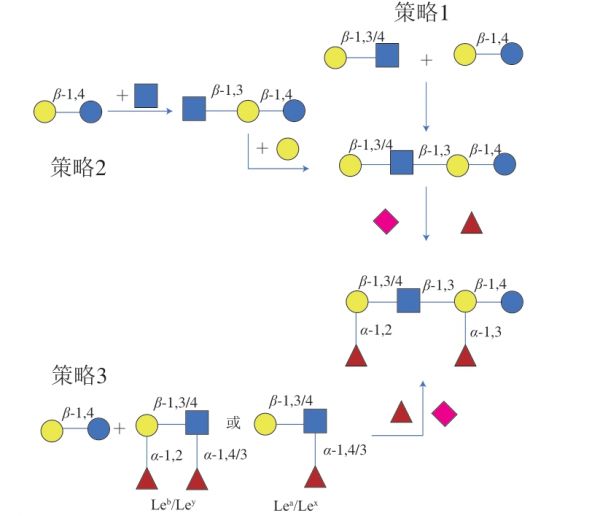
图4 逆向合成策略进行HMOs的合成[17]
Fig. 4 General retrosynthetic strategies for HMO production[17]
4.2 合成方法
4.2.1 化学合成法
糖苷键的构建是化学合成中最基本、最重要的过程。保护基的选择和糖苷化反应中特定糖苷键构型的选择性生成,是HMOs化学合成中的关键点。特定位置与构型的糖苷键的稳定高效构建需要选择出适合的保护基。化学合成的方法一般包括逐步缩合定向、“一锅法”合成和固相合成。比如,Glycom A/S公司已经通过化学合成大规模生产2’-FL和LNnT,并且能够用于临床前和临床项目的研究中;Jennum等[59]利用一锅糖基化反应,半乳糖硫糖苷化学选择性偶联至邻苯二甲酰亚胺保护的葡糖胺硫糖苷产生二糖,然后耦合到乳糖中的3’-位置,在第一次偶联中形成受保护的乳糖胺硫苷时,能够合成四糖结构的HMOs。同时,“一锅法”已用于高效合成由N-乙酰基乳糖胺、乳糖和岩藻糖组成的乳糖-N-新岩藻糖等五糖结构的HMOs。
化学合成方法能够合成所需要的特定结构的HMOs,特别是在合成结构复杂、分支多的HMOs时具有优越性。但是,HMOs的化学合成过程存在许多问题,如糖苷键形成的立体和区域选择性控制的不准确,多个活化、保护和脱保护步骤的复杂性使工业化生产具有诸多挑战,同时,其HMOs得率却难以提升。并且随着链长或分支模式的增加将使其合成更为复杂[60]。
4.2.2 体外酶法
体外酶法与体内细胞工厂法都离不开酶的作用,特别是糖基转移酶和糖苷水解酶(glycoside hydrolase,GH),因为HMOs合成中糖基化反应由这两种酶催化进行。糖基转移酶催化单糖从糖核苷酸供体转移到受体形成糖苷键,进而合成二糖、寡糖或多糖。GH则在特定条件下催化转糖基化反应[12,61]。体外酶法的关键点是通过酶工程合成更为有利的酶,因为相关的酶是HMOs合成过程中必不可少的。
体外酶法合成具有能有效保证糖苷化反应中糖苷键构型和能够将单糖逐个加到糖基受体特定位置的两大显著优点。酶法在体外进行,合成条件较体内的细胞法更容易控制,所以复杂的HMOs可以通过该方法合成。体外酶法合成HMOs依然面临许多挑战,比如,获得在体外仍然具有高效的酶是困难的,在体外反应中还会受到酶本身性质的限制。
4.2.3 体内细胞工厂法
细胞法通过代谢工程微生物生产HMOs,利用微生物的代谢机制和体内糖基转移酶的区域和立体选择性的活性,糖基转移酶的功能表达、其供体和受体底物在体内运输到细胞或合成的可用性,以及防止核苷酸副产物对合成酶的产物抑制作用,重组全细胞过度表达相应的异源糖基转移酶基因和参与糖核苷酸供体生物合成的基因[17,62]。目前通过合成生物学和代谢工程策略构建的一些模式宿主菌株,主要包括大肠杆菌、酵母、谷氨酸棒杆菌和枯草芽孢杆菌。在单细胞培养基中生产HMOs时,大肠杆菌是生产HMOs最常用的微生物[63]。
到目前为止,已有文献报道使用细胞工厂方法生产了超过42 种结构的HMOs。并且微生物细胞工厂和大规模发酵生产已成功应用于2’-FL的工业规模合成。但是体内细胞工厂法目前仅能够合成含有3~10 个单糖单元的低聚糖,并且大多数情况下不产生独特的HMOs,而是低聚糖的混合物。
5 HMOs在婴儿配方粉产业中的应用
婴儿配方奶粉的发展一直致力于向母乳更加靠近,但目前仍有众多因素与母乳存在区别,特别是HMOs成分。目前市售的奶粉主要是利用益生元(将低聚半乳糖(galactooligosaccharides,GOS)与低聚果糖(fructooligosaccharides,FOS)按照质量比9∶1添加)来代替HMOs,虽然益生元有一定的作用,但其取代不了HMOs。越来越多的临床实验表明,添加了人工合成的HMOs的配方奶粉不仅在成分上更接近母乳,而且在功能上也更接近母乳,用该配方奶粉喂养的婴儿在生长发育、耐受性、吸收和排泄效率、免疫发育等方面与母乳喂养的足月婴儿相似。因此,HMOs在婴儿配方食品中的应用已然成为这一行业发展的新趋势。
目前,在国外部分HMOs已被允许应用于婴儿配方奶粉中(表2)。毋庸置疑,随着全球各地监管和法规进程的推进,可以预计会有越来越大的HMOs市场容量被释放出来,也将会有更多的生产厂商加入进来。当前市场上HMOs的生产供应商全部是国外的公司,如巴斯夫、杜邦、菲仕兰等。虽然我国目前尚未允许HMOs在婴儿配方粉中应用,但是已有越来越多的学者关注到这一领域,并且在研究中也取得了不错的成果。
表2 可用于婴儿配方粉中的HMOs
Table2 HMOs approved for application in infant formula
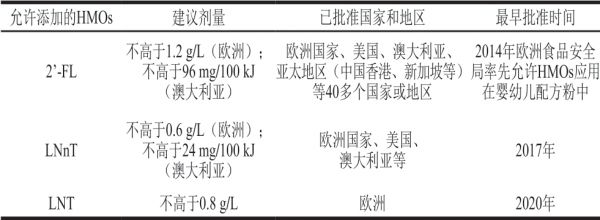
允许添加的HMOs 建议剂量 已批准国家和地区 最早批准时间2’-FL不高于1.2 g/L(欧洲);不高于96 mg/100 kJ(澳大利亚)欧洲国家、美国、澳大利亚、亚太地区(中国香港、新加坡等)等40多个国家或地区2014年欧洲食品安全局率先允许HMOs应用在婴幼儿配方粉中LNnT不高于0.6 g/L(欧洲);不高于24 mg/100 kJ(澳大利亚)欧洲国家、美国、澳大利亚等 2017年LNT 不高于0.8 g/L 欧洲 2020年
6 结 语
总之,作为母乳重要组成部分的HMOs具有重要的功能作用,但是其复杂的结构限制着人们对HMOs的认知以及应用。随着HMOs人工合成的进一步发展,特别是重组细胞的生物合成在大规模生产和分离纯化方面有了一定的进展,HMOs在婴儿配方奶粉中的应用会更被重视。HMOs的种类众多,仅添加一种或少数几种是不足以满足婴儿对HMOs的所有需求,并且HMOs在个体之间还存在着差异,因此仍需大量深入研究,特别是需要大量临床研究为HMOs的有益效果以及在婴儿配方奶粉中的应用提供合理详细的证据。
参考文献:
[1] PHIPPS K R, BALDWIN N, LYNCH B, et al. Preclinical safety evaluation of the human-identical milk oligosaccharide lacto-Ntetraose[J]. Regulatory Toxicology and Pharmacology, 2018, 99:260-273. DOI:10.1016/j.yrtph.2018.09.018.
[2] HONG Q, RUHAAK L R, TOTTEN S M, et al. Label-free absolute quantitation of oligosaccharides using multiple reaction monitoring[J].Analytical Chemistry, 2014, 86(5): 2640-2647. DOI:10.1021/ac404006z.
[3] MCGUIRE M K, MEEHAN C L, MCGUIRE M A, et al. What’s normal? Oligosaccharide concentrations and profiles in milk produced by healthy women vary geographically[J]. American Journal of Clinical Nutrition, 2017, 105(5): 1086-1100. DOI:10.3945/ajcn.116.139980.
[4] GAO Xiaoxiang, WU Desheng, WEN Yuxi, et al. Antiviral effects of human milk oligosaccharides: a review[J]. International Dairy Journal,2020, 110: 104784. DOI:10.1016/j.idairyj.2020.104784.
[5] UNDERWOOD M A, GAERLAN S C, DE LEOZ M L A, et al.Human milk oligosaccharides in premature infants: absorption,excretion, and influence on the intestinal microbiota[J]. Pediatric Research, 2015, 78(6): 670-677. DOI:10.1038/pr.2015.162.
[6] MORROW A L, RUIZ-PALACIOS G M, ALTAYE M, et al. Human milk oligosaccharides are associated with protection against diarrhea in breast-fed infants[J]. Journal of Pediatrics, 2004, 145(3): 297-303.DOI:10.1016/j.jpeds.2004.04.054.
[7] SPRENGER N, ODENWALD H, KUKKONEN A K, et al. FUT2-dependent breast milk oligosaccharides and allergy at 2 and 5 years of age in infants with high hereditary allergy risk[J]. European Journal of Nutrition, 2016, 56(3): 1293-1301. DOI:10.1007/s00394-016-1180-6.
[8] NIEKERK E V, AUTRAN C A, NEL D G, et al. Human milk oligosaccharides differ between hiv-infected and HIV-uninfected mothers and are related to necrotizing enterocolitis incidence in their preterm very-low-birth-weight infants[J]. Journal of Nutrition, 2014,144(8): 1227-1233. DOI:10.3945/jn.113.187799.
[9] 朱婧, 王鑫, 向雪松, 等. 母乳低聚糖的检测方法研究进展[J].中国食品卫生杂志, 2016, 28(3): 396-400. DOI:10.13590/j.cjfh.2016.03.027.
[10] HUANG Xunwen, ZHU Baoli, JIANG Tiemin, et al. Improved simple sample pretreatment method for quantitation of major human milk oligosaccharides using ultrahigh pressure liquid chromatography with fluorescence detection[J]. Journal of Agricultural and Food Chemistry,2019, 67(44): 12237-12244. DOI:10.1021/acs.jafc.9b03445.
[11] ALBRECHT S, SCHOLS H A, VAN DEN HEUVEL E G H M, et al.CE-LIF-MSn profiling of oligosaccharides in human milk and feces of breast-fed babies[J]. Electrophoresis, 2010, 31(7): 1264-1273.DOI:10.1002/elps.200900646.
[12] ZEUNER B, MEYER A S. Enzymatic transfucosylation for synthesis of human milk oligosaccharides[J]. Carbohydrate Research, 2020, 493:108029. DOI:10.1016/j.carres.2020.108029.
[13] BODE L. Human milk oligosaccharides: every baby needs a sugar mama[J]. Glycobiology, 2012, 22(9): 1147-1162. DOI:10.1093/glycob/cws074.
[14] URASHIMA T, HIRABAYASHI J, SATO S, et al. Human milk oligosaccharides as essential tools for basic and application studies on galectins[J]. Trends in Glycoence and Glycotechnology, 2018, 30:SJ11-SJ24. DOI:10.4052/tigg.1734.1SJ.
[15] THURL S, MUNZERT M, BOEHM G, et al. Systematic review of the concentrations of oligosaccharides in human milk[J]. Nutrition Reviews, 2017, 75(11): 920-933. DOI:10.1093/nutrit/nux044.
[16] MOUKARZEL S, BODE L. Human milk oligosaccharides and the preterm infant: a journey in sickness and in health[J]. Clinics in Perinatology, 2017, 44(1): 193-207. DOI:10.1016/j.clp.2016.11.014.
[17] FAIJES M, CASTEJONVILATERSANA M, VALCID C, et al.Enzymatic and cell factory approaches to the production of human milk oligosaccharides[J]. Biotechnology Advances, 2019, 37(5): 667-697. DOI:10.1016/j.biotechadv.2019.03.014.
[18] ROWLAND I, GIBSON G R, HEINKEN A K, et al. Gut microbiota functions: metabolism of nutrients and other food components[J].European Journal of Nutrition, 2018, 57(1): 1-24. DOI:10.1007/s00394-017-1445-8.
[19] MILANI C, DURANTI S, BOTTACINI F, et al. The first microbial colonizers of the human gut: composition, activities, and health implications of the infant gut microbiota[J]. Microbiology and Molecular Biology Reviews, 2017,81(4): e00036-17. DOI:10.1128/MMBR.00036-17.
[20] RAUTAVA S, LUOTO R, SALMINEN S, et al. Microbial contact during pregnancy, intestinal colonization and human disease[J]. Nature Reviews Gastroenterology & Hepatology, 2012, 9(10): 565-576.DOI:10.1038/nrgastro.2012.144.
[21] AYCICEK A, EREL O, KOCYIGIT A, et al. Breast milk provides better antioxidant power than does formula[J]. Nutrition, 2006, 22(6):616-619. DOI:10.1016/j.nut.2005.12.011.
[22] 李艳莉. 低聚糖对婴儿肠道菌群的益生功能[D]. 哈尔滨: 东北农业大学, 2012.
[23] DONOVAN S M, COMSTOCK S S. Human milk oligosaccharides influence neonatal mucosal and systemic immunity[J].Annals of Nutrition and Metabolism, 2016, 69(2): 42-51.DOI:10.1159/000452818.
[24] KULINICH A, LIU L. Human milk oligosaccharides: the role in the fine-tuning of innate immune responses[J]. Carbohydrate Research,2016, 432(1): 62-70. DOI:10.1016/j.carres.2016.07.009.
[25] SOTGIU S, ARRU G, FOIS M L, et al. Immunomodulation of fucosyllactose and lacto-N-fucopentaose on mononuclear cells from multiple sclerosis and healthy subjects[J]. International Journal of Biomedical Science, 2006, 2(2): 114-120.
[26] ZHU B, TRIKUDANATHAN S, ZOZULYA A L, et al. Immune modulation by lacto-N-fucopentaose III in experimental autoimmune encephalomyelitis[J]. Clinical Immunology, 2012, 142(3): 351-361.DOI:10.1016/j.clim.2011.12.006.
[27] BODE L, JANTSCHERKRENN E. Structure-function relationships of human milk oligosaccharides[J]. Advances in Nutrition, 2012, 3(3):383S-391S. DOI:10.3945/an.111.001404.
[28] ZENHOM M, HYDER A, DE VRESE M, et al. Prebiotic oligosaccharides reduce proinflammatory cytokines in intestinal Caco-2 cells via activation of PPARγ and peptidoglycan recognition protein 3[J].Journal of Nutrition, 2011, 141(5): 971-977. DOI:10.3945/jn.110.136176.
[29] EIWEGGER T, STAHL B, SCHMITT J, et al. Human milk-derived oligosaccharides and plant-derived oligosaccharides stimulate cytokine production of cord blood T-cells in vitro[J]. Pediatric Research, 2004,56(4): 536-540. DOI:10.1203/01.PDR.0000139411.35619.B4.
[30] HE Y, LIU S, LEONE S, et al. Human colostrum oligosaccharides modulate major immunologic pathways of immature human intestine[J]. Mucosal Immunology, 2014, 7(6): 1326-1339.DOI:10.1038/mi.2014.20.
[31] COLLINS B E, PAULSON J C. Cell surface biology mediated by low affinity multivalent protein-glycan interactions[J]. Current Opinion in Chemical Biology, 2004, 8(6): 617-625. DOI:10.1016/j.cbpa.2004.10.004.
[32] BODE L, KUNZ C, MUHLYREINHOLZ M, et al. Inhibition of monocyte, lymphocyte, and neutrophil adhesion to endothelial cells by human milk oligosaccharides[J]. Thrombosis and Haemostasis, 2004,92(6): 1402-1410. DOI:10.1160/TH04-01-0055.
[33] MOROZOV V, HANSMAN G S, HANISCH F, et al. Human milk oligosaccharides as promising antivirals[J]. Molecular Nutrition &Food Research, 2018, 62(6): 1700679. DOI:10.1002/mnfr.201700679.
[34] ETZOLD S, BODE L. Glycan-dependent viral infection in infants and the role of human milk oligosaccharides[J]. Current Opinion in Virology, 2014, 7(1): 101-107. DOI:10.1016/j.coviro.2014.06.005.
[35] MANTHEY C F, AUTRAN C A, ECKMANN L, et al. Human milk oligosaccharides protect against enteropathogenic escherichia coli attachment in vitro and EPEC colonization in suckling mice[J]. Journal of Pediatric Gastroenterology and Nutrition, 2014, 58(2): 167-170.DOI:10.1097/MPG.0000000000000172.
[36] RUIZ-PALACIOS G M, CERVANTES L E, RAMOS P, et al.Campylobacter jejuni binds intestinal H (O) antigen (Fucα1, 2Galβ1,4GlcNAc), and fucosyloligosaccharides of human milk inhibit its binding and infection[J]. Journal of Biological Chemistry, 2003,278(16): 14112-14120. DOI:10.1074/jbc.M207744200.
[37] SCHRAG S J, GORWITZ R J, FULTZBUTTS K, et al. Prevention of perinatal group B streptococcal disease revised guidelines from CDC[J]. Morbidity and Mortality Weekly Report, 2010, 59(10): 1-36.DOI:10.2307/42001049.
[38] LIN A E, AUTRAN C A, SZYSZKA A, et al. Human milk oligosaccharides inhibit growth of group B streptococcus[J]. Journal of Biological Chemistry, 2017, 292(27): 11243-11249. DOI:10.1074/jbc.M117.789974.
[39] ANDREAS N J, AL-KHALIDI A, JAITEH M, et al. Role of human milk oligosaccharides in group B streptococcus colonisation[J].Clinical & Translational Immunology, 2016, 5(8): e99. DOI:10.1038/cti.2016.43.
[40] ZATZ M, BARONDES S H. Rapid transport of fucosyl glycoproteins to nerve endings in mouse brain[J]. Journal of Neurochemistry, 2010,18(6): 1125-1133. DOI:10.1111/j.1471-4159.1971.tb12041.x.
[41] VÁZQUEZ E, BARRANCO A, RAMREZ M, et al. Effects of a human milk oligosaccharide, 2’-fucosyllactose, on hippocampal longterm potentiation and learning capabilities in rodents[J]. Journal of Nutritional Biochemistry, 2015, 26(5): 455-465. DOI:10.1016/j.jnutbio.2014.11.016.
[42] WANG Bing, YU Bing, KARIM M, et al. Dietary sialic acid supplementation improves learning and memory in piglets[J].American Journal of Clinical Nutrition, 2007, 85(2): 561-569.DOI:10.1186/1479-5868-4-3.
[43] JACOBI S K, YATSUNENKO T, LI D, et al. Dietary isomers of sialyllactose increase ganglioside sialic acid concentrations in the corpus callosum and cerebellum and modulate the colonic microbiota of formula-fed piglets[J]. The Journal of Nutrition, 2016, 146(2): 200-208. DOI:10.3945/jn.115.220152.
[44] GERMAN J B, FREEMAN S L, LEBRILLA C B, et al. Human milk oligosaccharides: evolution, structures and bioselectivity as substrates for intestinal bacteria[J]. Nestle Nutrition Workshop Series, 2008,62(1): 205-222. DOI:10.1159/000146322.
[45] BOREWICZ K, GU F, SACCENTI E, et al. Correlating infant fecal microbiota composition and human milk oligosaccharide consumption by microbiota of 1-month-old breastfed infants[J]. Molecular Nutrition &Food Research, 2019, 63(13): 1-13. DOI:10.1002/mnfr.201801214.
[46] GARRIDO D, RUIZMOYANO S, KIRMIZ N, et al. A novel gene cluster allows preferential utilization of fucosylated milk oligosaccharides in Bifidobacterium longum subsp. longum SC596[J].Scientific Reports, 2016, 6(1): 35045. DOI:10.1038/srep35045.
[47] MARCOBAL A, BARBOZA M, FROEHLICH J W, et al.Consumption of human milk oligosaccharides by gut-related microbes[J]. Journal of Agricultural and Food Chemistry, 2010, 58(9):5334-5340. DOI:10.1021/jf9044205.
[48] LOCASCIO R G, NINONUEVO M R, FREEMAN S L, et al.Glycoprofiling of bifidobacterial consumption of human milk oligosaccharides demonstrates strain specific, preferential consumption of small chain glycans secreted in early human lactation[J]. Journal of Agricultural and Food Chemistry, 2007, 55(22): 8914-8919.DOI:10.1021/jf0710480.
[49] NISHIMOTO M, KITAOKA M. Identification of N-acetylhexosamine 1-kinase in the complete lacto-N-biose i/galacto-N-biose metabolic pathway in Bifidobacterium longum[J]. Applied and Environmental Microbiology, 2007, 73(20): 6444-6449. DOI:10.1128/AEM.01425-07.
[50] SELA D A, CHAPMAN J, ADEUYA A, et al. The genome sequence of Bifidobacterium longum subsp. infantis reveals adaptations for milk utilization within the infant microbiome[J]. Proceedings of the National Academy of Sciences, 2008, 105(48): 18964-18969.DOI:10.1073/pnas.0809584105.
[51] SELA D A, MILLS D A. Nursing our microbiota: molecular linkages between bifidobacteria and milk oligosaccharides[J]. Trends in Microbiology, 2010, 18(7): 298-307. DOI:10.1016/j.tim.2010.03.008.
[52] GOH Y J, KLAENHAMMER T R. Genetic mechanisms of prebiotic oligosaccharide metabolism in probiotic microbes[J]. Annual Review of Food Science and Technology, 2015, 6(1): 137-156. DOI:10.1146/annurev-food-022814-015706.
[53] STEWART C J, AJAMI N J, O’BRIEN J L, et al. Temporal development of the gut microbiome in early childhood from the TEDDY study[J]. Nature, 2018, 562: 583-588. DOI:10.1038/s41586-018-0617-x.
[54] PICHLER M J, YAMADA C, SHUOKER B, et al. Butyrate producing colonic clostridiales metabolise human milk oligosaccharides and cross feed on mucin via conserved pathways[J]. Nature Communications,2020, 11(1): 3285. DOI:10.1038/s41467-020-17075-x.
[55] SWADHA A, HARRISHAM K, MANDE S S. Comparative in silico analysis of butyrate production pathways in gut commensals and pathogens[J].Frontiers in Microbiology, 2016, 7: 1945. DOI:10.3389/fmicb.2016.01945.
[56] DOTZ V, RUDLOFF S, BLANK D, et al. 13C-labeled oligosaccharides in breastfed infants’ urine: Individual-, structure- and time-dependent differences in the excretion[J]. Glycobiology, 2014, 24(2): 185-194.DOI:10.1093/glycob/cwt099.
[57] RUDLOFF S, POHLENTZ G, BORSCH C, et al. Urinary excretion of in vivo 13C-labelled milk oligosaccharides in breastfed infants[J].British Journal of Nutrition, 2012, 107(7): 957-963. DOI:10.1017/S0007114511004016.
[58] GOEHRING K C, KENNEDY A D, PRIETO P A, et al. Direct evidence for the presence of human milk oligosaccharides in the circulation of breastfed infants[J]. PLoS ONE, 2014, 9(7): e101692.DOI:10.1371/journal.pone.0101692.
[59] JENNUM C A, FENGER T H, BRUUN L M, et al. One-pot glycosylations in the synthesis of human milk oligosaccharides[J].European Journal of Organic Chemistry, 2014, 2014(15): 3232-3241.DOI:10.1002/ejoc.201400164.
[60] WANG Laixi, DAVIS B G. Realizing the promise of chemical glycobiology[J]. Chemical Science, 2013, 4(9): 3381-3394.DOI:10.1039/c3sc50877c.
[61] FAIJES M, CASTEJÓN-VILATERSANA M, VAL-CID C, et al.Enzymatic and cell factory approaches to the production of human milk oligosaccharides[J]. Biotechnology Advances, 2019, 37(5): 667-697. DOI:10.1016/j.biotechadv.2019.03.014.
[62] SPRENGER G A, BAUMGARTNER F, ALBERMANN C.Production of human milk oligosaccharides by enzymatic and wholecell microbial biotransformations[J]. Journal of Biotechnology, 2017,258: 79-91. DOI:10.1016/j.jbiotec.2017.07.030.
[63] HUANG Di, YANG Kexin, LIU Jia, et al. Metabolic engineering of Escherichia coli for the production of 2’-fucosyllactose and 3-fucosyllactose through modular pathway enhancement[J]. Metabolic Engineering, 2017, 41: 23-38. DOI:10.1016/j.ymben.2017.03.001.
相关知识
母乳低聚糖及其在婴幼儿配方乳粉中的 替代品研究进展
低聚半乳糖与婴幼儿健康关系的研究进展
低聚果糖与婴幼儿健康关系的研究进展
国内外妊娠妇女孕期体重管理的研究进展
肠道菌群及其代谢产物与妊娠期糖尿病相关性的研究进展
益生元新宠:低聚半乳糖 & 低聚果糖的奥秘
从母乳到餐桌:低聚半乳糖的营养价值与应用
低聚果糖和低聚半乳糖在乳制品中的应用
母婴分离状态下母乳喂养的研究进展
肠道小卫士:低聚半乳糖与低聚果糖的力量
网址: 母乳低聚糖的体内代谢与体外合成研究进展 https://m.trfsz.com/newsview780096.html