降糖之“艺”:胰岛素治疗新技术不断涌现
当前,糖尿病已逐渐成为威胁人们生命健康日益严峻的重大挑战。国际糖尿病联盟(IDF)最新数据显示,目前全球已有超过5.4亿人患有糖尿病,而这个数字仍在不断增加,其中我国就有约1.4亿糖尿病患者,也是患病人数最多的困家。糖尿病作为一种慢性代谢性疾病,长期的高血糖水平会导致血管和神经系统产生严重的并发症,从而影响患者生命健康和生活质量,并对卫生系统造成沉重负担。
胰岛素作为葡萄糖代谢的关键激素,其发现与迭代在糖尿病治疗中极其重要。自1921年发现胰岛素,到1965年我国科学家首次实现牛胰岛素的人工合成,再到重组人胰岛素的商业化生产,基础胰岛素的研发进展为糖尿病患者带来了曙光。
时至今日,外源性胰岛素的持续输注仍旧是糖尿病患者的主要治疗手段。然而,长期频繁的胰岛素注射操作复杂,易产生创面感染,使得患者依从性差,严重降低生活质量。因此,众多研究团队致力于开发更加高效、安全、依从性好的糖尿病治疗方案,以期持续控制血糖达标,为全球糖尿病患者消除更多隐患(如图1所示)。
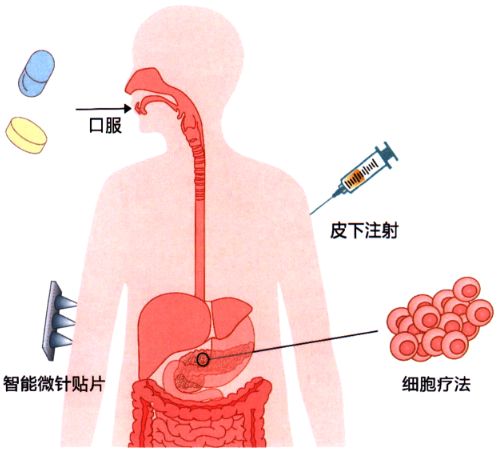
图1 胰岛素治疗新技术
传统皮下注射胰岛素新生
根据作用特点,目前的胰岛素制剂主要分为超短效胰岛素、短效胰岛素、中效胰岛素、长效胰岛素和预混胰岛素。尽管适用于不同场景的胰岛素制剂不断更新并得到应用,但传统皮下注射胰岛素仍旧无法完全还原生理性胰岛素的分泌模式,依然存在剂量难以调整、易导致低血糖风险且无法将进餐时间以及夜间因素考虑在内的严格的血糖控制等问题。
20世纪80年代,科学家们提出了基于实时响应机体动态血糖变化来自主实现葡萄糖响应性胰岛素释放的递送体系。利用葡萄糖氧化酶、苯硼酸基团和葡萄糖结合蛋白等成分作为葡萄糖响应组件,众多研究团队已构建了一系列血糖响应性胰岛素递送系统,通过载体材料的化学或物理结构改变、解聚、降解,与葡萄糖竞争替换等方式实现胰岛素的可控递送。
比如,浙江大学顾臻团队开发了基于苯硼酸的季胺型阳离子脂质,制备得到脂质纳米粒实现胰岛素葡萄糖响应性释放和高效负载。当血糖正常时,胰岛素仅缓缓释放;当血糖上升时,苯硼酸基团会与葡萄糖结合形成带负电的苯硼酸酯,使得脂质纳米粒所带电负荷转变为负电,导致其与带负电的胰岛素之间静电吸引减弱,促使胰岛素快速释放。另外,顾臻团队还设计了一种葡萄糖响应性聚合物,其负载胰岛素后可以持续调节血糖正常超过20h。然而,这类复合物容易在注射液中析出,导致在使用过程中注射困难和剂量不准确。因此,顾臻团队进一步使用聚乙二醇对聚合物进行修饰,修饰后的纳米复合物可以稳定保存7d以上,在皮下注射1型糖尿病小鼠后,在30min内可使其血糖恢复正常,并可维持20h。
四川大学张志荣团队也设计了一种仿生红细胞的葡萄糖响应性系统,其不仅拥有红细胞的长循环特性,而且可以通过酶促反应响应血糖变化,从而调节胰岛素释放速率。
除此之外,另一种通过对胰岛素分子进行化学修饰的策略也可使其具备葡萄糖响应能力。麻省理工学院Robert Langer团队将含有苯硼酸结构的脂肪链引入胰岛素分子中提高其疏水作用,以改变胰岛素类似物的药代动力学和葡萄糖响应活性。为了预防低血糖,顾臻团将胰岛素与葡萄糖转运蛋白抑制剂缀合设计了一种智能胰岛素类似物。在高血糖条件下,胰岛素类似物与葡萄糖转运蛋白发生解离,并与细胞膜表面的胰岛素受体结合增强,促使血液中葡萄糖浓度降低。当血糖过低时,胰岛素类似物则与葡萄糖转运蛋白的结合增强,抑制葡萄糖转运蛋白活性,阻止过多的葡萄糖进入细胞,减少低血糖的风险。
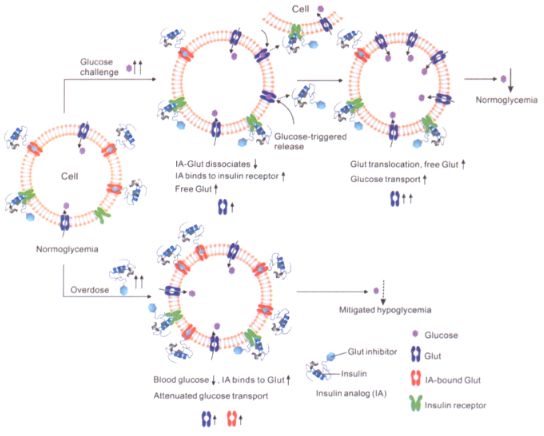
图2 智能胰岛素调节葡萄糖转运活性的作用机制
智能胰岛素贴片方兴未艾
传统的血糖管理方式需要糖尿病患者长期频繁检测血糖水平,并辅以每日多次皮下胰岛素注射,但这种基于皮下注射策略往往会导致患者依从性差,严重影响生活质量。而微针器件作为一种微创、微痛、便捷、安全的透皮递送方式,不仅在医美行业备受欢迎,在蛋白和基因药物透皮递送、疾病检测等领域也有广泛应用。
基于此,顾臻团队于2015年首次提出了智能胰岛素贴片的概念及原型,用以帮助糖尿病患者更加便捷和安全地使用胰岛素。智能胰岛素微针贴片通过模拟胰腺细胞功能以实现血糖响应性胰岛素释放,其设计理念是将胰岛素与血糖响应性高分子材料通过微针阵列整合起来,通过微针对角质层的有效穿刺进人表皮组织以实时监测体内血糖水平,并在高血糖情况下通过直接的血糖响应或者间接的葡萄糖氧化酶级联反应(包括缺氧、低pH等)促使胰岛素快速释放,而在血糖正常时减缓释放,实现糖尿病小鼠模型的血糖智能调节。采用微针阵列可显著减轻血糖监测及胰岛素注射过程中的疼痛感,并降低长时间皮下注射胰岛素所导致的皮肤硬结及创伤风险,进而提高病患的依从性。
为了进一步推动智能胰岛素贴片的临床转化,顾臻团队联合初创企业持续迭代该技术,并在2020年发布了新一代智能胰岛素贴片。该贴片的尺寸仅为硬币大小,即可维持1 d体重逾25 kg的糖尿病小型猪的血糖在正常范围内。贴片上的微针由含有苯硼酸基团的高分子单体与其他多种单体的混合溶液通过原位光聚合方式直接制得,而胰岛素直接装载在所形成的葡萄糖响应性聚合物基质中。在高血糖条件下,聚合物基质中负电荷增加,诱导基质膨胀,同时其与带负电的胰岛素之间静电作用力减弱,促进胰岛素的快速释放进入体内(如图3所示)。
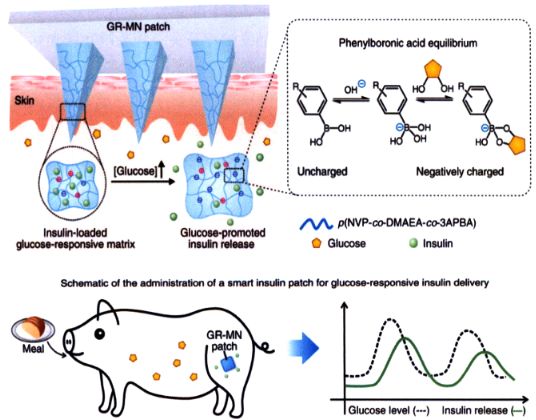
图3 智能胰岛素微针贴片机制
在正常血糖条件下,微针体积的回缩和静电相互作用的恢复减缓了胰岛素的释放速度,从而降低了低血糖的风险。这种基于原位光聚合策略的新型微针制造T艺简单高效,适于规模化生产。此外,胰岛素的高包封效率和高负载能力使该体系能够达到临床使用剂量标准,并且装载其中的胰岛素可在室温条件下长期保持生物活性。
在人体内,除了胰岛素之外,其他多种激素也参与到了血糖调控之中。其中胰腺所分泌的胰岛素和胰高血糖素往往处于动态平衡状态,对调节血糖水平起着至关重要的作用。尽管目前已经开发了多种不同的葡萄糖响应性胰岛素递送系统,但缺乏拥有自我调节功能的胰高血糖素释放模块仍会造成潜在的低血糖风险,从而限制临床应用。
针对这种情况,顾臻团队通过模拟胰岛B细胞和仅细胞动态释放胰岛素和胰高血糖素的逆反馈机制,设计了一种新型控糖微针贴片,针对胰高血糖素与胰岛素蛋白电荷性质间的差异,利用血糖水平调控微针基质所带电荷,实现胰岛素与胰高血糖素在不同情况下的动态可控释放。这种根据血糖水平的波动模拟胰岛细胞功能、调节胰岛素和胰高血糖素释放的治疗方法,有望实时适应机体血糖动态变化,在个体水平上提供精准医疗,从而在实现疗效的同时最大限度地减少低血糖的发生。
口服胰岛素的突破
相比于其他给药方式,口服药物服用方便,患者依从性高,是目前使用最广泛的给药途径。但胰岛素在经过胃肠道的“三座大山”——化学屏障、酶屏障和渗透屏障时,或因低pH致使结构变性而失活,或被酶降解,或因黏膜阻碍而吸收效率低下,最终导致口服生物利用度极低。
哈佛大学Omid C.Farokhzad团队将免疫球蛋白G抗体的Fc段修饰于负载胰岛素的纳米颗粒表面,利用肠道上皮细胞上的新生儿Fc受体(FeRn)介导纳米颗粒,有效穿过肠道屏障进入血液循环,显著提高了口服生物利用度。
此外,韦恩州立大学曹智强团队发现两性离子胶束能够同时突破粘液和上皮屏障,显著增强蛋白质的跨膜转运。为此,曹智强团队使用了两性离子胶束负载胰岛素,并将其冻干粉末封装于肠溶胶囊中,可大幅增强胰岛素的口服吸收。
Robert Langer团队受到豹龟自我定位能力的启发,开发了一种可装载于口服胶囊中的自定向注射器。当胶囊到达胃部后,注射器中的弹簧可将压缩胰岛素制成的针注射到胃壁,使胰岛素跨过物理屏障促进其吸收,与皮下注射具有相当的血糖水平调节。
为了使口服胰岛素实现在餐后的血糖刺激性释放,顾臻团队利用苯硼酸接枝的透明质酸包裹负载胰岛素的Fc受体,靶向脂质体以防止胰岛素在胃肠道的暴露。在餐后,肠道内葡萄糖浓度快速升高,使得透明质酸外壳脱落,暴露的Fc基团与小肠上皮的FcRn特异性结合,加速胰岛素吸收。尽管相关研究成果频出,但目前口服胰岛素研究仍处于早期阶段,其最终应用转化以惠及广大患者仍面临众多挑战。
细胞疗法捷报频传
胰岛细胞疗法可以通过移植胰岛细胞,补充患者体内缺乏的胰岛素和其他激素,增强血糖控制并减少低血糖发作。美国CellTrans公司开发用于治疗l型糖尿病的胰岛细胞疗法Lantidra已于2023年获批上市。该方法从逝者中获得同种异体胰岛细胞,通过肝门静脉单次输注给糖尿病患者以帮助其分泌胰岛素。临床研究结果表明,部分1型糖尿病患者经输注后在1至5年不再需要胰岛素治疗。
北京大学邓宏魁团队也建立了一种安全、简单、易于调控的人多能干细胞制备技术,可将人成体细胞诱导为多能干细胞,随后进一步定向诱导分化为胰岛细胞,所获得的胰岛与人胰岛细胞相似,并具有双相胰岛素分泌功能。基于此,邓宏魁团队和中国医学科学院/北京协和医学院彭小忠团队联合开发了一种全新的胰岛移植策略——腹直肌前鞘下移植。该策略可以使人多能干细胞诱导的胰岛细胞在移植后存活并逐渐成熟,改善灵长类动物糖尿病的血糖控制。
目前,利用合成生物学原理改造细胞并移植到患者体内的细胞治疗方法,也开始应用于糖尿病治疗研究。为细胞设计胰岛素表达调控开关,再将T程化细胞移植到患者体内,这就相当于为病人安装了新的“胰岛”,使得病人可以通过口服小分子药物来开启开关,从而产生所需的胰岛素。北京大学刘涛团队“引设计了基于翻译水平的控制开关,称为非天然氨基酸触发治疗开关。该系统在胰岛素基因上引入蛋白翻译过程的终止密码子,在没有非天然氨基酸启动信号的情况下,只能生成无功能的短肽链产物,而只有在口服非天然氨基酸时,才能翻译产生完整的胰岛素(如图4所示)。在将非天然氨基酸调控的细胞治疗系统植入糖尿病小鼠后,口服非天然氨基酸可在90min内显著降低血糖。研究人员将非天然氨基酸与小鼠饲料混合制作了“控糖饼干”,代替普通饲料喂食糖尿病小鼠,可以实现长达1个月的胰岛素表达和血糖控制。
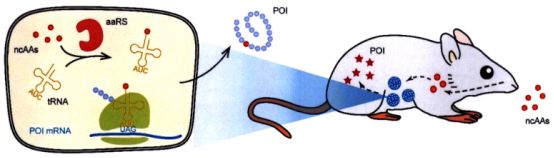
图4 非天然氨基酸“饼干”控制血糖水平”
胰岛素未来研发满怀信心
目前口服胰岛素、葡萄糖响应性注射胰岛素、智能胰岛素贴片和细胞疗法等新药物、新制剂和新器件不断涌现,给“糖友”带来曙光,但仍存在众多关键问题亟待解决,如不同种属之间、体内外之间相关性有待明确等。此外,以上胰岛素递送的新技术进人人体临床试验的屈指而数,美国默沙东公司的葡萄糖响应性胰岛素类似物(MK-2640)和丹麦诺和诺德公司的口服胰岛素的临床试验并不顺利。
尽管如此,基于过去100年胰岛素研发的蓬勃发展,伴随多学科的交叉融合,我们对下一个百年的进展与突破满怀信心,胰岛素新疗法将变得更高效、更安全、更智能。
相关知识
治疗糖尿病,在“打胰岛素”和“吃降糖药”之间,该如何选?
最全胰岛素治疗方案调整技巧!
1型糖尿病有望摆脱胰岛素注射治疗
我国科学家重大突破:治疗糖尿病,有望不打胰岛素
代糖降低胰岛素敏感
胰岛素行业发展现状分析:胰岛素行业市场迎新格局
胰岛素个体化治疗
“胰岛素抵抗”怎么看?需不需要治疗,什么降糖药比较好?
糖尿病人有6大表现:说明胰岛素抵抗了,三个策略增强胰岛敏感性
糖尿病七年胰岛素治疗,消瘦便秘
网址: 降糖之“艺”:胰岛素治疗新技术不断涌现 https://m.trfsz.com/newsview1333020.html