Cell:厦门大学周大旺/陈兰芬团队揭示糖原累积与相分离驱动肝癌起始的重要机制
自世界卫生组织提出癌症的早发现、早诊断、早治疗策略以来,癌症的筛查与早诊,已被公认为癌症防控最为有效的手段。因此,发现与鉴定癌症早期事件具有十分重要的科学意义与临床价值。
 自世界卫生组织提出癌症的早发现、早诊断、早治疗策略以来,癌症的筛查与早诊,已被公认为癌症防控最为有效的手段。因此,发现与鉴定癌症早期事件具有十分重要的科学意义与临床价值。
自世界卫生组织提出癌症的早发现、早诊断、早治疗策略以来,癌症的筛查与早诊,已被公认为癌症防控最为有效的手段。因此,发现与鉴定癌症早期事件具有十分重要的科学意义与临床价值。 2021年10月21日,细胞应激生物学国家重点实验室、细胞协同创新中心、厦门大学生命科学学院 周大旺 教授团队与陈兰芬教授团队合作,在国际顶尖学术期刊 Cell 发表了题为: Glycogen accumulation and phase separation drives liver tumor initiation 的研究论文。该研究 首次发现肿瘤起始的代谢重编程主要是癌细胞汲取葡萄糖后以糖原的方式作为能量在胞内存储起来而不是直接代谢分解葡萄糖,而累积的糖原会通过液-液相分离抑制Hippo信号通路,激活下游原癌蛋白YAP,从而驱动肿瘤的起始 。该发现改变了对肿瘤代谢已有的认知——肿瘤细胞将大量汲取的葡萄糖用于无氧糖酵解,代谢分解葡萄糖提供能量和物质原料用于细胞的增殖,同时也回答了重要抑癌信号通路Hippo通路在肿瘤发生中如何失活这一困扰领域的重要科学问题。厦门大学生命科学学院博士生刘清许、李佳薪、张炜极、肖琛及博士后张世浩 (目前为安徽医科大学教授) 为该论文的共同第一作者,通讯作者为周大旺与陈兰芬教授。
 在这项工作中,作者通过分析小鼠的多种肝癌诱导模型及人类的肝癌样本,发现早期癌变但尚未快速增长的癌细胞汲取葡萄糖后,可能更多是将葡萄糖以糖原的方式作为能量在胞内存储起来。因此,在肝癌发生的前期阶段,存在明显的糖原累积的现象,最后随着肝癌的发展进程,累积在细胞内的糖原逐渐被消耗殆尽 (图一) 。为了探究这个过程中造成糖原累积的机制,作者利用显微切割技术结合RNA-Seq测序,对比分析早期肝癌样品中的糖原累积区域和正常组织,发现糖酵解的关键代谢酶G6pc (葡萄糖-6-磷酸酶) 在癌前病变区域 (糖原累积区域) 表达明显下降,这可能是糖原累积的重要因素。
在这项工作中,作者通过分析小鼠的多种肝癌诱导模型及人类的肝癌样本,发现早期癌变但尚未快速增长的癌细胞汲取葡萄糖后,可能更多是将葡萄糖以糖原的方式作为能量在胞内存储起来。因此,在肝癌发生的前期阶段,存在明显的糖原累积的现象,最后随着肝癌的发展进程,累积在细胞内的糖原逐渐被消耗殆尽 (图一) 。为了探究这个过程中造成糖原累积的机制,作者利用显微切割技术结合RNA-Seq测序,对比分析早期肝癌样品中的糖原累积区域和正常组织,发现糖酵解的关键代谢酶G6pc (葡萄糖-6-磷酸酶) 在癌前病变区域 (糖原累积区域) 表达明显下降,这可能是糖原累积的重要因素。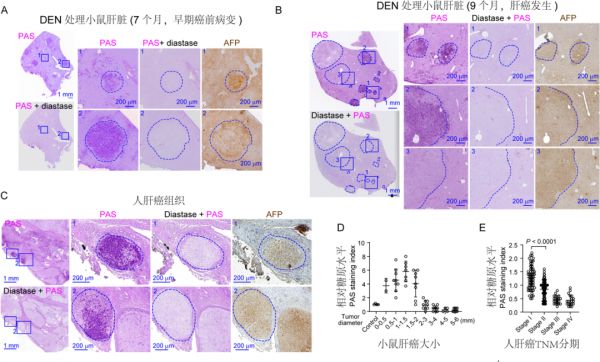 图一:肝脏早期肿瘤病灶及小肿瘤中糖原过度累积
图一:肝脏早期肿瘤病灶及小肿瘤中糖原过度累积 糖原是人体内葡萄糖的储存形式,是由大量单糖分子聚合形成的细胞内最大可溶的超大分子。临床上糖原分解各类酶包括G6PC、PYGL等的基因失活突变均导致糖原累积症 (glycogen storage disease,GSD) ,临床表型为巨肝症,多数患病者年幼夭折,生存下来的患者后期往往发展成为肝癌。周大旺教授团队前期的工作发现Hippo信号通路的失活能导致肝脏组织快速增生,3个月内肝脏增大10-15倍,4-5个月内100%产生肝癌。近年研究表明各类肿瘤发生发展中往往伴随着抑制细胞癌变的Hippo通路的失活,但具体失活机制仍不清楚。作者构建了肝脏特异性敲除G6pc的小鼠模型并观察到小鼠肝脏中糖原累积,肝脏异常变大和后期的肿瘤发生。有趣的是,在糖原累积的早期小鼠或人肝癌组织内,Hippo通路的关键激酶Mst1/2与糖原共定位呈现出明显的聚点形态,而在正常的小鼠或人的肝脏组织中并没有观察到这一现象 (图二) 。
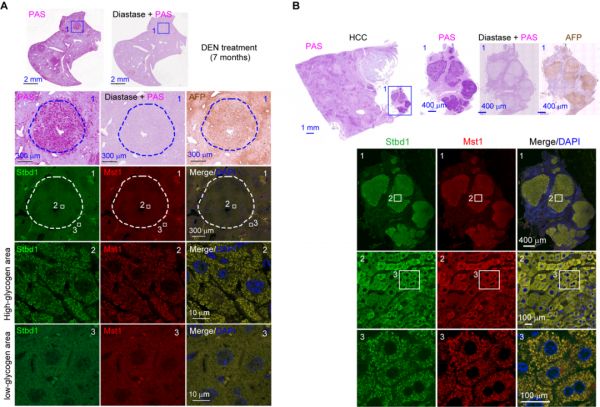 图二:激酶Mst1/2与糖原在小鼠(A)与人(B)早期肝癌组织中以聚点形态共定位
图二:激酶Mst1/2与糖原在小鼠(A)与人(B)早期肝癌组织中以聚点形态共定位 作者在后续研究中发现累积的糖原在体内与体外条件下都会自发地形成液-液相分离,并且糖原能够通过糖原结合蛋白Laforin与Mst1/2相互作用,将部分Mst1/2包裹进糖原液滴中并以此来抑制Hippo信号通路的活性 (图三) 。这是首次发现糖原这一大分子代谢物能够发生液-液相分离,并以此来调节机体稳态。
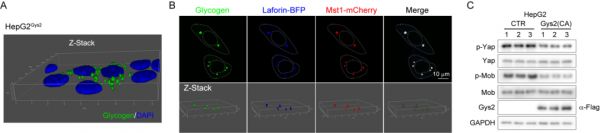 图三:累积的糖原发生液-液相分离抑制Hippo信号通路活性
图三:累积的糖原发生液-液相分离抑制Hippo信号通路活性 研究人员介绍,本项工作的发现改变了人们对于肿瘤代谢重编程已有的认知。同时,该研究系统地展示了糖原除了作为营养能量储存功能外,还会发生液-液相分离,从而抑制抑癌信号,促进肿瘤发生 (图四) 。本项工作可以为相分离领域在生理与病理条件下的研究提供更好范本,也为针对糖原累积开发肿瘤的早期诊断方法提供了理论依据。
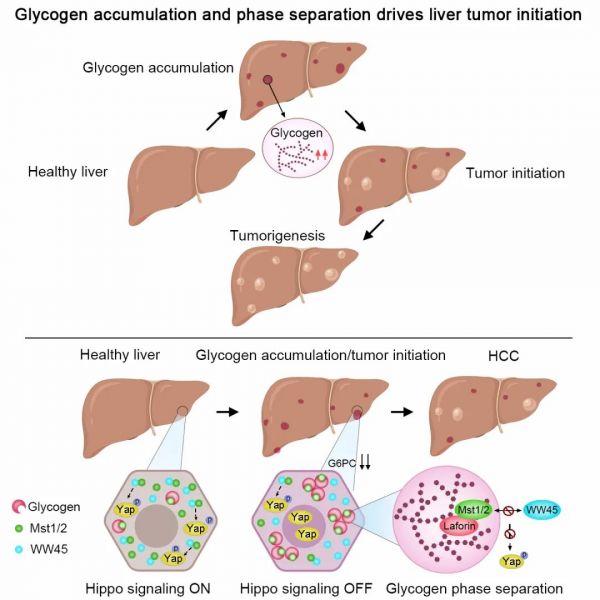 图四:糖原累积和相分离驱动肝脏肿瘤的发生和发展该研究得到国家重点研发计划、国家自然科学基金、高等学校学科创新引智计划及厦门大学中央高校基本科研基金的支持和资助。研究还得到福建医科大学吴孟超肝胆医院刘小龙教授、海军军医大学东方肝胆医院丁劲教授和华侨大学柯荣秦教授等课题组的支持。本工作的第一作者刘清许同学因白血病不幸于2020年6月11日离世,他生前向红十字会登记将自己的遗体捐献给厦门大学医学院用于教学与科研工作。本项研究工作起始与多个重要发现均由刘清许同学承担完成,向刘清许同学致敬。论文链接: https://doi.org/10.1016/j.cell.2021.10.001
图四:糖原累积和相分离驱动肝脏肿瘤的发生和发展该研究得到国家重点研发计划、国家自然科学基金、高等学校学科创新引智计划及厦门大学中央高校基本科研基金的支持和资助。研究还得到福建医科大学吴孟超肝胆医院刘小龙教授、海军军医大学东方肝胆医院丁劲教授和华侨大学柯荣秦教授等课题组的支持。本工作的第一作者刘清许同学因白血病不幸于2020年6月11日离世,他生前向红十字会登记将自己的遗体捐献给厦门大学医学院用于教学与科研工作。本项研究工作起始与多个重要发现均由刘清许同学承担完成,向刘清许同学致敬。论文链接: https://doi.org/10.1016/j.cell.2021.10.001本文由“健康号”用户上传、授权发布,以上内容(含文字、图片、视频)不代表健康界立场。“健康号”系信息发布平台,仅提供信息存储服务,如有转载、侵权等任何问题,请联系健康界(jkh@hmkx.cn)处理。
相关知识
Cell论文揭示精氨酸驱动代谢重编程促进肝癌生长
北京大学强力/汪丽恒团队揭示肥胖中IgG积累驱动胰岛素抵抗和慢性炎症
癌症是一种代谢疾病:Cell论文揭示精氨酸驱动代谢重编程促进肝癌生长
四川大学华西医院邓洪新团队发布驱动结直肠癌新机制
为阿尔茨海默病防治提供新策略:厦门大学张杰团队揭示小胶质细胞糖脂代谢调控新机制
Cell子刊:林慧观团队揭示葡萄糖致癌的直接作用靶点
浙江大学张龙团队揭示乳酸感知与乳酸化修饰的分子机制
Cell子刊:上海交通大学研究团队揭示癌痛调控肿瘤进展新机制
Cell:清华大学研究团队发现,“睡眠不足免疫崩溃”的新机制
治疗MASH新策略!Cell Metabolism揭示降糖药改善代谢功能障碍相关脂肪性肝炎的机制
网址: Cell:厦门大学周大旺/陈兰芬团队揭示糖原累积与相分离驱动肝癌起始的重要机制 https://m.trfsz.com/newsview1810100.html