膳食草酸盐和草酸盐前体对尿草酸盐排泄的贡献
肾结石疾病的患病率越来越高,最常见的结石成分是草酸钙。膳食草酸盐摄入和草酸盐的内源性产生在草酸钙结石病的病理生理学中很重要。饮食草酸盐摄入量对尿草酸盐排泄和肾结石疾病风险的影响已通过大型队列研究以及小型饮食控制研究进行了评估。净胃肠道草酸盐吸收影响尿草酸盐排泄。肠道微生物组中的草酸盐降解细菌,尤其是Oxalobacter formigenes,可通过减少净草酸盐吸收来降低结石风险。抗坏血酸(维生素 C)是内源性草酸盐产生的主要膳食前体,其他几种化合物的作用较小。草酸盐的肾脏处理以及潜在的草酸盐的肾脏合成可能有助于结石形成。在这篇综述中,我们讨论了膳食草酸盐和草酸盐的前体、它们在人体中的相关生理学,以及它们在肾结石疾病中的作用。
一、简介
肾结石疾病影响大约 10% 的人口 [ 1 ],而草酸钙 (CaOx) 是最常见的结石成分 [ 2 ]。尿液中 CaOx 过饱和会显着增加结石形成的风险 [ 3 ],而过饱和是 CaOx 晶体沉淀的驱动力 [ 4 ]。尿草酸盐对 CaOx 过饱和度的贡献是显着的。例如,在一项研究中,与尿钙的变化相比,CaOx 的过饱和度对尿草酸盐变化的敏感性高达 23 倍 [ 5 ]。在随后的研究中,发现尿钙和尿草酸盐对 CaOx 过饱和的贡献相同 [ 6]. 尿草酸盐来源于膳食草酸盐摄入和内源性草酸盐合成 [ 7 ]。饮食来源的部分主要取决于三个因素:消耗的草酸盐量、消耗的钙和其他二价阳离子的量以及肠道对草酸盐的处理。由于肠道细菌对一些摄入的草酸盐进行降解 [ 8 ] 以及肠道不同区域对草酸盐的吸收存在差异 [ 9 ],这进一步复杂化。内源性草酸盐的产生主要发生在肝脏中,并受膳食摄入前体的影响,尤其是抗坏血酸 (AA) [ 10 ]。随后的肾脏处理 [ 11] 并且,肾脏的内源性合成可能是尿草酸盐池的最终决定因素。在本文中,我们回顾了膳食草酸盐和草酸盐前体的来源、它们对尿液草酸盐池的影响以及它们对肾结石风险的影响。
2. 膳食草酸盐摄入量和尿草酸盐排泄
几种方法已被用于评估膳食草酸盐及其对尿草酸盐和肾结石疾病的影响。其中包括来自大型流行病学研究的食物频率问卷 (FFQ)。虽然其中一些研究是本综述的核心(表格1A), FFQ 对膳食草酸盐有特殊限制。虽然规模较小,但涉及受控饮食受试者的研究提供了对影响尿草酸盐排泄的因素的严格调节(表格1B).
2.1. 量化草酸盐消耗
主要通过使用 FFQ 对大量人群中消耗的草酸盐量进行了估计。该工具对于确定膳食钙在 CaOx 结石形成中的关键作用至关重要 [ 32 ]。这种作用的主要机制被认为是钙与草酸盐的结合限制了肠道草酸盐的吸收 [ 33 ]。然而,通过类似的方法,膳食草酸盐与肾结石疾病之间的关系不太明显 [ 12]。此外,基于 FFQ 的草酸盐消耗量最高和最低四分位数之间的尿草酸盐差异很小,为 1.7 毫克/天 [ 13 ]。这些不一致有几个原因:
(1)按摩尔计算,草酸的每日摄入量远低于钙,约为十分之一(2.5 毫摩尔对 25 毫摩尔);
(2)摄入的结合草酸盐量高于结合钙;
(3)由于植物和植物性食品中草酸盐的可变性,摄入的草酸盐量可能难以确定。这些差异可能是由于生长条件、遗传差异和草酸盐分析中的分析变异性所致 [ 34 ];
(4)FFQ 容易出错,当针对单一营养素时,应通过与另一种技术(例如称重的 3-4 天食物记录)进行比较来验证它们 [ 35 ]。
由于这些影响因素的多样性,似乎验证 FFQ 在确定草酸盐消耗量方面的准确性可能是一项徒劳无功的任务,即使不是不可能的任务。利用受控饮食条件的研究克服了 FFQ 在草酸盐摄入方面的许多局限性。
2.2. 膳食草酸盐与尿草酸盐的关系
已经在健康的人类受试者中进行了几项研究,这些研究使用严格控制其营养含量的饮食来解决膳食草酸盐与其尿液排泄之间的关系。在一项研究中,膳食草酸盐对尿草酸盐的平均贡献范围为 25%(每天 10 毫克膳食草酸盐)至 42%(每天 250 毫克膳食草酸盐);当 250 毫克草酸盐/天饮食的钙含量从 1002 毫克减少到 391 毫克时,平均贡献增加到 53% [ 7 ]。进一步的分析表明,在规定的饮食条件下(包括 1000 毫克/天的钙摄入量),在每天摄入 50-750 毫克的草酸盐范围内,尿草酸盐排泄量呈线性增加 [36 ]]. 重要的是要注意,自选饮食中的饮食草酸盐摄入量可能相差超过 200 毫克/天 [ 37 ],在没有饮食控制的情况下会导致草酸盐排泄的显着变化。我们之前曾提倡,在适当的时候减少或消除饮食中富含草酸盐的食物,应该有利于减少饮食对尿草酸盐排泄的贡献 [ 38 ]。
3. 膳食草酸盐和肠道
胃肠道草酸盐吸收受这种二羧酸的吸收和分泌通量的影响。粪便微生物组中的草酸盐降解生物体(包括产甲酸草酸杆菌)对这些过程的影响是一个活跃的研究领域。
3.1. 膳食草酸盐的肠道吸收
草酸盐通过跨细胞阴离子转运蛋白沿肠道吸收,特别是溶质连接载体 (SLC)-26 家族,以及通过紧密连接的细胞旁通量 [ 9、39 ]。被肠道吸收的摄入草酸盐量似乎在 5% 到 15% 之间,具体取决于钙、镁和纤维的摄入量 [15 ]。草酸盐的过度吸收与肠段手术切除有关,包括减肥旁路手术和吸收不良性肠道疾病。这种继发性高草酸尿症,称为肠道高草酸尿症(综述于 [ 40]),这归因于游离脂肪吸收不良导致钙螯合和皂化导致可吸收的可溶性草酸盐量增加,以及胆汁酸量增加,再次由于吸收不良,这是被认为可以增加胃肠道对草酸盐的吸收。
3.2. 肠道微生物草酸盐降解
哺乳动物体内不具有能够代谢草酸盐的酶。然而,胃肠道中的多种细菌具有降解草酸盐的能力,因此可以推测这些肠道微生物在降低钙石病风险方面发挥着重要作用。胃肠道中有两大类草酸盐降解细菌。有不完全依赖草酸作为能源的“通才草酸菌”,以及使用草酸作为其唯一或主要碳源和能源的“专业草酸菌”[41 ]。迄今为止,在哺乳动物肠道中只发现了一种专门的草酸营养菌,即专性厌氧菌O. formigenes ]. 大多数研究都集中在这种细菌上 ,只有少数研究涉及一般的草酸营养菌对结石病的作用。
一些研究已经检验了益生菌制剂的影响,这些益生菌制剂旨在降解胃肠道草酸盐以减少尿液中草酸盐的排泄,包括那些含有 O. formigenes、乳酸杆菌和/或双歧杆菌属的制剂。[ 23 , 52 , 53 , 54]。尽管这些试验未显示对尿液草酸盐排泄有显着影响,但尚不清楚这些试验中摄入的细菌是否保持活力。使用草酸脱羧酶的口服制剂在整个胃肠道中酶促降解草酸盐是最近的潜在治疗策略 [ 55]. 一项 2 期开放标签试验发现,在患有特发性 (-10.2 mg) 和肠道高草酸尿症 (-22.0 mg) 的参与者中,给予草酸脱羧酶可显着减少 24 小时尿液中草酸盐的排泄 [56 ]。仅在一项针对健康非结石形成者的研究中检验了通才草酸营养菌和O. formigenes对肠道草酸盐降解的相对作用 [ 25 ]。这项研究使用了控制营养素(包括草酸盐)的饮食,并证明了未被O. formigenes定殖的个体的微生物组的草酸盐降解能力在低膳食草酸盐摄入量下可忽略不计,并且随着摄入较高水平的膳食草酸盐而增加。这与反刍动物早期膳食草酸盐喂养研究一致 [ 57 ]。这项研究还发现,与未被O. formigenes定植的个体相比,被O. formigenes定植的个体排泄的粪便草酸盐水平显着降低,突出了专业草酸营养素对整体肠道草酸盐降解的重要性。例如,在膳食草酸盐摄入量适中(每天 250 毫克)时,80% 的膳食草酸盐在未定植O. formigenes 的个体的粪便中回收,而仅 30% 在定植为O. formigenes。
需要在结石形成者中进行类似的对照饮食研究,以确定通才草酸营养菌和O. formigenes对肠道草酸盐降解的相对作用,以及这些微生物在肠道的定植如何影响尿液草酸盐排泄和结石形成风险。未来的研究利用最先进的测序技术 [ 58 ] 可能会导致识别微生物网络,这些微生物网络在增强人体胃肠道中的草酸盐降解方面起着重要作用。此外,由于口服抗生素的使用和年轻时接触抗生素与结石形成风险增加有关 [ 59],未来的研究还应侧重于确定抗生素暴露增加结石病风险的机制,包括抗生素治疗对微生物草酸盐降解的影响。
4. 内源性草酸盐生产的前体
60 多年前,通过对罕见的遗传性肾结石/肾钙质沉着症生成疾病原发性高草酸尿症 (PH) 的研究,初步了解了内源性草酸盐合成。在大鼠、健康志愿者和 PH 患者中使用14 C 和13 C 标记的化合物进行的研究有助于确定肝脏在草酸盐生成中的重要性以及确定草酸盐合成的前体(图1). 在离体大鼠肝脏和肝切除大鼠中进行的研究证明了肝脏在草酸盐合成中的核心作用 [ 60 , 61 ]。其他组织(如肾脏)的作用尚未完全阐明。在肝脏中,乙醛酸盐已被确定为草酸盐的直接前体,而乳酸脱氢酶是将乙醛酸盐氧化为草酸盐的关键酶[ 62、63、64、65 ]。进一步支持肝脏在乙醛酸到草酸代谢中的核心作用,PH中的酶缺陷与乙醛酸代谢有关,并且在肝脏中高度甚至完全表达[ 66、67、68, 69 , 70 ]。因此,对草酸盐合成前体的研究是由涉及乙醛酸盐代谢的途径驱动的 [ 71 , 72 ]。一个显着的例外是 AA,它长期以来一直被认为是草酸盐合成的非酶促来源 [ 73、74 ]。
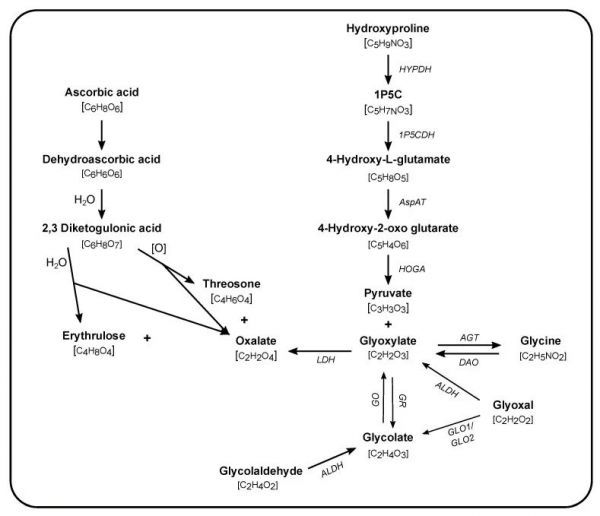
图1内源性草酸盐合成途径。
草酸盐的合成通过发生在不同亚细胞区室(胞质溶胶、线粒体和过氧化物酶体)中的酶促反应(名称以斜体显示)和非酶促反应发生。分子式在每种化合物下方的括号中给出。乙醇醛是果糖和木糖醇代谢的产物。1P5C:1-吡咯啉-3-羟基-5-羧酸,LDH:乳酸脱氢酶,GO:乙醇酸氧化酶,GR:乙醛酸还原酶,AGT:丙氨酸:乙醛酸氨基转移酶,DAO:D-氨基氧化酶,ALDH:醛脱氢酶,GLO :乙二醛酶,HOGA:4-羟基-2-酮戊二酸醛缩酶,AspAT:天冬氨酸转氨酶,1P5CDH:1P5C 脱氢酶,HYPDH:4-羟脯氨酸脱氢酶。
4.1. 氨基酸和蛋白质
在已研究的草酸盐前体中,提出了许多氨基酸(甘氨酸、丝氨酸、酪氨酸、色氨酸、苯丙氨酸和羟脯氨酸),但只有少数在人体中进行了评估和验证,饮食控制的情况更少 [ 60、75、76、77、78 ] 。甘氨酸在草酸盐合成中的作用最初被认为是主要作用,在较早的研究中估计其对草酸盐合成的贡献高达 40% [79 , 80 , 81 ]。然而,一项针对 6 名健康志愿者的研究使用了改进的分析方法,包括饮食控制和准备好的持续输注13C-甘氨酸表明,甘氨酸代谢对尿草酸盐的贡献小于 5% [ 26 ]。羟脯氨酸是胶原蛋白分解的产物,当以明胶的形式口服摄入时,健康志愿者会转化为草酸盐 [ 19 ]。这项研究促进了对羟脯氨酸分解代谢为草酸盐的更定量检查,使用受控饮食的健康志愿者和患有 PH 的受试者持续输注15 N,13 C 5 -羟脯氨酸 [ 30 ]。这项研究表明,羟脯氨酸的代谢促成了健康受试者至少 15% 的内源性草酸盐合成,并且在 PH 患者中发挥了更大的作用,尤其是 PH 2 型和 3 型。
4.2. 乙醛酸盐的其他来源
乙醇酸盐是乙醛酸盐的前体,是 1型PH 中草酸盐合成的主要来源。60多年来,通过对人类和啮齿动物的大量研究,已经确定了其代谢为乙醛酸盐的过程[ 60、61、63、71、82 ]。通过 RNA 干扰或 CRISPR/Cas9 靶向甘醇酸氧化酶 (GO) 抑制甘醇酸氧化为乙醛酸已显示可有效减少缺乏丙氨酸:乙醛酸氨基转移酶 (AGT) 的小鼠的尿液草酸排泄,AGT 是一种 PH 型模型[ 83、84 ] , 85]. GO 在 1 型 PH 中增强草酸盐合成的核心作用源于 AGT 的缺乏;然而,在具有正常 AGT 活性的健康志愿者中,乙醇酸盐作为草酸盐前体的作用尚不清楚。乙二醛是一种双碳反应性二醛,通过许多氧化和代谢反应产生 [ 86 ],并且可以通过酶促转化为乙醛酸 [ 87 ] 和乙醇酸 [ 88 ]。在一项利用人类红细胞的研究中,乙二醛被证明最好转化为乙醇酸,其中 1% 最终通过乙醛酸转化为草酸 [ 89]]. 当细胞内谷胱甘肽耗尽时,草酸盐的形成增加,突出了氧化应激通过该途径在内源性草酸盐合成中的潜在作用。乙二醛存在于大量食品和饮料中,例如面包、饼干、酸奶、沙丁鱼油、咖啡、茶、啤酒和葡萄酒,并且是一种食品加工污染物[ 90、91、92、93、94、95 ]; 然而,关于这些膳食来源的乙二醛的肠道吸收一无所知。乙二醛在体内的反应性也使其成为一个难以研究的目标,其在内源性草酸盐合成中的作用仍不清楚。
4.3. 果糖、葡萄糖和戊糖
果糖摄入量与肾结石形成之间关联的流行病学证据 [ 96、97 ] 支持这样的假设,即摄入果糖可直接或间接通过丝氨酸代谢导致草酸盐合成[ 77 ]。然而,一项针对健康志愿者的对照饮食研究发现,喂食增加的果糖(4-21% 的卡路里)未能证明尿液中草酸盐排泄的变化 [ 22 ]。此外,肝细胞体外实验未显示13 C 标记的糖(果糖和葡萄糖)向草酸盐的任何转化 [ 22]]. 报告的果糖摄入量与肾结石疾病的相关性可以用肥胖和胰岛素抵抗等混杂因素来解释 [ 98 , 99 ]。戊糖途径和木酮糖已被提议作为草酸盐合成的来源,通过乙醇醛和乙醇酸盐合成 [ 77 ]。尽管有摄入木糖醇后出现草酸血症的病例报告,但体外实验 [ 100 ] 不支持木糖醇是草酸盐的重要来源,因此仍不清楚摄入木糖醇是否是尿液草酸盐排泄增加的危险因素。
4.4. 抗坏血酸
自 20 世纪中叶以来,AA 与草酸盐合成之间的关系就已为人所知。草酸盐的形成是 AA 非酶促分解为 2,3-二酮古洛糖酸 (DKG) 的结果(图1). DKG 可分解为苏糖酮或赤藓酮糖,在这两种情况下都伴有草酸盐。转换对 pH 和温度敏感,这是一个可能影响某些富含 AA 的生物样品中草酸盐测量的因素。阿特金斯等人的研究。和贝克等人。表明 AA 可能是内源性草酸盐合成的最大贡献者 [ 81 , 101],约占尿草酸盐排泄的 40%。当时使用的方法有局限性,因此需要重新研究 AA 在内源性草酸盐合成中的作用。AA 摄入量与肾结石风险之间的关联已在几项大型队列研究中得到证实,尽管缺乏饮食控制、研究持续时间短以及潜在的样本处理问题可能会影响结果[13、102 ]。据报道,摄入 AA 可更大程度地促进肾结石形成者的草酸盐排泄 [ 13 ]。尽管一项在饮食控制条件下进行的研究发现,肾结石形成者和健康对照者都因口服 AA 补充剂而增加了尿液草酸盐 [17 ]。一些病例报告还表明,肾功能受损的个体在大剂量口服或静脉输注 AA 后可能会发展为草酸盐肾病[ 103、104、105 ]。尽管 AA 对健康受试者和肾结石患者的草酸盐合成都很重要,但我们对所涉及机制的了解仍然存在差距。线粒体被认为是细胞内 AA 循环的主要场所,并且是内源性抗氧化防御的主要组成部分 [ 106]]. AA 可能在产生草酸盐的线粒体中充当抗氧化剂。有必要研究该途径在草酸盐合成中的重要性,并可能确定减少草酸盐合成的新方法。
5. 草酸盐和肾脏
草酸盐是人体新陈代谢的最终产物。在健康受试者中,大约 95% 的草酸盐被肠道吸收并内源性产生,并随尿液排出 [ 107 ]。草酸盐通过肾小球滤过和分泌被输送到肾单位 [ 108、109 ]。虽然草酸盐重吸收已在大鼠近端小管中得到证实 [ 110 ],但这在人类中尚未得到表征。在受控饮食的健康志愿者中口服单剂量草酸钠显示出快速吸收和净肾分泌,尿液和血浆草酸盐短暂升高 [11 ]]. 后来的一项评估口服草酸盐负荷后草酸盐排泄的研究表明,尿草酸盐排泄或草酸盐与肌酐清除率的比率在正常受试者和肾结石形成者之间没有差异 [20 ]。然而,Bergsland 等人。发现患有特发性高钙尿症或接受过减肥手术的结石形成患者与控制饮食的正常对照组相比,尿液草酸盐的增加明显更快,并且草酸盐的肾小管分泌是一个关键的介质,可能会保持对血浆草酸盐的严格调节[ 24]. 除了排泄草酸盐外,还有一些证据表明肾脏可能在草酸盐合成中发挥作用。乙醛酸还原酶 (GR) 和 4-羟脯氨酸脱氢酶 (HYPDH) 均在肾脏中高度表达。在大鼠中,近端小管已被证明是这些酶高度表达的肾单位部分[ 111、112、113、114 ] 。Farinelli 和 Richardson 在肝切除大鼠中进行的实验表明,某些乙醇酸盐代谢为草酸盐可能通过未知机制在肾脏中发生 [ 61]]. 对 GR 缺陷小鼠(一种 PH2 模型)进行的一项研究表明,由于肾脏草酸盐合成增加,饮食喂养羟脯氨酸会迅速诱发 CaOx 肾钙质沉着症 [115 ]。鉴于这些发现,未来的研究应检查肾脏草酸盐合成和肾脏草酸盐处理在尿草酸盐排泄中的作用。
6。结论
膳食草酸盐和膳食草酸盐前体的摄入量是尿草酸盐排泄和氧化钙结石病的关键决定因素。通过 FFQ 对大量人群的膳食草酸盐摄入量进行量化有很大的局限性,可以通过严格的饮食控制研究来克服这些局限性。通过此类研究,已确定膳食草酸盐摄入量平均占正常健康受试者尿液草酸盐排泄量的 50%。降解草酸盐的肠道微生物在 CaOx 肾结石病中的作用尚不清楚,需要通过控制饮食进行进一步研究。AA 已被确定为主要的膳食草酸盐前体,而其他假定的前体似乎具有较小的作用。然而,大多数这些研究的局限性在于它们仅在健康志愿者中进行。
Crivelli JJ, Mitchell T, Knight J, Wood KD, Assimos DG, Holmes RP, Fargue S. Contribution of Dietary Oxalate and Oxalate Precursors to Urinary Oxalate Excretion. Nutrients. 2020 Dec 28;13(1):62. doi: 10.3390/nu13010062. PMID: 33379176; PMCID: PMC7823532.
本文由“健康号”用户上传、授权发布,以上内容(含文字、图片、视频)不代表健康界立场。“健康号”系信息发布平台,仅提供信息存储服务,如有转载、侵权等任何问题,请联系健康界(jkh@hmkx.cn)处理。
相关知识
降低尿草酸盐排泄以减少草酸钙结石病
盐酸西布曲明
【盐城花草茶公司
尿酸高吃什么中草药
丁酸盐的健康益处和副作用
少盐从我做起,探索少盐的健康之道
鱼腥草的食疗药膳
植酸盐摄入量、健康和疾病:“让你的食物成为你的药物,药物成为你的食物”
尿石症的营养疗法 (9):肾结石患者的饮食评估
盐酸西布曲明片
网址: 膳食草酸盐和草酸盐前体对尿草酸盐排泄的贡献 https://m.trfsz.com/newsview716920.html