以下文章来源于老顽童说 ,作者老顽童说
老顽童说.
公众号致力于传播衰老相关的前沿科研进展和趣味科普,帮助大家更深入地了解衰老背后的科学故事~

关注我们,获取更多相关资讯
翻译 by 左越晟 王雪宝 张保虎 王敏
蜀道难,早梅悲,长路漫,且修远,上下求索终有时,拨开迷雾见明日。在人们追求长寿,延缓衰老的万里征途上,清除衰老细胞作为一种潜在策略被广泛关注。而在疾病发生发展过程中,衰老细胞也是“功劳”不小,这也使得靶向衰老细胞成为疾病治疗的可能策略,如最近有报道发现延缓衰老的干预策略在COVID-19治疗中具有潜在价值。今天小编就分享一篇康涅狄格大学老龄化研究中心Ming Xu博士及其合作者于2021年10月07日在Nature Aging上发表的 “Strategies for targeting senescent cells in human disease” 综述,为大家详述衰老细胞的特征和针对它们的靶向策略,关于清除衰老细胞的senolytics疗法在应对人类疾病的临床试验进展及其可能存在的问题。
摘 要
细胞衰老是一种独特的细胞命运,是细胞在应答一系列内在和外在的压力时出现的复制阻滞。细胞衰老不仅可以促进发育和伤口愈合进程,还能限制肿瘤的发生。但是,衰老细胞的病理性积累往往也与一系列疾病相关,包括年龄相关的器官疾病。衰老细胞通过产生旁分泌和内分泌信号引起局部组织功能紊乱并对全身产生有害反应。通过诱导凋亡来清除衰老细胞的药物或抑制衰老相关分泌表型的疗法来清除衰老细胞,这些策略在老年功能退行和慢性疾病的临床研究中取得了一定的疗效,这表明衰老细胞是延缓衰老进程的潜在药理学靶标。然而,衰老细胞群体在组成、功能和组织分布方面都具有异质性,甚至在不同物种之间也有差异,这也是目前临床试验中从实验室到正式临床应用过程中遇到的问题。在此,作者对衰老细胞的特点和靶向衰老细胞的策略(包括免疫学方法,以及关键的胞内信号通路)进行了总结回顾。此外,作者还调研列举了目前正在进行人体试验的senolytics,阐述了其作用机制、应用前景及其存在的问题。
正 文
实际年龄是全球范围内疾病和死亡的主要风险因素。通常情况下,生物学年龄与实际年龄是等同的;然而在多种慢性疾病和老年综合症的影响下,生物学年龄的增长会加快,这也是个体间的患病和死亡风险高低各有不同的由来。因此,现在有越来越多的科学工作者致力于从根源上了解和调节细胞衰老以减轻全球范围内的共发性疾病。细胞衰老作为慢性疾病与老年功能退行的一个基本驱动因素而愈发受到重视。尽管在体外培养细胞进行连续传代后发现细胞生长和分裂终止时,就已经发现细胞衰老了,但直到人们发现衰老细胞与许多增龄引起的跨器官系统的慢性疾病相关时,才开始关注到细胞衰老的影响。随着研究者对细胞衰老在病理学中作用的认识不断深入,对细胞衰老在基础生理学中的作用的理解也在不断发展。由于衰老研究中固有的二元性以及当前人们有限的认知,从研究衰老细胞的实验方法到将衰老细胞作为治疗靶标的研究,都引发了研究热潮和争议。
在此,作者调研了目前细胞衰老领域有关其异质性的研究,以阐释这一细胞命运在生理学和病理学方面的不同作用。作者首先探讨了细胞衰老的分子基础以强调目前如何根据其潜在的多样性来定义衰老细胞。其后,作者探索了衰老细胞分泌组如何进一步加剧细胞异质性。最后,作者总结了目前针对各种类型的衰老细胞的治疗方法和意义,以及目前针对senolytics研制的临床试验。
细胞衰老
尽管细胞衰老在健康和疾病中的作用存在着争议,但就其基本的定义,学界目前达成了一定程度上的共识。究其本源,细胞衰老代表了一种细胞命运,其在面对各种压力因素时表现为稳定的增殖阻滞,并常伴随产生一种被称为“衰老相关分泌表型”(senescence-associated secretory phenotype,SASP)的分泌组。相关的压力因素包括端粒缩短导致的复制压力、DNA损伤途径的激活、表观遗传学变化、氧化压力、线粒体功能障碍、辐射、肿瘤基因诱导以及机械和剪切压力,这些因素在先前的综述中都已被细致地总结过。在受到压力后,往往会因为细胞周期检查点阻断因子上调而导致DNA复制进程被阻滞。尽管这些细胞积累了大量的损伤但是其并不会发生凋亡,导致损伤积累的原因包括DNA断裂的发生、DNA损伤应答反应(DNA damage response,DDR)的增加,以及线粒体功能障碍和活性氧(reactive oxygen species,ROS)的增加。相反,这些衰老细胞通过衰老细胞抗凋亡通路(senescent cell anti-apoptotic pathways,SCAPs)使得促进生存的通路发生上调,而关键的凋亡调控因子则下调。除了其内部的稳态平衡发生紊乱外,衰老细胞还能通过SASP引发局部和全身的炎症以及组织损伤。
压力、衰老和随后的SASP信号和免疫激活对正常发育和健康至关重要。在发育的早期,具有衰老特征的细胞对体轴建立发挥着重要作用,相关的SASP通过巨噬细胞介导的清除来指导诸如肢芽等结构的生长。更进一步地,由于衰老细胞产生促进组织重塑和招募相关免疫组分的因子,因此受时空调控的细胞衰老对于维持伤口和器官修复等的再生过程中愈合和纤维化之间的平衡至关重要。有趣的是,衰老细胞还可以通过旁分泌机制促进邻近细胞的去分化和可塑性。此外,由于衰老细胞的炎症特性是在DNA损伤和致癌压力的诱导下发生的,因此其也可以作为一种肿瘤抑制机制,尽管这种炎症特性和DNA损伤的诱导在失调时也会导致患肿瘤风险的增加。
虽然研究者们对衰老细胞的有益作用很感兴趣,但大部分基于细胞衰老的研究都是针对它们在疾病中的作用,并强调其在老年功能退行中的作用。细胞衰老领域研究的热点浪潮是由以下发现推动的:细胞衰老的标志物随着衰老而积累,并且增加寿命和健康寿命的干预措施能够延缓积累,去除衰老细胞可增加早衰模型小鼠的健康寿命,而将少量衰老细胞移植到健康的动物身上会引发与老年动物类似的多系统功能障碍。更进一步的研究发现,人类衰老细胞的积累与疾病也具有相关性,并且可通过相关的临床干预手段减轻衰老细胞负担。基于以上发现,理解细胞衰老在疾病发病率和死亡率中的作用就显得至关重要。迄今为止,细胞的衰老已被认为与大多数器官系统的疾病相关联,其中不乏死亡率较高以及造成较高医疗系统负担的疾病,诸如心血管、肺、神经系统、肾、肝、肌肉骨骼和内分泌疾病等。
细胞衰老的分子基础及标志物
衰老作为一种细胞命运,常常被认为是一种压力应激反应。衰老与其他经适当有丝分裂剂诱导可进入增殖状态的非增殖性细胞的命运不同,后者可以分为静息状态和终末分化状态,处于终末分化状态的细胞通过特定的谱系发育以发挥特定的功能,并通过多种通路阻滞增殖。基于对端粒缩短或电离辐射等内部和外部因素的响应,衰老的细胞周期停滞信号主要集中在p53-Cdkn1a(p21)以及视网膜母细胞瘤(retinoblastoma,RB)-Cdkn2a(p16)通路。细胞周期蛋白依赖性激酶抑制剂(cyclin-dependent kinase inhibitors,CDKIs)p21或p16水平的增加可以促进G1/S细胞周期的阻滞,其主要通过抑制细胞周期蛋白-循环蛋白依赖性激酶复合物的形成以及不能灭活与转录抑制相关的RB来介导。尽管引起细胞衰老生长停滞的通路趋向一致,但新的观点更倾向认为不同的压力诱导因素会导致独特的衰老亚型。由于没有任何一个已知的标记物能以高灵敏度和特异性来定义细胞衰老,这也加剧了上述细胞衰老亚型的复杂性。目前惯用的做法是依靠表型和标志物的组合来表征细胞的衰老。例如,尽管p16和p21的积累在生物学上与衰老有关,而且它们被广泛地用作分子标记,但各种不同的体外压力源却能诱导这些CDKIs出现差异表达,甚至在同一细胞系内也没有例外,这表明p16和p21本身并不足以代表细胞的衰老。而当不同类型的细胞面对同一诱导性压力源时,其转录组也会发生不同的变化,这使得细胞衰老的亚型更加复杂化。与体外细胞培养模型的良好控制约束不同的是,多种压力源可以在体内同时作用于衰老和疾病。因此,研究者们推测,体内的细胞衰老亚型将会更加多样化。
除了p16和p21之外,其他一些标志物也可用于识别衰老的细胞,尽管每种标志物的特异性和敏感性各不相同(表1)。许多体外的形态学特征也能指征细胞衰老,并可通过明场显微镜等进行评估。与同类细胞相比,衰老细胞的大小增加,这可能反映了其代谢和细胞器稳态的改变。尤其是线粒体和溶酶体在细胞受到衰老诱导压力时都会积累。这些表型上的变化为检测衰老细胞提供了额外的手段和助力。衰老细胞中的溶酶体丰度是其中最常用的特征之一,这是由于溶酶体衰老相关的β-半乳糖苷酶(lysosomal senescence-associated beta-galactosidase,SA-β-gal)活性的测定相对快速而直接。然而,这种特异性的标志物也有其局限性,最好与其他标志物搭配使用。脂褐素是溶酶体副产物的聚集物,也在衰老细胞内积累,可以方便地进行检测,而这种检测在特异性方面与SA-β-gal检测有类似的限制。此外,衰老细胞中还出现线粒体丰度增加的现象,同时其膜电位发生改变,ROS、氧化磷酸化和氧消耗增加。因此,氧化还原状态、线粒体功能和线粒体生物合成等相关的检测也可用于衰老细胞表型的鉴定。
表1:细胞衰老标志物的选择
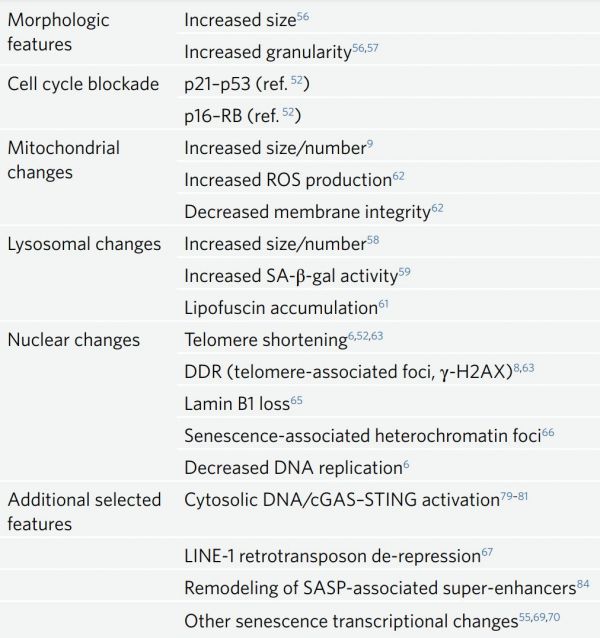
细胞核的改变是衰老细胞的突出特征,这主要是由引起p16和p21激活的DDR通路激活造成的。这些DDR通路的激活还同时使组蛋白H2AX磷酸化和激活态增加,该组蛋白的主要功能是在基因毒性压力和双链断裂后协助DNA的修复。H2AX组蛋白的这一特点促成了细胞衰老研究中使用免疫组化技术在衰老试验中标记磷酸化(γ)H2AX。然而,由于这一通路可以修复大部分染色体上的DNA双链断裂,考虑到其在大多数基因座上的瞬时性,其敏感性可能相对较为欠缺。然而,非同源末端连接为防止染色体末端-末端融合而呈现的局部抑制,使得双链断裂在端粒位点持续存在。因此,通过检测端粒探针和γ-H2AX抗体的共定位来评估端粒相关的DNA损伤灶是检测衰老细胞一种相对特异和敏感的方法,因为损伤灶在衰老诱导的压力下会在细胞中积累。其他细胞核的核改变包括核中间丝蛋白和表观遗传调节因子lamin B1的丢失、衰老相关异染色质区域的特定染色质重塑模式的出现以及DNA复制的减少,每一种改变都可以用免疫荧光技术进行鉴定和评估。其他遗传和表观遗传标记包括LINE-1逆转录转座子的激活和组蛋白乙酰转移酶KAT7的上调等。
细胞衰老研究领域目前正被组学和生物信息学方法所推动,这些方法有助于更好地理解细胞衰老的图谱,阐述新的分子机制,尤其是衰老细胞亚群的异质性。转录组方法为衰老细胞的动态研究提供了独特的视角,同时也给出了新的衰老分子标志物。最近研究发现,无论诱发的压力和细胞类型如何,衰老细胞似乎都有共同的基因差异表达特征,包括组蛋白相关转录物的下调和参与p53信号调控的长非编码RNA PURPL的上调。然而,单细胞分辨率下的转录组分析显示,即使是面临相同压力的单细胞也会呈现独特的衰老亚型,具有不同的基因和SASP表达谱,这不禁让人怀疑是否有可能找到一个的衰老标志物的“金标准”。不管怎样,单细胞转录组学可以通过多种转录标志物用以鉴定衰老细胞群。例如,这种技术显示脂肪来源的间充质干细胞在自然衰老条件下因衰老相关通路的改变而积累衰老标志物。辅以表观基因组以及蛋白质组和代谢组的数据,我们对衰老细胞命运的理解正在呈指数型增长。
SASP
SASP不仅可以抑制细胞增殖,还在衰老细胞的生理功能和病理变化中发挥重要作用。SASP包含大量细胞因子、基质金属蛋白酶、microRNA、趋化因子、生长因子和小分子代谢物,它们由外泌体包裹或直接分泌,主要受p53、NF-κB、CEBPB、JAK-STAT和GATA4转录因子调控。随着研究深入人们逐渐发现SASP调控是多层次的,除了转录水平,还包括如cGAS-STING通路的转录前信号级联作用,以及超级增强子重塑等表观遗传调控。科学家通过SASP图谱等来绘制和记录相应的衰老分泌表型,以此为基础的分析表明SASP随不同的压力而发生变化。例如病原体相关因子脂多糖或严重急性呼吸系统综合症冠状病毒2 S1抗原,可以显著放大现有衰老细胞的SASP,导致机体产生细胞因子风暴并增加死亡风险,这在老年人和慢性疾病患者中尤为严重。
SASP组分与许多生物学功能相关,但通常与衰老的慢性炎症相关,部分SASP组分与免疫调节相关。SASP趋化因子如白介素1(interleukin 1, IL-1)、白介素8(interleukin 8, IL-8)和肿瘤坏死因子(tumor necrosis factor, TNF)能够招募包括巨噬细胞、嗜中性粒细胞和T细胞在内的免疫细胞。这使得积累了ROS、DNA损伤或致癌应激的衰老细胞和邻近细胞被清除,与衰老在肿瘤发生中的预防作用一致。相反,这些相同的SASP组分(以及其他组分)长期或不受控制地表达时可能会通过基质和血管重塑促进肿瘤扩散和侵袭。这可以解释衰老在癌症预防和癌症发展中都起作用这一矛盾的发现。此外,SASP不仅是衰老细胞的产物,它还通过旁分泌和自分泌信号机制诱导和促进衰老(图1)。鉴于此,人们推测在慢性炎症环境中,与年龄相关的免疫能力下降可能会使得衰老细胞逃避被清除的命运,尽管这一点还没有完全被解析。此外,SASP信号会使得衰老细胞对免疫介导的清除产生抗性(例如,通过上调HLA-E配体,可抑制CD8+ T细胞和自然杀伤细胞功能)。不管免疫相互作用的确切潜在机制如何,衰老细胞的积累可以通过使衰老细胞清除的循环失败来持续下去,同时增加SASP信号,导致继发性衰老细胞诱导。值得注意的是,尽管有证据表明原发性和继发性诱导衰老细胞之间的SASP动力学存在差异,但关于继发性衰老细胞和那些初始因压力而衰老的细胞是否相似仍存在争议。此外,衰老的免疫系统因子还会进一步加强衰老和损伤的SASP信号,例如具有线粒体功能障碍的T细胞会像衰老细胞那样导致衰老细胞整体压力的增加,这与虚弱和多重病征的增加有关,并且部分可能与TNF信号有关。此外,在转基因小鼠的造血祖细胞中引入干扰DNA修复的载体使得免疫细胞成熟前衰老,导致产生多种年龄相关表型和转基因小鼠多种组织中的衰老细胞负担增加的现象。
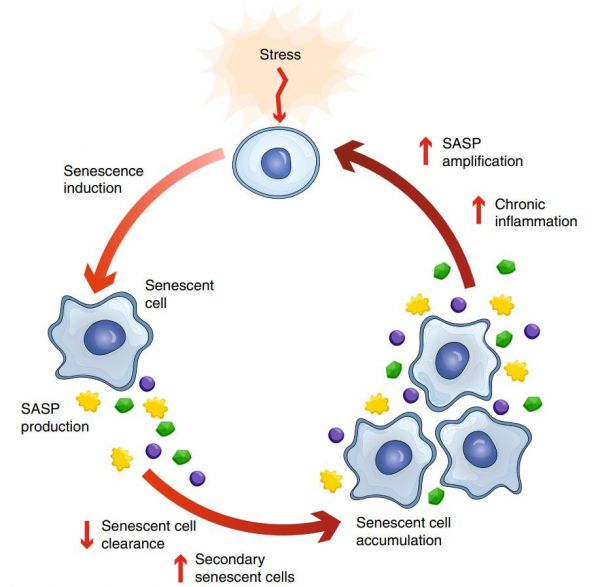
图1:衰老细胞累积的正反馈循环。
在暴露于初始应激源后诱导了细胞衰老。由此产生的衰老细胞会产生SASP,它可以进一步促进衰老细胞的积累并抑制其被清除。反过来SASP也可以被放大,引发慢性炎症和继发性的衰老诱导压力源,驱动衰老细胞积累的正反馈循环。
SASP的异质性反映了潜在衰老机制的复杂性,也进一步说明了SASP如何影响非衰老细胞的再生潜力。在体内角质细胞再生模型中,NF-κB通路SASP因子瞬时表达可促进干细胞特性和再生潜能的增强,而中断该信号或长时间暴露会减少干细胞特性和再生潜能。这表明了思考SASP动力学和阐明慢性衰老细胞的积累和信号传导如何减弱对生理损伤应答的必要性。在肝脏中,衰老分泌组也扮演者截然不同的两个角色。衰老和相关的转化生长因子-β信号传导与再生受损和胆管纤维化有关,而衰老细胞的不断消除和随后的SASP减少可诱导血管结构纤维化。这些发现可能是所使用的模型系统造成的假象,如不断消除衰老细胞的影响、p16作为衰老标志物的特异性有限,以及一项研究中可能存在血管渗漏的血管细胞群,但另一方面也可以表明衰老特征在不同环境下的可变性。
靶向衰老细胞
2004年的一份报告表明小鼠衰老细胞比重与健康寿命之间存在反比关系,这促使人们开始研发选择性消除衰老细胞的药物。在转基因INK-ATTAC小鼠模型(在衰老细胞中少量活跃的p16启动子的控制下,带有药物诱导的胱天蛋白酶8的转基因小鼠模型可以选择性消除表达p16的衰老细胞)中,通过从早衰小鼠中选择性去除高水平表达p16的细胞来缓解与年龄相关的表型,进一步支持了这一结论。由于衰老细胞在其分子生物学和生理功能方面具有高度异质性,因此需要有针对性的策略来尽量将衰老细胞保持在有益的状态,同时消除有害的影响。从广义上讲,这些疗法可以分为senomorphic疗法和senolytic疗法的主要类别,这种分类方法有一定的相对性,因为在一种细胞类型或环境中具有促进衰老作用的药物可能在另一种细胞类型或环境中具有延缓衰老作用,反之亦然。Senomorphic化合物靶向病理SASP信号,而senolytic则消除释放有害SASP因子的潜在衰老细胞。Senomorphic在其他地方也有讨论,简而言之,Senomorphic可抑制SASP组分的产生或者对其进行拮抗与中和,且通常需要连续给药。我们将专注于新兴的senolytic疗法以解决衰老病理的根本原因——衰老细胞,并通过间歇性给药产生多效益处。目前已经被研究证明有效清除衰老细胞的senolytic疗法包括Src激酶抑制剂达沙替尼和类黄酮槲皮素(dasatinib and the flavonoid quercetin, D+Q),以及最新的BCL-2家族抑制剂等。虽然第一批senolytic疗法是使用生物信息学方法开发的,旨在破坏SCAP和其他促进生存的通路,但该类已经扩展到利用额外的衰老特征和增强免疫介导的清除(图2)。从广义上讲,第一代药物的作用是使SCAP暂时失效,导致那些具有组织损伤性SASP的衰老细胞凋亡。所有senolytic疗法都可能发生脱靶效应或干扰正常细胞,但这些影响被控制在一定范围内,因为大多数疗法都适合间歇性的“打了就跑”的给药策略,不需要每天甚至每周给药。这种间隔给药策略被认为是有效的,因为衰老细胞即使在体外面临持续且严酷的衰老诱导压力时,也需要7天或更长时间(至少在体外)产生和累积SASP,并且可能需要同样长时间才能开始在体内重新积累。
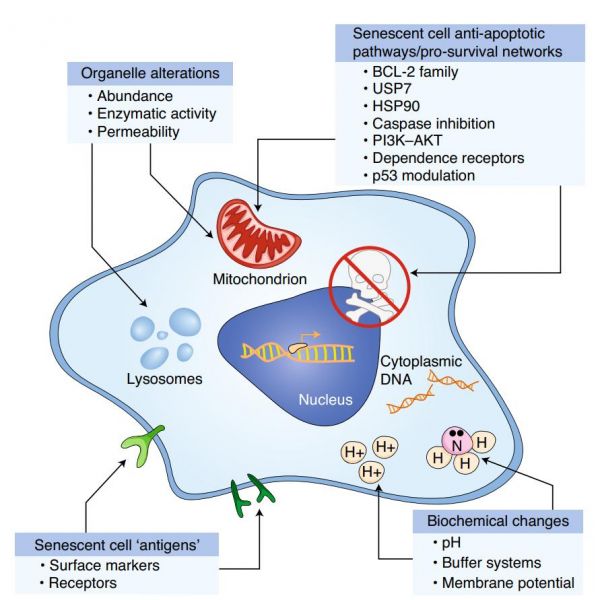
图2:senolytic所靶向的衰老细胞特征。
利用衰老细胞的经典特征来降低它们的丰度。这些靶标包括特异的表面抗原、SCAP和其他生存网络、生化代谢改变和细胞器特征的变化。
细胞外靶标和免疫系统介导的清除
衰老细胞的描述和定义已经揭示了衰老相关的特异性抗原。这些可以用于免疫系统介导的衰老细胞激活和清除。最近一项在小鼠模型中使用嵌合抗原受体CAR-T细胞靶向抑制尿激酶型纤溶酶原激活剂受体(urokinase-type plasminogen activator receptor, uPAR)的研究就利用了这一点。uPAR与细胞外基质重塑相关,在复制、致癌基因诱导和毒性诱导的衰老细胞表面上调。细胞毒性CAR-T细胞能够在体外和体内选择性地清除表达uPAR的衰老细胞。在四氯化碳和饮食诱导的肝纤维化小鼠模型中,CAR-T细胞介导的衰老细胞清除改善了存活率和组织病理学特征,这表明了这种衰老细胞清除疗法的可行性和潜力。然而,在治疗时,CAR-T细胞剂量与细胞炎性因子、体重减轻和体温过低有关,表明需要特别注意初始给药剂量。特别是在免疫系统受损和持续的慢性炎症的老年人群中,这可能会成为限制治疗的因素。此外,人类CAR-T细胞方法涉及初始免疫系统抑制,致病率较大且价格昂贵。衰老细胞清除疗法的CAR-T细胞可能具有自我限制的特性,它们的扩张和消退会在几天内发生,但这在急性到亚急性不良反应的情况下是有风险的。鉴于其临床前疗效和对衰老细胞的特异性,该策略有一定可行性,但在临床给药前还需进一步优化和测试。
选定衰老抗原后接种相应疫苗为清除衰老细胞提供了一种新颖的疗法。衰老的T细胞群在肥胖的脂肪组织中积聚,从而导致具有局部和全身效应的炎症。这些T细胞带有已知的衰老相关标志物,其特征是CD4阳性、CD44高表达、CD62L低表达、PD1阳性和CD153阳性。用CD153肽偶联物对这些细胞进行免疫接种可促进衰老T细胞从脂肪组织中清除,并改善其代谢功能。与其他免疫介导的清除疗法一样,针对衰老抗原表位的疫苗接种需要仔细考虑临床转化,尤其是在其可能难以逆转的持久影响的背景下。由于CD153与分枝杆菌清除有关,那些有分枝杆菌感染史或易感性强的患者需要特别注意中和抗体或清除阳性细胞的可能。此外,免疫系统衰退可能会限制老年人群的疫苗应答和记忆能力。
作用于SCAP
靶向SCAP网络开发了初始senolytic疗法。与单一药物、单一目标的方法相比,SCAP抑制可同时与多个促进生存的信号相互作用。因此,这些早期抗衰老药物通常具有几种协同相互作用的药理作用机制。这方面的主要例子是类黄酮非瑟酮(flavonoid fisetin)以及D+Q,它们已被充分运用和验证。简而言之,尽管确切的作用机制尚不清楚(大多数药物都是如此),但D+Q组合通过干扰包括ephrin依赖性受体信号通路、PI3K-AKT和BCL-2成员在内的几种促进生存的网络发挥广谱的清除衰老细胞活性。BCL-2家族成员(BCL-2、BCL-XL、BCL-W等)会阻止促凋亡线粒体信号级联的激活、细胞色素c的释放和下游的半胱天冬酶激活,是衰老抑制剂的靶标。这些化合物中,如navitoclax(ABT-263)、A1331852和A1155463,在体外对衰老的人肺成纤维细胞和脐静脉内皮细胞以及其他细胞类型显示出了活性。然而,与D+Q不同的是,这些药物并不能在体外消除所有的衰老细胞,并且在衰老的前脂肪细胞中发生了部分的回弹,而在体内也会造成广泛的代谢功能障碍和伤害。尽管调节间歇给药的剂量可能有所帮助,但BCL-2抑制剂作为senolytic的临床效用由于在血小板、中性粒细胞并且可能在T细胞中存在脱靶效应而受到限制,但这对于高危人群来说可能是特殊的(可能在单次给药后即可发生),并且可能损害止血功能并进一步损害其免疫功能。其他可以作为药物靶向的SCAP包括调节p53相关通路、抑制抗凋亡转录因子FOXO4、抑制肽酶USP7、抑制HSP90分子伴侣、增加由caspase激活驱动的凋亡以及其他正在研究中的通路。
其他方法
衰老细胞的其他特征有利于定向清除衰老细胞,其中一个便是衰老细胞的溶酶体酶活性增加。研究发现可以通过使用被溶酶体酶SA-β-gal切割和激活的药物前体来实现定向清除衰老细胞,或者通过将细胞毒性化学物质装载到的可以优先释放到衰老细胞中的纳米颗粒(进行半乳糖聚合物包被),从而实现定向清除衰老细胞。这种疗法可能会在具有高SA-β-gal活性的非衰老细胞中(如活化的巨噬细胞)受到脱靶效应的影响。衰老细胞中的溶酶体的丰度也通过激活自噬为衰老细胞清除提供了机会。自噬通常涉及细胞器和其他细胞成分的转换,这些成分被运输到溶酶体进行分子再利用。除了能够作为细胞循环系统之外,自噬在持续压力下而高度激活时,可激活细胞死亡的途径。自噬虽然在衰老细胞内受到抑制,但衰老细胞可在自噬的推动下为细胞死亡做好准备。这可以通过诱导自噬和随后使用贝特类药物、二甲双胍、mTOR复合物1(mTORC1)抑制剂、溴区结构域和末端结构域(bromodomain and extraterminal domain, BET)抑制剂和溶酶体酸化(ataxia telangiectasia mutated, ATM)抑制剂等来清除衰老细胞。除了靶向细胞器外,即使是微小的化学变化也能被利用来进行衰老细胞清除。强心苷可以通过衰老细胞内膜电位和质子浓度的变化对衰老细胞进行清除便可以证实这一点。此外,也可以靶向衰老细胞中对这些化学变化的补偿反应。例如,衰老细胞通过上调包括谷氨酰胺酶的产物氨在内的缓冲系统来抵抗溶酶体改变和其他因素导致的pH降低。这些缓冲系统的中断可以诱导衰老细胞死亡,并且维持缓冲浓度的酶可以被小分子药物所靶向。
Senolytics疗法的临床试验
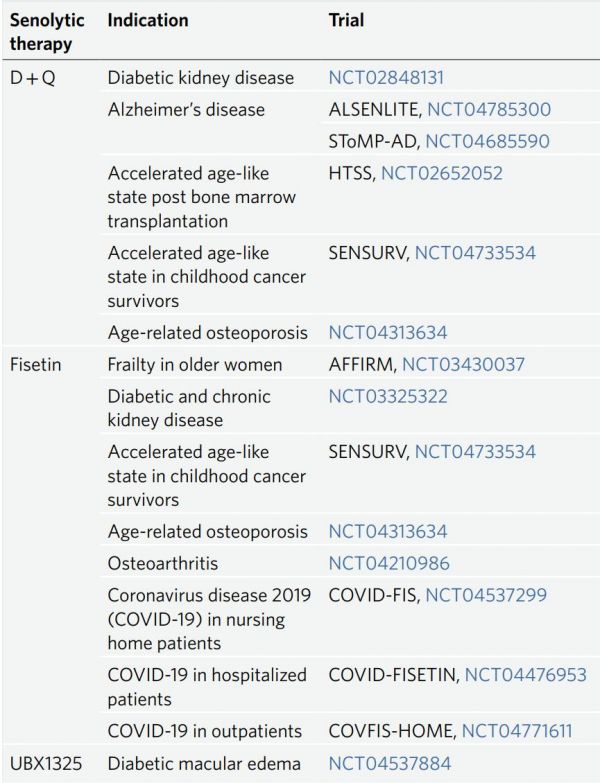
在首例试点开放性的临床senolytics疗法研究中(ClinicalTrials.gov identifier NCT02874989),14名特发性肺纤维化患者在3周内口服9次D+Q,停止服药五天后,患者的6分钟内步行距离、步行速度、座椅起身能力和简易体能状况均有所改善,这可能与试验药物、学习效果或开放性研究设计中固有的其他因素有关。依据这些初始数据,研究人员计划进行规模更大的安慰剂对照的D+Q治疗特发性肺纤维化的临床试验。最近报告了关于糖尿病肾病患者D+Q的一期开放性临床试验(NCT02848131)中期结果。在为期3天的口服D+Q之后的11天,与D+Q给药之前的活检细胞相比,9名糖尿病肾病患者脂肪组织p16INK4A和 SA-β-gal阳性数量都减少了。此外,在为期3天senolytic干预完成后的第11天,由于激活了CD68+巨噬细胞脂肪组织浸润和脂肪组织冠状结构形成(由于纤维化所造成的),10种循环SASP因子的综合评分显著降低,并且在这项持续试验中(受试者总计30人),迄今尚未出现严重的副作用。其他多项临床试验也正在进行或即将开始(表2),其中包括针对阿尔茨海默症(ALSENLITE, NCT04785300; STOMP-AD, NCT04685590),骨髓移植(HTSS, NCT02652052)和儿童癌症治愈者(SENSURV, NCT04733534)的加速衰老状态,年龄相关性骨质疏松症(NCT04313634)的D+Q试验,以及老年羸弱女性(AFFIRM, NCT03430037),糖尿病和慢性肾病(NCT03325322),儿童癌症治愈者的加速衰老状态(与SENSURV的D+Q相比),年龄相关性骨质疏松症(NCT04313634)、骨关节炎(NCT04210986)和在疗养院、住院病人和门诊病人中发现的冠状病毒患者(分别为COVID-FIS, NCT04537299; COVID-FISETIN, NCT04476953和COVFIS-HOME, NCT04771611)的非瑟酮试验。除了D+Q和非瑟酮,目前,一项Bcl-xL抑制剂UBX1325治疗糖尿病黄斑水肿的试验(NCT04537884)正在招募受试者。在一项拟用于治疗骨关节炎的senolytic复合物UBX0101(p53负调节因子MDM2的抑制剂)的临床试验(NCT03513016)中,因为UBX0101服用组未能在中期评估中优于安慰剂组,而被迫在2期临床试验时停止。这可能是由于多种因素造成的,其中包括可能的主要作用机制——MDM2抑制剂有异构活性以及需要持续性给药。此外,与临床试验中的单次注射相比,UBX0101在临床前模型中需要多次注射治疗,由于关节内注射生理盐水对骨关节炎患者报告结果的临床益处,该试验的 UBX0101 组的潜在益处也可能被掩盖了。在这些研究和其他研究提供有关益处以及不良或脱靶效应的结果和数据之前,不应在临床试验之外施以senolytics疗法。
表 2:关于senolytics疗法正在进行或即将开始的临床试验
结论和未来方向
由于细胞衰老宽泛的影响,其研究在十年间增长十分迅速,在未来几年必定会有更多新的衰老领域发现,然而,这之中依然存在巨大的差距与关键性问题。由于它们的表型依赖之前的应激环境,衰老细胞表现出滞后性。此外,衰老细胞在形式和功能上都是异质性的。衰老表型因细胞类型、起源组织、驻留组织、功能作用及衰老诱导方式的不同而不同(图3)。
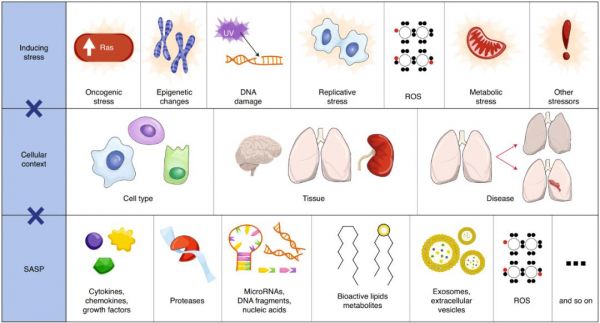
图三:细胞衰老的多层异质性。
衰老细胞表现出环境依赖的表型多样性。大量的刺激可以引起应激反应,足以引起细胞衰老。此外,对这些应激源的易感性和衰老细胞特征可能取决于细胞类型、组织、疾病状态和其他背景。由此产生的衰老细胞在其分泌组和随之产生的功能上表现出一系列趋同和不同的表型。
由于体外模型和从组织培养研究到体内动物模型,以及最终到人类的转化之间的差异,也让这一点变得更加复杂。并且研究这些差异的模型也很少(表3)。当前的动物模型,如INK-ATTAC或p16-3MR小鼠和其他p16依赖的模型,其作用是有限的。因为p16Ink4a不是每个衰老细胞都特异表达的,一些非衰老细胞(类型普遍且丰富),如活化的巨噬细胞,也可以高水平表达p16Ink4a。最近开发了基于p21的小鼠系统,以解决这些问题并探索未表征的衰老细胞群。但是,不得而知的是小鼠的衰老细胞是否代表人类体内的衰老细胞?我们已经开始通过移植研究来回答这个问题,在某项研究中,人类衰老细胞被引入小鼠宿主,但是这一问题依然还未解决。
表3:基于CDKI的已构建的衰老细胞模型

显然,该领域需要新的动物模型、衰老细胞培养系统和附加的人类转化实验来推动。在对衰老细胞异质性的不断认识中,可能仍存在尚未定义的衰老细胞种群和亚群,它们可能具有独特的表型,具有独特的空间动力学,并以依赖于环境的方式发挥不同的生理和致病作用。更为重要的是,很少有研究来评估自然发生衰老的细胞特征,尽管这可能是与衰老表型最相关的。虽然有大量的临床前证据表明,senolytics疗法可以治疗各种疾病过程,甚至补充再生疗法,但是目前还不清楚如何将senolytics治疗策略调节不同的衰老细胞群的方式转化为临床结果,也不清楚在预防性使用或在病程中使用时,senolytics的疗效是否不同。理想情况下,随着我们对衰老异质性理解的不断拓展,将越来越有可能使用合理的设计策略来瞄准并清除最有害的衰老细胞亚群(比如利用衰老细胞的单细胞差异基因表达谱)。然而,考虑到动物模型和人类自身之间的内在差异,这些转化问题仍具有挑战性,这些内在差异是由复杂的免疫功能和衰老细胞积累动力学的差异所构成的。总之,这些缺口需要通过蓬勃发展的细胞衰老领域来填补,并可能在可预见的未来引起人们的广泛兴趣。

来源:老顽童说
微信号
CSCB-Wechat
网站
原标题:《【重磅综述】靶向衰老细胞的疾病治疗策略》
