一种葡萄糖电极、微流控芯片、微流控无源汗液贴片及其制备方法和应用
1.本发明涉及传感器技术领域,尤其涉及一种葡萄糖电极、微流控芯片、微流控无源汗液贴片及其制备方法和应用。
背景技术:
2.可穿戴传感器可以实时监控人体的运动、电生理、温度等信号。在物联网、柔性传感器、大数据等技术的支撑下,可穿戴传感器广泛应用运动监护、精密医学和慢性病防护等生物医学领域。通过把传感器集成在纹身、贴片、腕带、手表和衣服等可穿戴产品中,可以实时监控患者的物理、生物和化学信号。这些数据可以无线传输到数据中心,以实现远程医疗系统。目前大多数可穿戴体液检测是通过汗液、眼泪和尿液等进行健康监测。汗液成分稳定,能为健康防护提供稳定的监控数据来源,具有良好的诊断价值。因此,可穿戴汗液检测尤其具有吸引力。
3.目前可穿戴汗液传感器开发的产品很少,但相关的文献报告很多。2017年,javey报道了一款完全集成的可穿戴汗液传感器,自此,该领域的研究进入了新的阶段(fully integrated wearable sensor arrays for multiplexed in situ perspiration analysis.doi:10.1038/nature16521)。该传感器同时且选择性地测量汗水代谢物(如葡萄糖和乳酸盐)与电解质(如钠离子和钾离子)、根据皮肤温度校准传感器的反应,以及连接至小型的穿戴式板载处理器单元,透过该小型板载处理器执行信号的转换、调节、处理,而且能以无线方式将结果传送到智能手机。但该传感器图片没有显示的是,传感器的激活和传感都需要电池。由于耗电量较大,因此传感器背后需要连接较大的电池。这完全背离了可穿戴传感器的初衷。
4.传统可穿戴传感器无法实现流体的精确捕获、存储、体积测量和化学分析,从而限制了将体液与污染物隔离的能力,并限制了后续提取、采样和化学分析的能力。此外,传统的葡萄糖检测装置往往需要产生创口,使用不便,无法实现汗液中的葡萄糖检测,应用受限。
5.因此,本领域亟待开发出新型的传感器以及穿戴设备,使其兼具收集、传递、储存和化学分析等性能。
技术实现要素:
6.针对现有技术的不足,本发明的目的之一在于提供一种葡萄糖电极,尤其在于提供一种可实现无源检测的葡萄糖电极。所述葡萄糖电解可以在无创的前提下,准确分析汗液中的代谢产物。
7.为达此目的,本发明采用如下技术方案:
8.本发明的目的之一在于提供一种葡萄糖电极,所述葡萄糖电极包括基体电极以及依次包覆在所述基体电极表面的聚苯胺膜和葡萄糖氧化酶膜。
9.本发明通过在基体电极上修饰离子选择性膜(聚苯胺膜和葡萄糖氧化酶膜),形成离子选择性葡萄糖电极,首次实现了利用离子选择电极来进行汗液中葡萄糖的无源检测,其原理是基于葡萄糖氧化酶催化葡萄糖生成氢离子,然后用氢离子选择电极检测生成的氢离子,进而计算出葡萄糖浓度,且不会对被测者造成创伤。
10.优选地,所述基体电极包括碳墨水电极、碳电极或碳墨水印刷电极。
11.优选地,所述葡萄糖氧化酶膜中含有葡萄糖氧化酶、壳聚糖和乙酸的组合。
12.本发明优选上述三种物质组成葡萄糖氧化酶膜,乙酸有助于溶解壳聚糖、壳聚糖能够稳定并保护葡萄糖氧化酶、葡萄糖氧化酶能与汗液中葡萄糖进行反应,能够进一步提高测试的精准度。
13.优选地,所述葡萄糖氧化酶、壳聚糖和乙酸的质量比为(0.2
‑
1):1:(1
‑
3),其中,(0.2
‑
1)包括但不限于0.3、0.4、0.5、0.6、0.7、0.8、0.9等,(1
‑
3)包括但不限于1.2、1.4、1.6、1.8、2、2.2、2.4、2.6、2.8等,优选0.5:1:2。
14.本发明的目的之二在于提供一种目的之一所述的葡萄糖电极的制备方法,所述制备方法包括如下步骤:
15.(1)将苯胺单体聚合到基体电极上,得到包覆有聚苯胺膜的电极;
16.(2)将葡萄糖氧化酶膜溶液滴在所述包覆有聚苯胺膜的电极上,干燥,得到所述葡萄糖电极。
17.优选地,步骤(1)中,所述聚合的方法为循环伏安法。
18.优选地,所述循环伏安法中,电压为
‑
0.2v
‑
1.0v,例如
‑
0.1v、0.1v、0.2v、0.3v、0.4v、0.5v、0.6v、0.7v、0.8v、0.9v等。
19.优选地,所述循环伏安法中,循环次数为20
‑
30次,例如21次、22次、23次、24次、25次、26次、27次、28次、29次等,优选25次。
20.优选地,所述循环伏安法中,电压速率为0.05
‑
0.2v/s,例如0.1v/s、0.12v/s、0.14v/s、0.16v/s、0.18v/s等,优选0.1v/s。因为循环伏安曲线是测循环电压下的电流值,电压速率是指电压的变化速度。
21.优选地,所述循环伏安法中,参比电极为ag/agcl电极。
22.优选地,所述循环伏安法中,电解液为苯胺单体的盐酸溶液。
23.优选地,所述电解液中苯胺单体的浓度为0.05
‑
2mol/l,例如0.1mol/l、0.2mol/l、0.4mol/l、0.6mol/l、0.8mol/l、1mol/l、1.2mol/l、1.4mol/l、1.6mol/l、1.8mol/l等,优选0.1mol/l。
24.优选地,所述电解液中hcl的浓度为0.5
‑
2mol/l,例如0.6mol/l、0.8mol/l、1mol/l、1.2mol/l、1.4mol/l、1.6mol/l、1.8mol/l等,优选1mol/l。
25.优选地,步骤(1)具体包括:通过循环伏安法将苯胺单体电聚合至碳墨水电极上,得到包覆有聚苯胺膜的电极;所述循环伏安法的条件包括:电压为
‑
0.2v
‑
1.0v,循环次数为20
‑
30次,电压速率为0.05
‑
0.2v/s,参比电极为ag/agcl电极,电解液为苯胺的盐酸溶液。
26.优选地,步骤(2)中,所述葡萄糖氧化酶膜溶液为含有葡萄糖氧化酶、壳聚糖和乙酸的pbs缓冲液。
27.优选地,所述葡萄糖氧化酶膜溶液中葡萄糖氧化酶的浓度为8
‑
12mg/ml,例如8.2mg/ml、8.4mg/ml、8.6mg/ml、8.8mg/ml、9mg/ml、9.2mg/ml、9.4mg/ml、9.6mg/ml、9.8mg/
ml、10mg/ml、10.2mg/ml、10.4mg/ml、10.6mg/ml、10.8mg/ml、11mg/ml、11.2mg/ml、11.4mg/ml、11.6mg/ml、11.8mg/ml等,优选10mg/ml。
28.优选地,步骤(2)中,所述干燥的温度为3
‑
6℃,例如4℃、5℃等,优选4℃。
29.优选地,步骤(2)中,所述干燥的时间为10
‑
18h,例如11h、12h、13h、14h、15h、16h、17h等。
30.优选地,葡萄糖氧化酶膜溶液的制备包括:溶解1%壳聚糖到2%乙酸中,然后以体积比2:1的比例与葡萄糖氧化酶溶液(浓度为10mg/ml,溶液为pbs缓冲液)混合。1%壳聚糖指的是质量百分比为1%的壳聚糖水溶液,2%乙酸指的是质量百分比为2%的乙酸水溶液。
31.本发明的目的之三在于提供一种微流控芯片,所述微流控芯片包括具有微流控通道的聚二甲基硅氧烷(pdms)膜以及贴附于所述聚二甲基硅氧烷膜上的离子选择(ise)传感器,所述离子选择传感器包括目的之一所述的葡萄糖电极。
32.本发明提供的微流控芯片能够实现汗液中葡萄糖的无源检测和分析,具体工作原理与目的之一所述的葡萄糖电极同理。
33.优选地,所述离子选择传感器还包括na
+
电极和/或k
+
电极。
34.优选地,所述na
+
电极为表面包覆有na
+
离子选择性膜的碳墨水电极。
35.优选地,所述na
+
离子选择性膜中含有na
+
载体x、四[3,5
‑
双(三氟甲基)苯基]硼酸钠、聚氯乙烯和双(2
‑
癸二酸乙酯)的组合。其中na
+
载体x为本领域公知的物质,示例性地可以为na
+
离子载体iii。
[0036]
优选地,所述na电极的制备方法包括:na
+
选择性膜混合溶液滴铸在碳墨水电极上,干燥,得到na
+
电极。
[0037]
优选地,所述na
+
选择性膜混合溶液的溶质为1%的na
+
离子载体x、0.5%的四[3,5
‑
双(三氟甲基)苯基]硼酸钠、33%的聚氯乙烯和65.5%的双(2
‑
癸二酸乙酯),溶剂为四氢呋喃。
[0038]
优选地,所述k
+
电极为表面包覆有k
+
离子选择性膜的碳墨水电极。
[0039]
优选地,所述k
+
离子选择性膜中含有缬霉素、四苯基硼酸钠、聚氯乙烯和癸二酸双(2
‑
乙基乙基)酯的组合。
[0040]
优选地,所述k
+
电极的制备方法包括:k
+
择性膜混合溶液滴铸在碳墨水电极上,干燥,得到k
+
电极。
[0041]
优选地,所述k
+
选择性膜混合溶液的溶质为2%的缬霉素、0.55%的四苯基硼酸钠、33%的聚氯乙烯和64.45%的癸二酸双(2
‑
乙基乙基)酯,溶剂为环己酮。
[0042]
在本发明的优选技术方案中,无机盐离子na
+
和k
+
的检测原理是基于离子选择电极进行的。离子选择电极是基于离子选择性透过表面修饰膜进而改变电极表面电势,通过分析电势的变化量分析汗液中离子的浓度。
[0043]
优选地,所述离子选择传感器还包括参比电极。
[0044]
优选地,所述参比电极为表面包覆有聚乙烯醇缩丁醛膜(pvb)的ag/agcl墨水电极。
[0045]
优选地,所述聚乙烯醇缩丁醛膜中含有聚乙烯醇缩丁醛、聚氧化乙烯
‑
聚氧化丙烯
‑
聚氧化乙烯嵌段聚合物(peo
‑
ppo
‑
peo)、多壁碳纳米管和nacl的组合。
[0046]
优选地,所述参比电极的制备方法包括:将pvb膜混合溶液滴铸在ag/agcl墨水电
极上,干燥,得到参比电极。
[0047]
优选地,所述pvb膜混合溶液包括pvb、peo
‑
ppo
‑
peo、多壁碳纳米管和nacl的甲醇溶液。
[0048]
优选地,所述微流控芯片还包括置于所述聚二甲基硅氧烷膜的微流控通道中的尿素检测条和ph检测条。
[0049]
优选地,所述尿素检测条包括涂布有尿素酶的ph试纸。
[0050]
所述尿素检测条的工作原理是基于尿素酶催化尿素,然后在ph试纸上产生比色结果。通过尿素和ph检测条的颜色变化来计算尿素的浓度。
[0051]
优选地,所述ph检测条包括ph试纸。
[0052]
本发明的目的之四在于提供一种微流控无源汗液贴片,所述微流控无源汗液贴片包括目的之一所述的葡萄糖电极或者目的之三所述的微流控芯片。
[0053]
本发明把微流控芯片集成到微流控无源汗液贴片中有下列优点:首先,微流控芯片存储、运输和处理液体的微结构形成了传感器的核心部件。通过操纵精确的液体量,可以显着提高传感精度和可靠性。这一特性对于可穿戴器件是非常有用的,因为体液的分泌很少且不可控。其次,微结构还可以形成物理容物,以受控的间隔进行溶质的存储和分配,进而实现可控的药物释放。最后,微型图案化结构可以用作电子设备的导管,并在柔性基板中实现电连接。在保持微机电系统(mems)之间优异的导电性的同时,提供了出色的柔性和拉伸性能。
[0054]
此外,由于整个传感器使用近场传感(rfid)技术,传感器部分不需要电源,本发明提供的微流控无源汗液贴片无需电源。
[0055]
优选地,所述微流控无源汗液贴片包括层叠设置的目的之三所述的微流控芯片、金属聚合物导体(mpc)导线层、金属聚合物导体(mpc)天线层和电子器件层。
[0056]
在本发明的优选技术方案中,将上述各部件组合形成微流控无源汗液贴片,首先,汗水利用微流控芯片的毛细管力的驱动传递到传感器表面,ise电极收集各个分析物的浓度信号,并转化为表面电势。优选技术方案中三个ise电极(葡萄糖电极、na
+
电极和k
+
电极)共享一个共有的参比电极。mlx 90129芯片收集信号后,通过mpc天线把数据传输出去,当便携式阅读器和智能手机靠近传感器时,生成的信号会通过信号传输和射频识别(rfid)传输到阅读器,且微流控无源汗液贴片的电源由rfid提供。
[0057]
本发明所述mpc导线层和mpc天线层按照专利申请cn108668431a记载的柔性可拉伸导电线路及电路的制备方法制备得到。
[0058]
优选地,所述微流控无源汗液贴片还包括粘贴在所述微流控芯片上的双面胶层。
[0059]
优选地,所述微流控芯片与所述金属聚合物导体导线层通过硅氧化学键连接。
[0060]
优选地,所述金属聚合物导体导线层与金属聚合物导体天线层通过聚二甲基硅氧烷的交联产物连接。
[0061]
优选地,所述金属聚合物导体天线层与电子器件层通过导电胶连接。
[0062]
优选地,所述双面胶层上含有微流控通道。所述微流控通道用于汗液的导入。
[0063]
优选地,所述金属聚合物导体导线层包括液态金属导线和包覆在所述液态金属导线表面的剥离层。
[0064]
优选地,所述液态金属包括镓、汞、镓铟合金、镓铟锡合金、镓锌合金或铋锡铅铟镉
合金中的任意一种或至少两种组合,优选镓铟合金。
[0065]
优选地,所述剥离层的材料包括聚二甲基硅氧烷(pdms)、smooth
‑
on系列材料、橡胶、塑料膜、树脂、聚氨酯、聚乙烯、聚乙烯醇、聚四氟乙烯、聚酰亚胺、环氧树脂、聚苯乙烯、pet、聚乳酸、聚乙醇酸、聚乳酸
‑
乙醇酸共聚物或聚乳酸
‑
己内酯中的任意一种或至少两种组合,优选聚二甲基硅氧烷。
[0066]
本发明的目的之五在于提供一种目的之四所述的微流控无源汗液贴片的制备方法,所述制备方法包括如下步骤:
[0067]
(1)使用氧等离子体将聚二甲基硅氧烷膜和金属聚合物导体导线层激活,然后将二者粘结在一起;
[0068]
(2)将电子器件层与金属聚合物导体天线层通过导电胶连接;
[0069]
(3)使用氧等离子体将金属聚合物导体天线层和金属聚合物导体导线层激活,然后将二者粘结在一起;
[0070]
(4)通过氧等离子体激活表面后,将所述离子传感器与金属聚合物导体导线层连接;
[0071]
(5)通过氧等离子体激活所述聚二甲基硅氧烷膜上的微流控通道层,将尿素检测条和ph检测条放置于微流控通道中,后与聚二甲基硅氧烷膜贴合;
[0072]
(6)将聚二甲基硅氧烷预聚体和固化剂的混合物涂布在所述微流控芯片表面,固化,得到微流控无源汗液贴片。
[0073]
上述步骤中,氧等离子体可以激活mpc导电层和mpc天线层表面的pdms发生交联,从而使二者连接在一起。上述步骤(6)中,固化后封闭隔绝外界干扰。
[0074]
优选地,步骤(2)中,所述电子器件层包括mlx 90129芯片。
[0075]
优选地,所述氧等离子体的功率为50
‑
70w,例如55w、60w、65w、68w等,优选60w。
[0076]
优选地,所述激活的时间为0.5
‑
2min,例如0.6min、0.8min、1min、1.2min、1.4min、1.6min、1.8min等,优选1min。
[0077]
优选地,步骤(6)还包括:在所述固化之后粘贴双面胶层。
[0078]
本发明的目的之六在于提供一种目的之四所述的微流控无源汗液贴片的应用,所述微流控无源汗液贴片用于检测汗液中的代谢物含量、电解质含量、尿素含量或ph。
[0079]
优选地,所述代谢物包括葡萄糖。
[0080]
优选地,所述电解质包括钾离子或钠离子。
[0081]
本发明的目的之七在于提供一种可穿戴设备,所述可穿戴设备包括目的之四所述的微流控无源汗液贴片。
[0082]
相较于现有技术,本发明具有如下有益效果:
[0083]
(1)本发明通过在碳墨水电极上修饰离子选择性膜,首次实现了利用离子选择电极来进行汗液中葡萄糖的无源检测,其原理是基于葡萄糖氧化酶催化葡萄糖生成氢离子,然后用氢离子选择电极检测生成的氢离子,进而计算出葡萄糖浓度,且不会对被测者造成创伤。
[0084]
(2)本发明将微流控芯片集成到微流控无源汗液贴片中有下列优点:首先,微流控芯片存储、运输和处理液体的微结构形成了传感器的核心部件。通过操纵精确的液体量,可以显着提高传感精度和可靠性。这一特性对于可穿戴器件是非常有用的,因为体液的分泌
很少且不可控。其次,微结构还可以形成物理容物,以受控的间隔进行溶质的存储和分配,进而实现可控的药物释放。最后,微型图案化结构可以用作电子设备的导管,并在柔性基板中实现电连接。在保持mems之间优异的导电性的同时,提供了出色的柔性和拉伸性能。
附图说明
[0085]
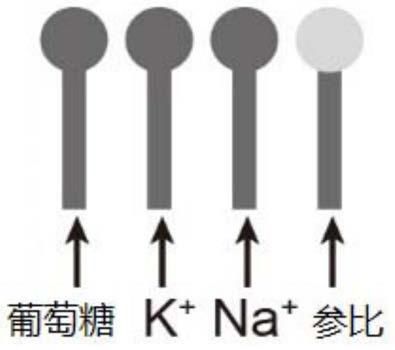
图1是本发明实施例1中离子选择传感器的示意图。
[0086]
图2是本发明实施例1中尿素检测条和ph检测条示意图。
[0087]
图3是本发明实施例2中微流控无源汗液贴片的结构示意图。
[0088]
图4是本发明实施例2中微流控无源汗液贴片的制备过程示意图。
[0089]
图5是本发明实施例2中mpc天线的外形示意图。
[0090]
图6a是本发明实施例2中微流控无源汗液贴片的na
+
传感器性能测试图。
[0091]
图6b是本发明实施例2中微流控无源汗液贴片的na
+
传感器浓度与电位关系图。
[0092]
图7a是本发明实施例2中微流控无源汗液贴片的k
+
传感器性能测试图。
[0093]
图7b是本发明实施例2中微流控无源汗液贴片的k
+
传感器浓度与电位关系图。
[0094]
图8a是本发明实施例2中微流控无源汗液贴片的h
+
传感器性能测试图。
[0095]
图8b是本发明实施例2中微流控无源汗液贴片的h
+
传感器ph值与电位关系图。
[0096]
图9a是本发明实施例2中微流控无源汗液贴片的葡萄糖传感器性能测试图。
[0097]
图9b是本发明实施例2中微流控无源汗液贴片的葡萄糖传感器浓度与电位关系图。
[0098]
图10是本发明实施例2中微流控无源汗液贴片的尿素传感器性能测试图。
[0099]
图11是本发明实施例2中微流控无源汗液贴片的尿素传感器浓度与gr值关系图。
具体实施方式
[0100]
为便于理解本发明,本发明列举实施例如下。本领域技术人员应该明了,所述实施例仅仅是帮助理解本发明,不应视为对本发明的具体限制。
[0101]
实施例1
[0102]
本实施例提供一种葡萄糖电极,制备方法如下:
[0103]
(1)通过循环伏安法将苯胺单体电聚合至碳墨水电极上,得到包覆有聚苯胺膜的电极;所述循环伏安法的条件包括:电压为
‑
0.2v
‑
1.0v,循环次数为25次,电压速率为0.1v/s,参比电极为ag/agcl电极,电解液为苯胺单体的盐酸溶液(苯胺单体浓度为0.1mol/l,hcl浓度为1mol/l);
[0104]
(2)溶解1%壳聚糖水溶液到2%乙酸水溶液中,然后以体积比2:1的比例与葡萄糖氧化酶溶液(浓度为10mg/ml,溶液为pbs缓冲液)混合,得到葡萄糖氧化酶膜溶液,将混合溶液滴在所述包覆有聚苯胺膜的电极上,4℃干燥12h,得到所述葡萄糖电极。
[0105]
实施例2
[0106]
本实施例提供一种微流控芯片及微流控无源汗液贴片;
[0107]
微流控芯包括具有微流控通道的pdms膜以及贴附于pdms膜上的ise传感器(如图1所示)以及置于微流控通道中的尿素检测条和ph检测条(如图2所示),其中,离子选择传感器由葡萄糖电极(实施例1)、na
+
电极、k
+
电极和参比电极组成。
[0108]
微流控无源汗液贴片包括层叠设置的双面胶层、微流控芯片、mpc导线层、mpc天线层和电子器件层,如图3所示。
[0109]
微流控无源汗液贴片具体制备方法如下(制备过程如图4所示):
[0110]
(1)使用氧等离子体将pdms膜和金属聚合物导体导线层激活,然后将二者粘结在一起;
[0111]
(2)将电子器件层(mlx 90129芯片)与mpc天线层通过导电胶(奥斯邦529)连接;
[0112]
(3)使用氧等离子体以60w的功率将mpc天线层和mpc导线层激活1分钟,表面的pdms发生交联,然后将二者粘结在一起;
[0113]
(4)通过氧等离子体激活表面后,将离子传感器与金属聚合物导体导线层连接;
[0114]
(5)通过氧等离子体激活pdms膜上的微流控通道层,将尿素检测条和ph检测条放置于微流控通道中,后与聚二甲基硅氧烷膜贴合,得到微流控芯片;
[0115]
(6)将pdms预聚体和固化剂的混合物(质量比为10:1)涂布在所述微流控芯片表面,固化,粘贴双面胶层,得到微流控无源汗液贴片。
[0116]
上述mpc导线层和mpc天线层的制备方法如下:
[0117]
将1g液态金属(镓铟合金,egain)添加到装有1ml正癸醇的5ml离心管中,并用超声仪以300w的功率进行超声处理,时间为2分钟。将egain超声处理为以egain为核,ga2o3为壳的液态金属(lms)颗粒油墨。用200目丝网印刷板将所得的lms油墨丝网印刷到聚对苯二甲酸乙二醇酯(pet)基材上,以获得各种lms颗粒图案。蒸发溶剂后,将pdms预聚体和固化剂的混合物(质量比为10:1)倒在lms颗粒图案上。在80℃下烤1小时固化后,将pdms膜从pet基材上剥离下来。ga2o3外壳由于剪切应力而破裂,从而形成了导电的mpc天线和导线。其中,mpc天线外形如图5所示。
[0118]
上述尿素检测条和ph检测条的制备方法如下:
[0119]
(1)将尿素酶溶解于去离子水中,得到浓度为0.01mg/ml的尿素酶溶液。将ph试纸切成直径为2mm的圆形,将5μl尿素酶溶液滴到ph纸上,并在干燥器中真空干燥60分钟,得到尿素检测纸。
[0120]
(2)将ph试纸切成直径为2mm的圆形,得到ph检测条。
[0121]
上述na
+
电极、k
+
电极和参比电极的制备方法如下:
[0122]
(1)na
+
电极:将1%的na
+
离子载体iii、0.5%的四[3,5
‑
双(三氟甲基)苯基]硼酸钠、33%的聚氯乙烯和双(2
‑
癸二酸乙酯)溶解于四氢呋喃中形成的混合溶液滴铸在碳墨水电极上,干燥,得到na
+
电极。
[0123]
(2)k
+
电极:将2%的缬霉素、0.55%的四苯基硼酸钠、33%的聚氯乙烯和癸二酸双(2
‑
乙基乙基)酯溶解于环己酮中形成的混合溶液滴铸在碳墨水电极上,干燥,得到k
+
电极。
[0124]
(3)参比电极:将pvb、peo
‑
ppo
‑
peo、多壁碳纳米管和nacl的甲醇溶液滴铸在ag/agcl墨水电极上,干燥,得到参比电极。
[0125]
本实施例中所使用的原料来源:聚氯乙烯购于macklin,牌号为p815910;pvb购于macklin,牌号为p815776;peo
‑
ppo
‑
peo购于macklin,牌号为p822487;多壁碳纳米管购于aladdin,牌号为c139823。
[0126]
性能测试1
[0127]
针对实施例2得到的微流控无源汗液贴片进行如下测试:
[0128]
将1m的nacl和kcl溶液连续稀释1024倍,得到1000、500、250、125、62.5、31,25、15.63、7.81、3.90、1.95、0.98和0mm的稀释标准溶液。在微流控无源汗液贴片上添加50μl溶液,并使用开路电势
‑
时间(ocpt)模型监控其信号。随着钠离子和钾离子浓度的增加,每个传感器的开路电势都增加,并表现出接近能斯特的行为(图6a、图6b,图7a、图7b)。开路电势与浓度的对数成正比,钠离子的标准曲线为y=0.0196
×
log2(x)+0.1695,r2=0.9984,钾离子的标准曲线为y=0.0146
×
log2(x)+0.1773,r2=0.9957。钠离子和钾离子的生理相关浓度分别约为66.3
±
46.0mm和9.0
±
4.8mm。准备了具有不同ph值(5.91、6.24、6.47、6.64、6.81、6.98、7.17、7.38、7.73和8.04)的磷酸盐缓冲溶液以表征微流控无源汗液贴片。观察到在室温下,在ph值为5.91
‑
8.04的范围内,其响应灵敏度为55.50
±
6.31mv/ph(图8a、图8b)。图9a和图9b显示了浓度为5、2.5、1.25、0.625、0.313、0.156、0.078、0.039、0.020和0.010mm的微流控无源汗液贴片中传感器的开路电势。在该浓度范围内,微流控无源汗液贴片中传感器的标准曲线为y=0.0151
×
log2(x)+0.2071,r2=0.9862,也覆盖了0.33
‑
0.65mm的自然浓度范围。图10和图11显示了不同浓度的尿酸作用下,微流控无源汗液贴片的颜色响应。通过分析照片的rgb值时,我们发现绿色(g)和红色(r)值与尿酸的浓度显示出良好的相关性。
[0129]
实施例3
[0130]
与实施例1的区别在于,不添加壳聚糖。
[0131]
实施例4
[0132]
与实施例2的区别在于,将实施例1的葡萄糖电极替换为实施例3的葡萄糖电极。
[0133]
性能测试2
[0134]
针对实施例4得到的微流控无源汗液贴片进行如下测试:
[0135]
制备浓度为5、2.5、1.25、0.625、0.313、0.156、0.078、0.039、0.020和0.010mm的标准溶液葡萄糖溶液。将制备的微流控无源汗液贴片传感器放置到溶液中,测其开路电势。在该浓度范围内,葡萄糖微流控无源传感器的灵敏度与实施例2没有太大区别,但传感器稳定性相对较差。
[0136]
对比例1
[0137]
与实施例1的区别在于,将聚苯胺膜替换为商用氢离子选择性透过膜。
[0138]
对比例2
[0139]
与实施例2的区别在于,将实施例1的葡萄糖电极替换为对比例1的葡萄糖电极。
[0140]
性能测试3
[0141]
针对对比例2得到的微流控无源汗液贴片进行如下测试:
[0142]
制备浓度为5、2.5、1.25、0.625、0.313、0.156、0.078、0.039、0.020和0.010mm的标准溶液葡萄糖溶液。将制备的微流控无源汗液贴片传感器放置到溶液中,测其开路电势。在该浓度范围内,葡萄糖微流控无源传感器的灵敏度差于实例2,无法覆盖汗液中葡萄糖的浓度范围。与此同时,对比例1得到的微流控无源汗液贴片不同浓度间的电压差异小于实例2。传感器的标准曲线为y=0.0121
×
log2(x)+0.1201,r2=0.9464。灵敏度和稳定性相较于实施例2均体现较差。
[0143]
申请人声明,本发明通过上述实施例来说明本发明的详细方法,但本发明并不局限于上述详细方法,即不意味着本发明必须依赖上述详细方法才能实施。所属技术领域的
技术人员应该明了,对本发明的任何改进,对本发明产品各原料的等效替换及辅助成分的添加、具体方式的选择等,均落在本发明的保护范围和公开范围之内。
相关知识
一种微针减肥贴片及其制备方法与流程
一种可用于健康监测的新型水凝胶电极贴片及其制备方法
一种茶多酚压片糖果及其制备方法与流程
一种减肥片及其制备方法与流程
一种电子贴片开关的方法与流程
一种减肥片剂及其制备方法与流程
一种控制体重的压片糖果及其制备方法与流程
一种高安全性的溶脂微针及其制备方法和其应用与流程
微电流贴片减肥有用吗
一种木耳辣木微粉片及其制备方法与流程
网址: 一种葡萄糖电极、微流控芯片、微流控无源汗液贴片及其制备方法和应用 https://m.trfsz.com/newsview1333038.html