贾玮教授:食源性多酚对2型糖尿病的有益作用:基于肠道微生物群变化

陕西科技大学食品科学与工程学院、陕西省农产品加工技术研究院的Song Han(第一作者)和Jia Wei(通信作者)基于现有文献,本文参考了对2型糖尿病具有保护或致病作用的微生物代谢产物的合成和代谢,包括短链脂肪酸(short-chain fatty acids,SCFAs)、胆汁酸(bile acids,BAs)和支链氨基酸(branched-chain amino acids,BCAAs),以总结多酚-微生物组-2型糖尿病的交互作用。此外,对食源性多酚干预2型糖尿病的作用机制进行了详细探讨。最后对食源性多酚的生物利用度进行探讨,为提高其临床疗效提供建议。
食用富含多酚的食物可以有效预防和预防2型糖尿病。多酚是生物活性化合物,并根据其结构特征分为多酚单体和聚合多酚。多酚单体分为90%的酚酸、类黄酮和10%的1,2-苯乙烯,其中大部分由绿原酸、咖啡酸、芦丁和花青素组成,它们均具有降低血脂和血糖、抗氧化剂和抗炎的特性。表1显示了本研究中讨论的食物来源的多酚的结构,根据化学结构中碳原子的骨架结构进行分类。
表1 根据化学结构中碳原子的骨架结构对化合物分类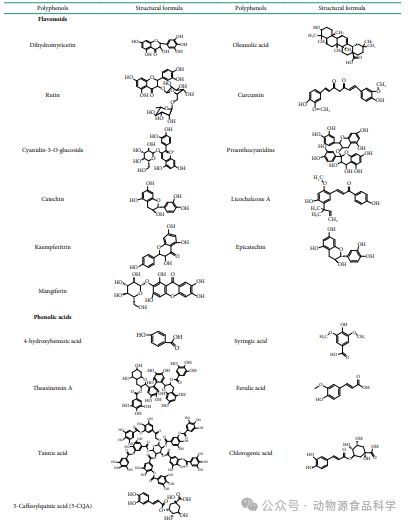
然而,多酚的生物利用度与其复杂的化学结构之间存在关系。由于其丰富的酚羟基,其在碱性环境中容易降解。肠吸收率、细胞吸收效应和组织富集影响食源性多酚的生物利用度。这种水解过程影响了摄入的多酚在生理上的运作,涉及肠道酶和肠道微生物。因此,根据几个变量,这些代谢物的可利用度在摄入后显著不同。此外,高剂量多酚(高于每日摄入的最大安全剂量,1.0 g)被认为是具有不良后果的促氧化剂。食品来源的多酚可以与蛋白质结合形成微胶囊,以提高其生物利用度,其中包埋技术研究最为广泛。
虽然食物来源多酚在治疗2型糖尿病中的作用机制已被广泛研究,但仍缺乏系统的研究来解释食物来源的多酚与2型糖尿病之间的因果关系是否由微生物介导。
2 2型糖尿病的肠道微生物:与饮食成分的相互影响饮食的组成影响个体肠道微生物组的组成,肠道微生物组发酵不可消化的膳食纤维以产生BAs,SCFAs和BCAA,可以解释饮食如何影响宿主肠道功能,导致2型糖尿病。了解肠道微生物群和微生物群代谢是通过调节饮食干预宿主肠道微生物群来缓解2型糖尿病发展(图1)。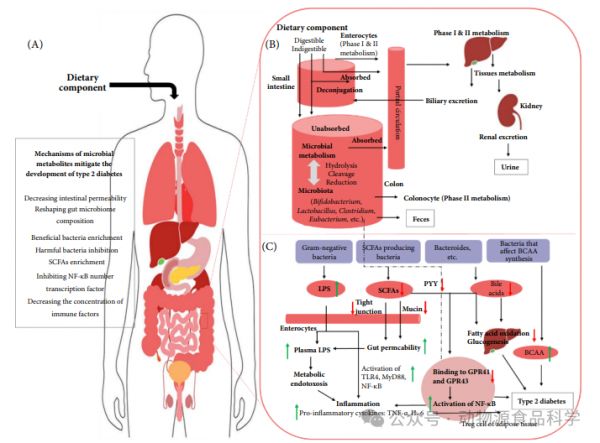
图1食源性多酚治疗2型糖尿病的微生物代谢机制
2.1 肠道微生物将难消化的膳食成分分解成SCFA
肠道微生物发酵难以消化的膳食成分以产生SCFA。SCFA主要由丁酸、丙酸和乙酸组成,它们被快速吸收,主要存在于结肠中。丙酸盐和丁酸盐通过刺激瘦素和促性腺激素如胆囊收缩素(cholecystokinin,CCK)和氧调节激素(oxygen regulatory hormone,OXM)的分泌,抑制饥饿和食欲,以及促进宿主脂质代谢和糖原代谢来降低2型糖尿病的风险(图2A)。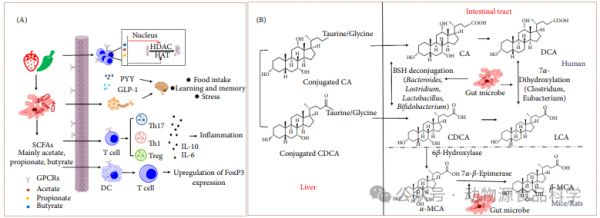
图2 SCFAs和BAs的代谢机制
丁酸通过参与葡萄糖代谢,维持能量稳态,并提供肠上皮细胞60%-70%的能量需求,促进肠道中葡萄糖的产生。丁酸通过降低胰高血糖素过表达和叉头盒蛋白O1(FoxO1)核转位抑制糖异生。罗斯拜瑞氏菌属和粪杆菌属的菌是主要丁酸盐产生菌,并且这些微生物丰度的减少将降低丁酸水平,这可能诱发2型糖尿病。此外,丁酸有助于再生结肠上皮,修复肠粘膜结构,增强肠道免疫力。一旦产生SCFA的细菌数量减少,肠道中SCFA的水平就会降低,从而激活活化B细胞的核因子κ-轻链增强子(nuclear factor kappa-light-chain enhancer of activated B cells,NF-κB),促进促炎因子的释放以引起炎症,并抑制SCFA受体。SCFA受体是G蛋白偶联受体(G protein-coupled receptors,GPR)家族的成员,包括GPR41、GPR43和GPR109A,位于结肠或免疫细胞的表面。SCFA受体被SCFA激活,参与脂质代谢、葡萄糖代谢和炎性体信号传导,以维持肠道稳态。丁酸盐与GPR109A相互作用,可能作为GPR109A的激动剂,并以GPR109A依赖性方式促进紧密连接蛋白的表达,以发挥抗炎特性。此外,丁酸盐以GPR43依赖性方式增强紧密连接蛋白表达并保护肠屏障完整性。紧密连接蛋白,如封闭小带1(onula occludens 1,ZO-1)、紧密连接蛋白和闭合蛋白,连接相邻的肠上皮细胞和整合细胞旁途径。增加紧密连接蛋白的表达可以降低肠道通透性,从而减轻2型糖尿病。丁酸通过抑制结肠细胞中的组蛋白脱乙酰酶(histone deacetylase,HDAC)活性来促进组蛋白H3乙酰化并抑制GPR43和A1蛋白的表达,从而减少炎症反应。丁酸被认为是HDAC的抑制剂。HDAC调节2型糖尿病进展中的异常血管生成。丁酸通过调节胰腺细胞增殖和抑制α细胞团来抑制胰高血糖素过表达。黄原胶低聚糖主链上含有β-1,4-葡萄糖苷键,有助于提高丁酸含量。体外粪便发酵实验表明,经肠道微生物发酵的黄原胶低聚糖使丁酸含量增加了83%。基于体外粪便发酵模型,发现黄原胶寡糖增加了2型糖尿病小鼠肝脏中拟杆菌目的种类数量,并激活了SCFA受体GPR41和GPR43的表达。体外模拟实验表明,花青素代谢产物矢车菊素-3-O-葡萄糖苷(cyanidin-3-O-glucoside,C3G)通过增加HepG2细胞的葡萄糖代谢和糖原含量,抑制活性氧(reactive oxygen species,ROS)的过度产生,改善线粒体功能,发挥抗2型糖尿病作用。体外发酵实验后,C3G的胃肠道pH值从5.87降至4.77(24 h,ΔpH=-1.10),增加SCFA产量和拟杆菌门丰度,降低厚壁菌门丰度。2.2 BA驱动肠道微生物群成熟BA是由胆固醇合成并由肠道植物群修饰的次级BA。BAs的合成和代谢在脊椎动物物种之间存在显著差异(图2B)。BA通过激活核法尼醇X受体(farnesoid X receptor,FXR)和武田G蛋白偶联受体5(Takeda G protein-coupled receptor 5,TGR5)调节葡萄糖和脂质代谢、能量消耗和炎症反应。FXR是一种转录和核受体,广泛表达于肝脏、肾脏和肠道。FXR激活诱导小异二聚体伴侣(small heterodimer partner,SHP)的表达,随后通过肝相关同源物-1(liver-related homologous-1,LRH-1)协同抑制胆固醇7α-羟化酶(cholesterol 7α-hydroxylase,CYP7A1)的表达,并调节胆固醇转化为BA。CYP7A1是经典胆汁酸合成途径中的限速酶,而LRH-1是由CYP7A1表达的转录因子。
BA与FXR结合,以促进胰岛素敏感性并减少肝脏新生和糖原合成,从而维持葡萄糖稳态。BA激活FXR可促进成纤维细胞生长因子-15(fibroblast growth factor-15,FGF15)或FGF19的表达和分泌,其与成纤维细胞生长因子受体4(fibroblast growth factor receptor 4,FGFR4)/β-Klotho受体结合,抑制CYP7A1的表达并激活c-Jun 氨基末端激酶(c-Jun N-terminal kinase,JNK)信号通路,从而抑制BA合成。FXR激活间接激活TGR5,TGR5在代谢组织如心脏、肾脏和小肠中广泛表达。TGR5通过GLP-1分泌协助葡萄糖代谢过程并增强能量消耗。BA还直接激活TGR5以促进GLP-1的释放,从而改善肝脏和胰腺功能并增强葡萄糖耐量。GLP-1是一种肠促胰岛素,以葡萄糖依赖性方式降低高血糖症,并直接作为胰腺细胞中的营养因子刺激胰岛素释放。GLP-1分泌增加意味着人G蛋白偶联胆汁酸受体1(G protein-coupled bile acid receptor 1,GPBAR1)可能被激活。GPBAR1是一种由BA激活的G蛋白偶联受体,在胆囊上皮细胞、胆囊平滑肌细胞和肠L细胞中表达。GPBAR1激活伴随腺苷酸环化酶(adenylate cyclase,AC)激活,进而激活环磷酸腺苷(cyclic adenosine monophosphate,cAMP)、蛋白激酶A(rotein kinase A,PKA)和下游信号通路,从而改善胰岛素敏感性。
2型糖尿病的发生与代谢紊乱有关。食用富含多酚的食物可以调节BAs分泌,影响肠道微生物组成,并改变BAs特征。食物来源的酚酸化合物,包括油酸、桦木酸和熊果酸,激活TGR5以诱导GLP-2释放并改善肠道适应性反应。油酸、桦木酸和熊果酸被认为是TGR5激动剂。
2.3 肠道细菌通过降解支链氨基酸预防2型糖尿病支链氨基酸是影响细胞代谢、氨基酸转运、蛋白质周转、基因表达和线粒体生物发生的必需氨基酸,主要包括亮氨酸(Leu)、异亮氨酸(Ile)和缬氨酸(Val)。支链氨基酸促进肌肉纤维吸收血糖和调节胰岛素信号。2型糖尿病患者的血浆支链氨基酸水平较高,这与胰岛功能受损的严重程度有关。胰岛素作用受损导致BCAA降解失调。肌肉中糖酵解减少和脂肪酸氧化增加导致烟酰胺腺嘌呤二核苷酸(NADH)和酰基辅酶A的过量产生,并损害BCAA转氨。此外,调节BCAA催化剂的酶的活性降低,例如支链氨基酸转氨酶(branched-chain amino acid transaminase,BCAT),支链酮酸脱氢酶复合物(branched-chain ketoacid dehydrogenase complex,BCKDC)和支链α-酮酸脱氢酶激酶(branched-chain alpha-ketoacid dehydrogenase kinase,BCKDK),导致产生过量的NADH,酰基辅酶A和酰基肉毒碱,这将导致更高水平的循环BCAA,从而促进胰岛素抵抗。
肠道微生物参与BCAA的生物合成和降解。营养丰富的膳食组成决定了肠道微生物的组成,并影响支链氨基酸及其发酵产物对宿主的有用性。富含蛋白质的饮食有助于增加降解BCAA的肠道微生物的丰度。同样,富含蛋白质的饮食也会导致BCAA代谢物的增加和粪便中SCFA的减少。支链氨基酸代谢物,如异戊酸和异丁酸,是全身葡萄糖和脂质代谢的潜在调节剂。异丁酸和异戊酸增加肝细胞中的肝细胞生成,激活雷帕霉素化合物1/核糖体蛋白S6激酶1(mammalian target of rapamycin compound 1/ribosomal protein S6 kinase 1,mTORC1/S6K1)的哺乳动物靶标,并保护肠屏障,反过来又可以改善上皮细胞的通透性。
补充支链氨基酸不仅刺激肌肉蛋白质合成,而且提高胰岛素敏感性,从而防止肌肉损失并改善全身代谢状态。然而,体外模型实验发现,增加支链氨基酸的摄入会加重高脂饮食诱导的糖脂代谢紊乱。膳食常量营养素的组成决定了肠道植物群合成支链氨基酸的丰度。在高脂诱导的糖尿病大鼠中,肠道微生物群中编码BCAA合成的基因显著上调,而胰岛素抵抗患者中编码BCAA分解代谢酶(如BCAT-2、BCKDC和BCKDK)的基因表达水平通常下调。机械上,BCAA激活mTORC-1和mTORC-2信号以抑制AKT 2激活和泛素-蛋白酶体依赖性降解。AKT2磷酸化通过促进固醇调节元件结合蛋白1/胰岛素诱导基因2a(sterol regulatory element binding protein 1/insulin-inducible gene 2a,SREBP1/INSIG2a)信号通路抑制FoxO1表达,减少脂质生成,并促进脂质蓄积。
膳食BCAA摄入诱导胰岛素和GLP-1的分泌,同时直接刺激胰腺细胞分泌胰高血糖素。丝瓜(Luffa cylindrica)多酚降低了饮食诱导的糖尿病小鼠中较高的循环BCAA水平,并上调了BCAA分解代谢酶(BCAT和BCKDK)的组织特异性表达,同时选择性地降低了产生BCAA的肠道微生物的相对丰度。
2.4 脂多糖(lipopolysaccharides,LPS):炎症诱导剂LPS被认为是饮食、炎症、肥胖和代谢紊乱之间的媒介。LPS是革兰氏阴性菌先天免疫的重要组成部分,主要是S型和R型,其通过O-抗原部分的存在来区分。LPS不仅与LPS结合蛋白(LPS binding protein,LBP)的N端物理结合,还与膜CD14和骨髓分化因子2/Toll样受体4(membrane CD14 and bone marrow differentiation factor 2/Toll-like receptor 4,MD2/TLR4)受体复合物结合,进一步调节NF-κB通路,促进促炎因子分泌,加剧肝脏炎症,导致巨噬细胞募集。
在炎症发展过程中,糖酵解代谢的变化导致巨噬细胞中ROS的过度产生,从而招募M1样促炎巨噬细胞。巨噬细胞以经典(M1)或非经典(M2,交替激活)方式激活。M1型促进IL-12、IL-23和一氧化氮(NO·)的产生,从而加剧炎症反应。在炎症反应结束时,表型从促炎性M1转变为抗炎性M2,以防止炎症性疾病的后续进展。食物来源的多酚具有抗炎特性,其通过减少关键自由基信号分子如ROS和NO·的产生,抑制促炎因子的产生来影响巨噬细胞的M1-M2极化,从而减轻炎症反应。此外,脂肪组织巨噬细胞产生IL-10,其与胰岛素合作以抑制餐后肝脏中的葡萄糖产生,而该机制仍需要深入探索。
3 食物来源的多酚通过调节信号通路和控制酶活性来缓解2型糖尿病食物来源的多酚可以通过清除活性氧、螯合金属离子、调节酶活性和调节细胞信号传导途径来预防或减轻2型糖尿病。3.1 抑制α-葡萄糖苷酶和α-淀粉酶活性控制餐后血糖浓度α-淀粉酶和α-葡萄糖苷酶水解过量的膳食碳水化合物会导致血糖异常升高。2型糖尿病的有效控制是通过抑制这两种酶的特性来实现的,以延长碳水化合物的消化和减少葡萄糖的吸收。消化酶抑制剂,如阿卡波糖,用于降低餐后血糖,但有腹泻和恶心等不良反应。多酚被认为能抑制α-淀粉酶和α-葡萄糖苷酶的水解活性,从而缓解餐后高血糖症状。
酚类物质通过抑制α-葡萄糖苷酶的活性降低血糖水平(中位抑制浓度从(0.10±0.08)~(0.50±0.03)mg/mL;芦丁、阿魏酸、儿茶素和表儿茶素的中位抑制浓度分别为0.188、0.301、0.387、0.397 mg/mL,和α-淀粉酶(中位抑制浓度从(1.10±0.08)~(2.60±0.07)mg/mL;儿茶素、表儿茶素、山柰苷、阿魏酸和芦丁的中位抑制浓度分别为1.189、1.215、1.658、1.75、1.865 mg/mL)。基于分子对接研究发现,这些多酚化合物与α-葡萄糖苷酶和α-淀粉酶中的相应残基相互作用,并很好地整合到α-葡萄糖苷酶和α-淀粉酶受体的疏水口袋中,从而抑制酶促反应,降低碳水化合物的水解和血糖水平。
在另一个体外消化实验中,砂苋(Allmania nodiflora)的酚类提取物对α-葡萄糖苷酶和α-淀粉酶均表现出中等抑制率。此外,用初始速率与底物之间的动力学反应来描述酶抑制机理。砂苋酚类提取物抑制胰腺α-淀粉酶的分子机制为非竞争性抑制,而对α-葡萄糖苷酶的抑制机制在提取物未消化时为竞争性抑制,消化后为非竞争性抑制。菜籽油酚类提取物(辛酸、芸苔素和芸苔素二聚体)抗葡萄糖的可能机制包括对α-葡萄糖苷酶的非竞争性抑制和对α-淀粉酶的竞争性抑制,甚至通过氢键、疏水性或π-π相互作用,从而减少α-淀粉酶/α-葡萄糖苷酶的水解。此外,瓜拉纳(Paullinia cupana)酚提取物抑制人胰腺α-淀粉酶的能力显示为阳性且呈剂量依赖性。这些发现为酚类化合物对α-淀粉酶和α-葡萄糖苷酶的调节提供了有价值的信息,并支持了食物多酚作为降血糖产品的功能。上述研究均为体外研究,由于体内和体外存在一定差异,因此体内多酚产生的相同机制还需要进一步的实验。
3.2 抑制二肽基肽酶IV(dipeptidyl peptidase IV,DPP-IV)加重低血糖DPP-IV是一种丝氨酸蛋白酶,在上皮细胞、血管内皮细胞和免疫细胞如T淋巴细胞、B淋巴细胞和自然杀伤(natural killer,NK)细胞的表面上表达。DPP-IV通过控制炎性细胞因子和趋化因子来调节免疫和炎症反应。DPP-IV还通过降解GLP-1增加餐后血糖水平。食源性多酚作用于DPP-IV的活性口袋并减弱其对GLP-1的降解,从而增加GLP-1的水平并有助于降低血糖水平。
分子对接技术用于寻找抑制DPP-IV活性的天然酚类化合物。结果发现,姜黄素、丁酸和白藜芦醇在浓度10 μmol/L时对细胞生长均有抑制作用,抑制率依次为50%、30%和28%。姜黄素(抑制率50%)的抑制作用明显强于阳性对照组。姜黄素直接占据酶的10 个活性位点,并竞争性抑制DPP-IV。此外,这些化学物质与DPP-IV结合的主要方式是氢键,偶尔是原子力。
葡萄籽中的原花青素可通过下调DPP-IV基因的mRNA表达来维持葡萄糖稳态,从而抑制DPP-IV酶活性或增加血浆胰岛素/葡萄糖比率。甘草查尔酮A,来自甘草菲施根,抑制DPP-IV活性,表现出极好的降血糖作用,对糖尿病肾病有保护作用。甘草查尔酮A结构中4位和5位氯原子上的羟基是发挥DPP-IV抑制作用的关键结构。此外,在3'-位的硝基也改善了DPP-IV抑制作用和线粒体功能。
3.3 抗氧化和抗炎机制持续的高血糖水平促进氧化应激,进一步触发促炎级联反应和胰岛素抵抗,并导致葡萄糖和脂质代谢紊乱和胰腺β细胞功能障碍。此外,IκB激酶/NF-κB(IKK/NF-κB)通路被过量ROS激活,激活的IKK直接磷酸化胰岛素受体底物(IRS)的Ser307残基,从而削弱胰岛素下游信号传导。IKK的激活可恢复NF-κB的转录活性,从而促进TNF-α、IL-6和细胞因子信号传导抑制剂3(SOCS3)等基因的表达,这涉及Janus激活激酶/信号转导(JAK/Stat)信号传导途径的激活和胰岛素抵抗。然而,JAK/Stat通路通过促进促炎因子的表达反向激活IKK/NF-κB,从而触发胰岛素抵抗、氧化应激和炎症。基于高血糖、炎症和2型糖尿病及其并发症之间的联系,控制炎症反应被认为是一种有效的策略。强烈建议摄入富含多酚的食物,以清除体内的活性氧,从而有助于保持氧化还原状态的平衡,预防糖尿病及其并发症。300 mg/kg的花青素显著下调JAK2/Stat3/5B和IKK-β/NF-κB p65信号通路转导,同时通过促进葡萄糖转运蛋白4(glucose transporter 4,GLUT-4)表达和GSK-3β磷酸化改善2型糖尿病小鼠的肝脏葡萄糖代谢。在Caco-2人结直肠腺癌/U937人组织细胞淋巴瘤细胞模型中,咖啡叶提取物,主要是5-咖啡酰奎宁酸(5-CQA)、表儿茶素、芦丁和芒果素,通过抑制TNF-α、IL-1β和IL-8的产生表现出抗炎作用。酚类化合物通过抑制Caco-2人结直肠腺癌/U937人组织淋巴瘤细胞模型中Val、Leu和Ile的表达来抑制BCAA和IL-8的产生。这些化合物通过调节U937巨噬细胞中的免疫代谢(包括氨基酸和碳水化合物)以及能量代谢来改善炎症。此外还发现,5-CQA、芒果苷和表儿茶素在无细胞培养基中培养24 h时容易降解,而芦丁的浓度保持不变,这可能归因于化合物在体外和体内的降解和代谢。在另一项研究中,黑桑葚酚类提取物通过抑制TNF-α和IL-6的表达,抑制TLR4/NF-κB通路,改善慢性炎症诱导的胰岛素抵抗,从而促进肝脏葡萄糖吸收和糖原合成。3.4 抑制晚期糖基化终产物
在美拉德反应结束时,蛋白质中的赖氨酸和精氨酸侧链与1,2-二羰基化合物联合收割机结合形成氨基酸衍生物,称为晚期糖基化终产物(advanced glycation end products,AGEs)。AGEs按来源分为内源性和外源性两大类。前者是指摄入高糖饮食,导致糖代谢异常或脂质过氧化。后者通过饮食直接进入体内,主要是通过热加工过程中食品中脂肪酸和氨基酸的自氧化作用。AGEs与RAGE结合以激活MAPK、磷脂酰肌醇-3激酶(phosphatidylinositol-3-kinase,PI3K)和JAK/STAT信号通路,促进烟酰胺、腺嘌呤二核苷酸磷酸氢盐(NADPH)和ROS的产生,并诱导促炎因子、单核细胞趋化蛋白-1(monocyte chemotactic protein-1,MCP-1)和环氧合酶-2(cyclooxygenase-2,COX-2)的表达,从而引起炎症反应。此外,持续的高血糖导致蛋白质和脂质的非酶糖基化,形成AGEs并刺激β受体的活化。AGEs本身催化ROS的形成,并在AGEs积聚的部位刺激氧化应激和炎症。在这种情况下,AGEs抑制内皮NO合酶的表达,并刺激活性中间体和有毒产物的产生,如过氧亚硝酸盐,NO和超氧阴离子。食源性多酚具有抗氧化和抗炎作用,其抑制AGE诱导的炎症反应的机制主要归因于金属螯合,抑制ROS,将电子转移到自由基,以及抗氧化酶的活化。在高血糖的背景下,葡萄糖代谢加速甲基乙二醛(methylglyoxal,MGO)等反应性二羰基化合物的异常积累,导致氧化应激和炎症反应.基于上述分析,食源性多酚、微生物和2型糖尿病之间的相互作用可分为3 种机制,包括1)在2型糖尿病伴肠道植物群紊乱时,食源性多酚干预改善肠道植物群,恢复肠道屏障,缓解2型糖尿病;2)肠道微生物将未消化的食物来源多酚代谢成微生物代谢物,以产生控制炎症反应或免疫系统的生理功能,从而减轻2型糖尿病;3)食物来源的多酚通过调节宿主信号传导途径影响肠道微生物组组成,从而缓解2型糖尿病(图3)。食用多酚含量高的食物是治疗2型糖尿病的推荐做法,此外还表明,可以基于食物来源的多酚创造具有降血糖作用的功能性食品和膳食补充剂。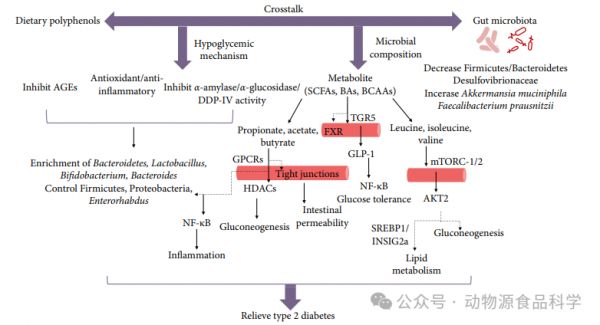
图3食物来源的多酚、肠道微生物和 2 型糖尿病之间的关系
4 食物来源的多酚的生物利用度:限制其在2型糖尿病中临床应用的因素如前所述,食物来源的多酚具有抗氧化和抗氧化特性,可以缓解2型糖尿病。然而,这些化合物具有差的稳定性并且易于降解,这降低了它们的生物利用度和生物活性。酚类化合物的理化性质、聚合等级、与蛋白质等物质的相互作用,以及在肝脏和肠道代谢后的吸收对其有益效果产生影响。为降低这些限制并保持结肠吸收活性成分的能力,应该开发适当的保护机制。
生物活性多酚的胶囊化增强了多酚的水溶性、物理和化学稳定性、肠道吸收和生物利用度。多酚通过与蛋白质相互作用显着保持其生物利用度,从而保护它们免受消化道降解并提高其降血糖能力。C3G通过降低总胆固醇和甘油三酯水平以及提高高密度脂蛋白水平来控制2型糖尿病的发展。然而,C3G分子结构中的糖苷键是可断裂的,使得其在碱性环境中容易降解,导致较差的稳定性和生物利用度。乳源性酪蛋白具有开放的流变结构,并通过疏水键和盐桥重组成胶束结构。C3G与酪蛋白通过疏水相互作用形成纳米颗粒,显著提高了C3G的稳定性。该复合物降低了肥胖小鼠的体质量和脂肪含量,从而稳定了脂质水平并防止了肝损伤。此外,该复合物通过降低厚壁菌门与拟杆菌门比例来减轻肥胖小鼠的肠道疾病。然而,研究没有比较C3G复合物与仅含C3G的饮食的干预效果。
多酚通过配位与金属离子形成金属-酚网络,以提高其稳定性和生物利用度。姜黄素通过清除ROS,激活核因子红细胞-2相关因子2(Nrf2)和抑制促炎因子的产生来增强抗氧化能力。然而,姜黄素已被证明在生理环境中无效吸收,并且由于其不令人满意的水溶性和易于降解而限制了临床应用。基于锌离子的金属骨架配位姜黄素形成的化合物显示出显著的ROS清除(清除率93.10%),激活Nrf2及其相关的抗氧化基因,抑制炎症因子的mRNA表达。此外,它还能抑制基质金属蛋白9(MMP9)的过表达,抑制NF-κB信号通路,促进I型胶原α2(COL1A2)和III型胶原α1(COL3A1)表达,从而促进糖尿病伤口的胶原再生和重塑。COL1A2和COL3A1是I型胶原和III型胶原的基因,促进胶原合成,修复血管或在血管损伤期间愈合伤口。
酚类物质的生物利用度可以通过包封来提高,这确保酚类化合物在到达靶组织之前不会失去其母核结构。然而,为了评估这种策略的有效性,需要进一步的临床研究,因为纳米颗粒的表征和基质会影响多酚的生物效应。此外,控制摄入酚的浓度也很重要,因为高剂量的多酚作为促氧化剂,可引起副作用,如肾毒性和肝毒性,导致结肠炎和结肠癌的发作。为确定摄入这些化学物质的可接受浓度限度,强调临床研究的必要性至关重要。
Conclusion探究食物来源多酚和微生物组研究在优先考虑饮食、微生物及其代谢产物方面极具价值。通过建立一个可行的实验系统,可以加强正在进行的临床观察和干预研究,提供候选生物标志物和治疗靶点,充分阐明三者之间的因果关系。此外,对这种串扰进行更深入的实验解剖也至关重要,因为对这些机制的深入了解为跨学科的跨系统研究奠定了基础。本研究调查了食物来源的多酚干预对2型糖尿病的影响。研究发现,食物来源多酚干预2型糖尿病的发病机制主要是由肠道微生物介导的,这是通过重塑肠道微生物种群多样性和控制炎症反应来实现的。此外,食物来源的多酚控制2型糖尿病发作的机制还包括改变肠道微生物组的组成,抑制DPP-IV和碳水化合物代谢酶,并最大限度地减少胰岛素抵抗和AGEs的产生。食源性多酚在2型糖尿病的控制中具有良好的治疗潜力和开发价值。然而,微生物组概况、食物偏好和宿主代谢状态之间的个体差异,微生物组和食物来源多酚之间的可能作用位点和相互作用模式,以及食物来源的多酚的长期健康影响仍有待探索。代谢组学和微生物组需要进行深入分析,以推进和清楚地了解它们的复杂性和相互联系。然而本文主题和研究并不详尽,后续研究应继续扩展所涉及的相互关系,并增加和完善分类。Abstract
Food-derived polyphenols and their effects on type 2 diabetes are linked to the microbiota. Here, we expound on the mechanisms of food-derived polyphenols that affect the onset of type 2 diabetes, focusing on the roles played by gut microorganisms and the metabolites they produce. We also discuss the mechanism of food-derived polyphenols lower blood glucose through host signaling-mediated inflammatory responses. Food-derived polyphenols alleviate the development of type 2 diabetes by remodeling gut microbiome composition and reducing inflammatory responses. Food-derived polyphenols inhibit the activity of α-glucosidase, α-amylase, and dipeptidyl peptidase IV enzymes to reduce postprandial blood glucose levels. The nuclear factor kappa-light-chain enhancer of activated B cells (NF-κB) is considered a key regulator of food-derived polyphenols in alleviating the onset of type 2 diabetes. Inhibition of NF-κB activation can increase insulin sensitivity, reduce inflammation, and maintain glucose homeostasis. This investigation reveals that food-derived polyphenols can alleviate the onset of type 2 diabetes and offers adequate theoretical knowledge in support of their usage as such.
作者介绍 贾 玮 教授陕西科技大学食品科学与工程学院
贾 玮 教授陕西科技大学食品科学与工程学院博士,陕西科技大学教授,博士生导师。主要从事基于多维组学的食品安全高灵敏度甄别和溯源研究。获陕西省青年拔尖人才、陕西省青年科技新星、陕西高校青年杰出人才。作为项目负责人承担国家自然科学基金(面上项目、青年项目)、国家重点研发计划子课题、陕西省重点产业创新链项目。主持/参与制定国际AOAC/国家/地方食品安全标准16 项。以第一/通信作者发表SCI收录论文98 篇,ESI高被引论文11 篇,热点论文2 篇。兼任Food Science of Animal Products、《分析测试学报》《质量安全与检验检测》等国内外期刊编委。为20余家重点产业链企业发展提供技术服务。


相关知识
贾玮教授:食源性多酚对2型糖尿病的有益作用:基于肠道微生物群变化
驼乳源益生菌对db/db鼠肠道菌群的调节作用
茶多酚对肠道微生物的研究
Science丨化学学院雷晓光教授与合作者发现肠道菌群调控二型糖尿病的新机制与化学干预新方法
综述丨ANTIOXIDANTS: 肠道菌群对大脑衰老的影响: 多酚作为有益调节剂
肠道菌群调节糖尿病患者的远端对称性多发性神经病变研究进展
蛋白质基于调节肠道微生物群的健康作用研究进展
香港大学教授贾伟:代谢组学推动健康食品现代化
茶多酚对肠道微生物的调节作用研究进展
基于2型糖尿病模型探究茶渣膳食纤维与其结合多酚血糖调控效应的相互影响
网址: 贾玮教授:食源性多酚对2型糖尿病的有益作用:基于肠道微生物群变化 https://m.trfsz.com/newsview1432909.html